您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-07 15:26
01抗体偶联药物
抗体偶联药物(antibody-drug conjugate,ADC),这个概念最早在100 年前便由德国医生和科学家保罗·埃利希(Paul Ehrlich)提出。ADC是一种将小分子细胞毒素药物(cytotoxin)通过连接子(linker)与单克隆抗体偶联形成的药物,既有抗体的高靶向性又可以有化学药物的强杀伤力,因此也被称之为“生物导弹”。随着单克隆抗体药物的蓬勃发展,这种新型抗癌药物慢慢进入人们的视野并逐渐成为今天的发展热点。自2000年,第一个ADC 药物MylotargR用于治疗CD33阳性急性髓系白血病被美国食品和药物管理局(FDA)批准以来,全球共有12个ADC获批上市,其中包括今年由中国本土公司荣昌生物研发并在中国上市的爱地希(Disitamab gedovin)[1]。在过去十年,ADC研发的速度显著加快,至今有80多个正在临床试验中[2]- [5]。
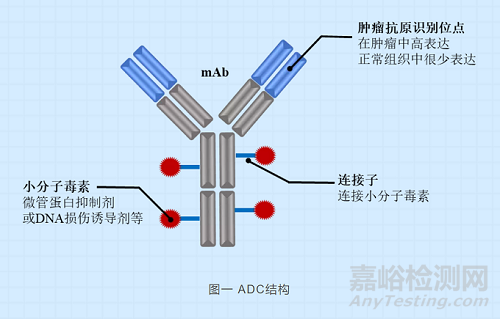
图一 ADC结构
02 抗体偶联药物的作用机制
正常状态下,ADC药物进入体内后,抗体部分与表达肿瘤抗原的靶细胞特异性结合,通过内吞作用内化进入细胞,经过内吞小体进入溶酶体,溶酶体的酸性环境和一些蛋白水解酶会致ADC降解,小分子细胞毒在胞内以高效活性形式被释放随后进入细胞质,从而破坏DNA或通过抑制微管合成等方式,完成对肿瘤细胞的杀伤作用,见图二[6]。因此,与传统的小分子化学药物以及抗肿瘤单抗相比,ADC药物不仅可以提高化学治疗的疗效和肿瘤细胞的特异性,而且可以降低或者减弱系统毒性以及非靶向性细胞毒性,但由于ADC自身所具有的特殊结构和复杂多样性,使得在临床前的药代动力学研究、安全性评价以及临床阶段,其分析方法的复杂性就变得异常重要。主要原因是由于随着ADC进入体内后,其连接的小分子毒素会逐渐解离下来会形成多样化且可能动态变化的DAR值(药物-抗体比,drug-to-drug ratio)分布,同时还有可能出现与小分子毒素相关的代谢产物,而DAR值是重要的药效和毒性评价指标。针对这个过程中不同类型的分析物,我们需要根据实验需要选择不同的分析平台来完成检测目的。
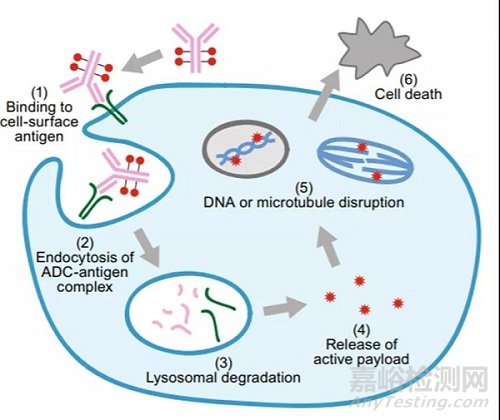
图二 ADC药物作用机制
03抗体偶联药物的分析策略
根据ADC的作用机制,ADC在体内会产生多种成分,主要包括完整的ADC、总抗体(DAR大于等于0)、游离的小分子毒素以及毒素相关的代谢产物。而由于进入体内这个动态变化的过程以及ADC独特的结构特征,会进一步增加诱发机体的免疫反应而形成抗药抗体的风险,不仅因为单抗可以作为抗原引发免疫反应,连接子或连接子-细胞毒素也可以作为半抗原引发免疫反应[7]。目前,对于ADC、总抗以及抗药抗体多采用LBA平台,对于小分子毒素以及相关的则主要是LC-MS/MS平台;而对于研究者们,在研究ADC药物理化性质方面,DAR则其重要的研究对象,一般可以采用光谱测定法[8]、色谱-紫外测定法[9]、质谱法等进行[10]。
3.1 ADC的测定
3.1.1 LBA平台ADC的测定
对于ADC浓度的测定,多采用LBA (Ligand Binding Assay)平台的ELISA(酶联免疫吸附法)进行检测。对于ELISA方法,通常固相载体表面包被捕获试剂,如靶点抗原、互补决定区(complementarity determining region, CDR)单克隆抗体等,通过抗毒素抗体检测。对于ECL方法,原理和ELISA类似,目前主要由基于MSD (Meso Scale Discovery) 公司的开发的超敏多因子电化学发光分析仪,其较ELISA通常具有更高的灵敏度和更宽的检测范围。但并非仪器决定了方法的灵敏度,LBA平台的灵敏度和准确度主要取决于所用试剂的亲和力大小以及ADC药物本身的载药量。
针对目前火热的ADC靶点如Her2、Trop-2、Claudin 18.2等,药明康德生物分析部大分子团队均有针对相关靶点成功开发方法的经验,并已赋能多个客户的方法学验证和临床前安全性评价及临床试验的样本分析。
3.1.2 LC-MS/MS平台ADC的测定
随着LC-MS/MS分析技术的广泛应用,免疫亲和捕获LC-MS/MS开始用于抗体的测定。通常分为三个步骤[11],第一步是免疫捕获,相当于传统 LBA平台的第一步,第二步是酶切或消化,最后一步是 LC 分离和 MS/MS 检测。与 LBA平台一样,可以使用各种特异性捕获试剂,包括靶抗原、抗Id 抗体或抗有效载荷抗体。同时Protein A/G 也可作为通用捕获试剂,因为可以结合IgG Fc段。然后将其生物素化抗体可固定在链霉亲和素包被的磁珠或小柱上。在随机偶联 ADC 的情况下,可以使用组织蛋白酶-B 进行酶消化来释放有效负载的小分子毒素,或通过胰蛋白酶消化以生成特征肽段[12],然后通过 LC–MS/MS定量检测。
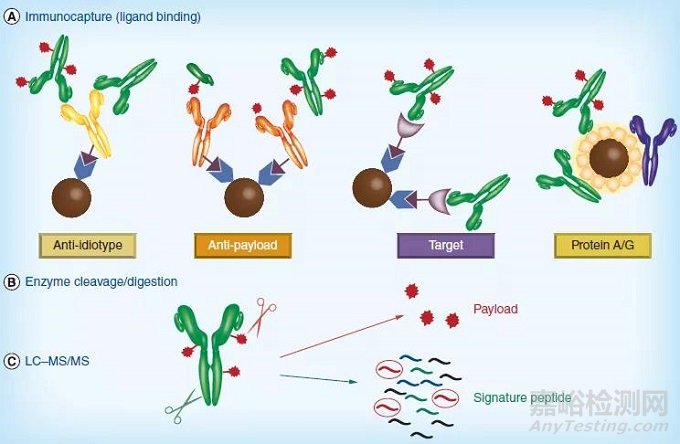
图三 LB-LC-MS/MS步骤
(A. 免疫捕获;B. 酶切或消化;C. LC-MS/MS定量)
目前药明康德生物分析团队已基于LC-MS/MS平台建立通用性和特异性的ADC分析方法,检测下限低至50 ng/mL,已赋能多个ADC的检测。
3.2 总抗的测定
3.2.1 LBA平台总抗体的测定
总抗体是指DAR≥0的抗体,用于评估ADC药物是否具备单克隆抗体一般PK特性。对于总抗体检测,通常采用包被靶点抗原或抗CDR区单克隆抗体的方式进行捕获,再根据抗体的种属性,用酶标的抗同种属IgG作为检测抗体。这种传统的ELISA方法,技术较成熟,因此应用范围较广。而对于专属性试剂难以获取时,尤其时前期候选药物筛选阶段,可以考虑通用型分析方法,即捕获试剂和检测试剂均为抗人IgG抗体,这种分析模式从成本和时间角度更具优势,一般不建议用于临床申报和临床样本分析。
3.2.2 LC-MS/MS平台
此方法检测的原理同前面ADC药物检测,目前药明康德生物分析部已建立通用型总抗体检测的方法,图四。该方法是通过免疫磁珠捕获的方法对待测样本进行富集,然后通过还原、烷基化、酶切法水解,得到其具有专属性的肽链,同时使用稳定同位素标记的内标肽对其进行定量分析。方法检测下限低至50 ng/mL,目前该方法已应用于至少10 ADC候选药物总抗体的测定。
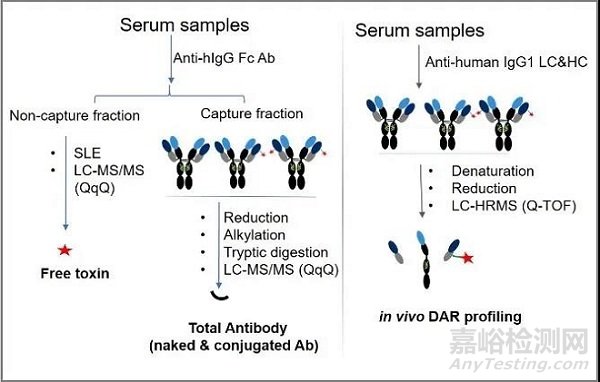
图四 LC-MS/MS平台针对三种待测物的分析策略
(从左至右依次为游离小分子毒素、总抗体、DAR值分析)
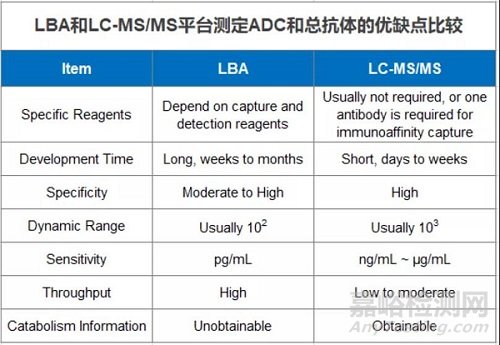
药明康德生物分析部致力于多平台联动,提供卓越的生物分析服务。针对ADC药物,ADC药物和总抗体的检测,LBA和LC-MS/MS平台各有千秋,如下表,客户可以综合测定需求和研究目的,有针对性的选择检测平台。
3.3 小分子毒素以及毒素相关的代谢产物测定
ADC药物进入体内后,小分子毒素存在两种不同形式,即游离的小分子毒素和带有连接子和/或氨基酸残基的小分子。一般采用常规蛋白沉淀的方法进行定量分析,也可以使用竞争ELISA方法。其中LC-MS/MS平台可以对结构类似物能进行有效区分,方法较LBA更简单高效,同时更重要的是可以同时监测/检测代谢产物的水平。如果需要对活性代谢产物进行绝对定量,则需要提前对代谢产物进行鉴定并制备其标准品。
基于LC-MS/MS平台,目前生物分析部已建立ADC药物常用小分子毒素的检测方法,如MMAE、MMAF、DM1、DM4等,结合该平台ADC和总抗体检测方法,大大缩减了前期方法开发的时间。
3.4 DAR值测定
DAR是描述ADC药物的一个重要理化参数,它决定了小分子药毒素的载荷量,同时影响药物的安全性和有效性。每个抗体具有多个Lys/Cys位点,所以,ADC的DAR值可以是0至8,但并非DAR值越大,体外药效越好,一般认为DAR值大于4,越高稳定性越差。主要原因可能由于小分子毒素的数量和疏水作用的增加会使得ADC非特异性的疏水作用增加而变得不稳定,因此这也对ADC药物的安全性和有效性提出了挑战。
具有不同DAR的ADC其绝对分子质量是不同的,因此可以据此词用质谱法对DAR进行分析。虽然DAR值测定有多种方法,但因为质谱较光谱法和色谱-紫外法,具有更高的灵敏度、特异性和准确性,因此质谱法具有更大的优势。药明康德生物分析团队借助高分辨质谱飞行时间分析器(Q-TOF)对DAR值进行准确测定,目前已赋能服务多个客户。
3.5免疫原性分析
与常规单克隆抗体一样,ADC 作为蛋白药物,具有免疫原性。同时由于偶联引入了新的抗原表位,ADC 药物有可能诱导机体产生更为复杂的免疫反应,从而可能影响药物的有效性和安全性。针对ADC药物的临床前免疫原性检测,通常采用LBA平台,常使用基于MSD平台的桥连法(Bridge assay)对其进行半定量检测,捕获试剂为生物素标记的药物,检测试剂为钌标记或地高辛标记的药物。
ADA检测的一般分为三个步骤,①筛选实验,通过筛选割点筛选样本是否为ADA潜在阳性样本;②确认实验,通过确认割点,竞争抑制实验确认潜在阳性样本是否为ADA阳性;③滴度实验,对确认的阳性样本进行滴度分析,确认样本中ADA阳性的程度。
由于ADC结构的特殊性,针对ADC不同表位产生的ADA,可以是ADC分子上3个组分中的任意一个,即抗体部分、连接子或小分子毒素;也可以是它们的复合物。因此,ADC药物的免疫原性分析应分析针对ADC所有成分的反应,尤其是临床阶段,需要针对ADC可能因结合产生的新表位的阳性抗体作为阳性对照,来开发一系列不同表位抗体检测的方法。目前抗药抗体不同表位分析,常采用竞争法或直接检测的方法。结合不同表位分析,可以更好的分析临床阶段可能出现异常的血药浓度降低或一些不良反应事件的发生。
药明康德生物分析团队拥有多个技术平台赋能客户ADC药物,针对不同靶点和不同的检测需求,提供一站式服务。借助药明康德LTD非临床到临床一站式生物分析服务平台,项目可以由苏州和上海生物分析部分别承接临床前和临床分析工作。非临床和临床团队的积极互动,共享分析方法研究的数据和经验,为后续临床生物分析方法的建立奠定了良好的基础。
04结语和展望
不管是资本市场还是药企,近年来,ADC一直是被大家关注的热点之一。根据Nature Reviews Drug Discovery相关评论文章[13],预计到2026年,全球已上市ADC药物的全球销售额将超过164亿美元。在全球范围内,ADC风起云涌。随着ADC药物技术的不断迭代更新,为了克服耐药性以及毒性,研发者们在各个领域继续尝试着改进,如通过新的抗体形式、新的非内化抗原靶点、新的毒素药物和位点特异性偶联方式来促进ADC药物的进一步发展。
随着生物分析领域对于ADC药物研究经验的不断积累,以及新的分析技术的涌现,将为ADC药物血药浓度以及免疫原性研究提供更广阔的思路,和更精准高效的分析检测,这也将推动全球精准医疗事业的蓬勃发展。
参考文献:
1. Haiyong Peng, Perspectives on the development of antibody-drug conjugates targeting ROR1 for hematological and solid cancers. Antibody Therapeutics, 2021, Vol. 4, No. 4 222–227.
2. Walsh, SJ, Bargh, JD, Dannheim, FM et al. Site-selective modification strategies in antibody-drug conjugates. Chem Soc Rev2021; 50: 1305–53.
3. Drago, JZ, Modi, S, Chandarlapaty, S. Unlocking the potential of antibody-drug conjugates for cancer therapy. Nat Rev Clin Oncol 2021; 18: 327–44.
4. Dean, AQ, Luo, S, Twomey, JD et al. Targeting cancer with antibody-drug conjugates: promises and challenges. MAbs 2021; 13:1951427.
5. Jin, Y, Schladetsch, MA, Huang, X et al. Stepping forward in antibody-drug conjugate development. Pharmacol Ther 2021; 107917: 107917–40.
6. Kyoji Tsuchikama&, Zhiqiang An. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell 2018, 9(1):33–46.
7. Carrasco-Triguero, Montserrat. Montserrat Insights on the immunogenicity of antibody-drug conjugates. July 2015 Bioanalysis 7(13):1565-1568.
8. HAMBLETT KJ,SENTER PD,CHACE DF,et al.Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate [J]. Clin Cancer Res, 2004, 10 (20):7063.
9. Yutaka Matsuda, Monica Leung, et al. A Purification Strategy Utilizing Hydrophobic Interaction Chromatography to Obtain Homogeneous Species from a Site-Specific Antibody Drug Conjugate Produced by AJICAP First Generation. Antibodies 2020, 9, 16.
10. WAKANKAR A, CHEN Y, GOKARN Y, et al. Analytical methods for physicochemical characterization of antibody drug conjugates [J]. MAbs, 2011, 3 (2): 161.
11. Jian Wang, Huidong Gu, et al. Antibody–drug conjugate bioanalysis using LB-LC–MS/MS hybrid assays: strategies, methodology and correlation to ligand-binding assays. Bioanalysis (2016) 8 (13), 1383–1401.
12. Wang Y, Heilig JS. Differentiation and quantification of endogenous and recombinant-methionyl human leptin in clinical plasma samples by immunocapture/mass spectrometry. J. Pharm. Biomed. Anal. 70, 440–446 (2012).
13. Carolina do Pazo, Khurram Nawaz & Rachel M. Webster. The oncology market for antibody–drug conjugates. Nature Reviews Drug Discovery 20, 583-584 (2021)

来源:Internet


