您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-24 16:13
ISO 10993-1:2003第3章中规定,在选择器械制造材料时,首要的考虑是材料宜适合于器械的使用目的,即考虑材料的表征和性能,其中包括化学、毒理学、物理学、电学、形态学和机械性能。进行生物学评价之前,有必要获取这些信息。化学信息,包括与医疗器械或其材料的结构、组成和生产有关的定性和定量的知识,这些知识可用于确定材料和器械中存在的成分和数量。化学表征信息可用于一些重要应用方面:作为医疗器械整体生物安全性的支持性证据;确定在临床使用条件下,可能从医疗器械中浸出的化学物质含量,以支持毒理学风险评估;支持与相同暴露类型的临床器械的等同性;支持最终医疗器械与原型机的等同性,尤其要考虑如材料成分、器械组成、和可沥滤物等信息;筛选产品用于新临床应用的潜在新材料。
那么GB 16886.18-2011材料化学表征到底讲了什么呢?小编已为您梳理出重点内容:
一、GB 16886.18-2011材料化学表征术语与定义
制造商:在器械以其自有名称进入市场之前,对器械的设计、生产、包装和标识负责的自然人或法人,无论这些运作是由其亲自完成还是以其名义由第三方完成。
化学表征:对材料的鉴别和存在于材料或成品医疗器械中的化学物的定性与定量。
极限浸提:随后的浸提至浸提液中残留物量小于首次浸提液中10%检出量的浸提。
模拟浸提:系指采用适宜介质并模拟产品使用的浸提方法, 用于评价器械常规应用期间对病人或使用者潜在风险。
二、一般原则
对医疗器械制造用材料进行化学表征是评价器械生物安全性过程中的首要步骤, 同样对判定下列等同性也十分重要:
a)拟用材料与临床已确立材料,和
b)原型器械与最终器械。
本部分附录A综述了本部分所描述的化学表征步骤及其与风险分析的关系。
应取得定性数据来描述材料的化学组分,如涉及到生物学安全性时还应取得定量数据。
对有些材料,组分信息可从材料技术规范中直接获得。像聚合物类的材料可能具有更为复杂的组成, 其组分的详细信息宜从材料的供应商处索取。如果缺少这些信息, 宜采用适当的分析技术分析材料 以获取组分数据。
通过鉴别用于医疗器械制造材料的组分,可以研究出每种组分的内在毒性。预期这些获取的数据可被医疗器械制造商用作医疗器械总体生物安全性评价的一部分,因此重要的是要引入控制,以防止材料供应商改变以特定商品名供应材料的组分,或在事先未通知医疗器械制造商的情况下改变供货合同。
制造商宜评价任何被告知的改变对产品生物安全性的影响。在医疗器械制造过程中使用的任何材料组分或添加剂都具有潜在的生物利用度,因此有必要获取成品在实际使用条件下证实这些组分生物利用度的信息,以评定由此引发的风险。这可以通过材料浸提试验进行评定。
采用适当的浸提条件(模拟浸提),可确保在成品使用中可能释放出的任何组分都将会释放到浸提介质中。对取得的浸提液可进行定性和(或)定量分析,得出的数据可用于医疗器械生物安全性评价。
所需化学表征的范围宜能反映出临床接触的性质与时间,并且应由毒理学风险评价人员根据器械生物学安全评价所需的数据来加以确定,同时还要反映出所用材料的物理形态,如液体、 凝胶、聚合物、金属、陶瓷、合成物或生物源材料。
成功地完成本部分中提出的化学表征需要材料学家、化学分析与毒理学风险评价人员的密切协作。在这种合作关系中,由材料学家和化学分析人员提供必要的定性与定量数据,风险评价人员则利用这些数据来确定器械的安全性。
三、表征步骤
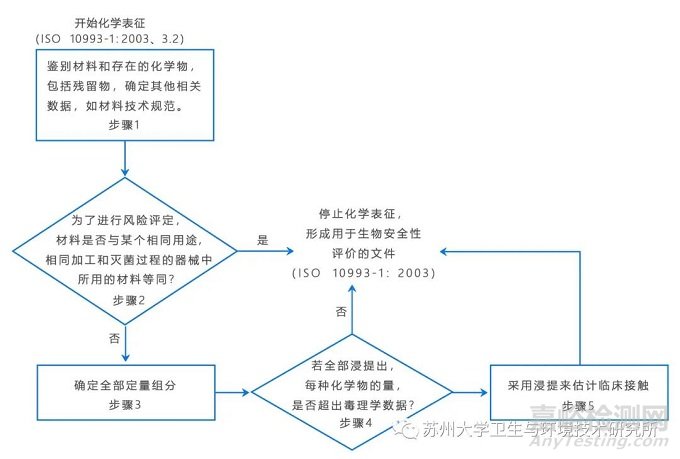
总则:化学表征数据的产生是与风险评价环环相扣循序渐进的过程,流程图见图1。应选择可给出毒理学评价所需信息的分析方法,如果无法确定适用的方法,则应开发适宜的新方法。在开发新方法之前,宜查阅现有的标准、专论、科学论文或其他相关科学文献,看是否有现行的适用试验方法。
步骤:描述材料/器械及其预期目的。需要有一份成品器械组分的有证明文件的定性描述,其中包括器械所用每种材料的添加剂和加工残留物。
步骤1:定性信息,描述材料/器械及其预期目的。需要有一份成品器械组分的有证明文件的定性描述, 其中包括器械所用每种材料的添加剂和加工残留物;
步骤2:材料等同性,应获取充分的定性信息以能对这些数据进行比较, 来确定这种材料是否与一种临床接触/使用相同,并且生产与灭菌过程相同的器械所用材料等同;
步骤3:定量信息,当单靠定性分析不能为完成毒理学风险分析提供充足的数据时,应确定定量化学组分并形成文件;
步骤4:定量风险评定,应取得充分的定量信息,并结合现有的毒理学信;
步骤5:根据预期的临床接触情况,任何一种一定量的化学物如果存在毒理学相关残留物,应测定该化学物的接触程度并估计接触总量。
四、化学表征参数与方法
总则:由于医疗器械具有多样性,要认识到,针对所有或某些器械的应用情况, 一种材料并非需要进行全部的参数鉴别。
聚合物分析参数和试验方法学
金属与合金分析参数和试验方法学
陶瓷分析参数和试验方法学
天然大分子分析参数和试验方法学
五、所得数据报告
应以能使数据登录材料数据库的格式报告数据, 所有定量数据应以可用于人体接触评定的方式提供。
试验报告中应明确说明所进行的化学表征的目的, 适宜时应包括下列信息:
材料详细描述;
分析方法和浸提条件;
得出的定性数据;
得出的定量数据;
化学物临床接触评定。

来源:GB/T 16886.18-2011


