您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-17 21:14
摘要:长效微球制剂作为特殊注射剂的一种,工艺复杂,有较高的技术壁垒,目前国产化品种仅有注射用醋酸亮丙瑞林微球和注射用利培酮微球。微球制剂具有能延长药物作用时间、提高药效、减轻不良反应、提高患者顺应性等优点,经济价值巨大。本研究基于国家药品监督管理局已出台的仿制药一致性评价指导原则,结合剂型特点,从参比制剂选择、处方研究、制备工艺、质量研究、稳定性考察、非临床研究和临床研究等方面,探讨多肽类药物长效微球制剂仿制药研发及评价应重点考虑的事项。
以长效微球制剂为代表的特殊注射剂 ( 微球、温敏凝胶、脂质体、乳剂等 ) 是一种诞生于20世纪末的药物新剂型 [1],在过去30年中诞生了多个“重磅炸弹”产品。我国长效微球制剂的基础研发虽紧跟国际步伐,但因较高的技术壁垒,如制备过程中关键辅料的筛选,工艺不能线性放大,产品质量评估时存在突释效应大、批间差异大、体内外释药模型相关性差等,也因研发及生产成本高、生产设备受制于进口等情况,鲜有产品上市,关键技术依然掌握在欧美日等发达国家手中。现今,我国医药产业处于转型升级进程中,我国药品审评步入新阶段,法规政策频出——新注册分类改革、仿制药一致性评价生物等效性 (BE) 试验备案制、临床60个工作日默许制、我国药品行业标准提升且与国际接轨、国家带量采购等,带来的是仿制药一致性评价研发成本大幅提高而价格大幅度下滑。此背景下,高技术门槛、高附加值的长效微球制剂对于有实力的药企而言,既是机遇又是挑战。
《中华人民共和国药典》2020年版 (ChP 2020)四部通则0102中定义注射剂是原料药或与适宜辅料制成的供注入体内的无菌制剂。注射剂通过直接注射进入血管、组织或器官,不通过人体固有的屏障而直接发挥作用,因而风险高 [2]。而特殊注射剂( 如微球、脂质体、静脉乳、混悬型注射剂、油溶液、胶束等 [3]) 因体内行为受处方和工艺的影响较大,与普通注射剂相比更应关注制剂在体内的安全性和有效性。本研究主要结合已出台的政策法规,特别是已发布的特殊注射剂——盐酸多柔比星脂质体注射液和注射用紫衫醇 ( 白蛋白结合型 ) 仿制药的指导原则,探讨长效微球制剂仿制药研发及评价应重点考虑的事项。
一、已发布的关于一致性评价的法规政策
国家推行仿制药一致性评价工作已逾8年,期间相关政策法规频出。长效微球制剂作为特殊仿制药,其仿制药开发、质量和疗效一致性评价参考政策如表1所示 [4—11]。


二、参比制剂的选择
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物。参比制剂应为处方工艺合理、质量稳定、疗效确切的药品 [12]。截至2021年4月,NMPA已发布仿制药参比制剂目录40批 ;同月,CDE 发布了化学仿制药参比制剂目录( 第四十二批 )( 征求意见稿 )。目前,参比制剂目录中长效微球注射剂有8个品种30个品规,详见表2。在仿制微球制剂时,对于已公示的微球品种,应参考已发布的参比制剂 ;如不适用,则可参考2019年3月NMPA《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号 ) [13],照2020年10月CDE 发布的《关于发布 < 化学仿制药参比制剂遴选申请资料要求 > 的通告》(2020 年第32号 )[14],在“申请人之窗”界面的参比制剂遴选平台提交资料。参比制剂首选原研药品,原研药品选择的顺序依次为:国内上市的原研药品、经审核确定的国外原研企业在我国境内生产或经技术转移生产的药品、未进口原研药品 ;如发生原研药品停产或因质量等原因导致原研药品不适合作为参比制剂的情况,可选择在美国、日本或欧盟等药品管理规范的国家获批上市的国际公认的同种药品、经审核确定的在我国境内生产或经技术转移生产的国际公认的同种药品。
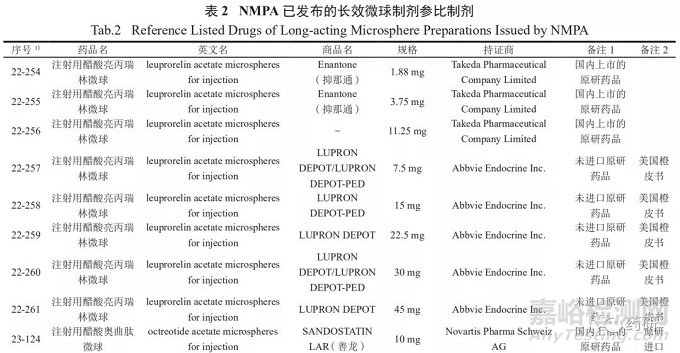
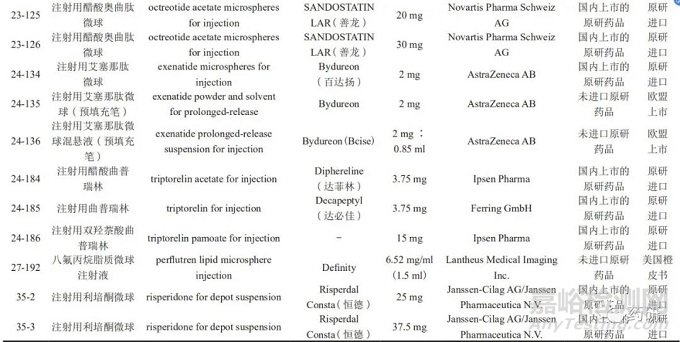
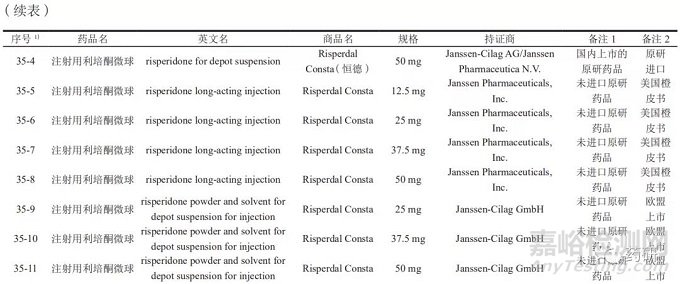

三、已进行仿制药一致性评价的微球制剂品种
国产化的微球制剂品种有注射用醋酸亮丙瑞林微球和注射用利培酮微球Ⅱ。其中,山东绿叶制药有限公司的注射用利培酮微球Ⅱ为2021年1月12日批准上市的2.2 类化药品种。而注射用醋酸亮丙瑞林微球为国内首个上市的微球制剂品种,生产厂家为上海丽珠制药有限公司和北京博恩特药业有限公司,按原注册分类中的化药6类于2009年被批准上市。目前,这2个品种均在开展一致性评价研究。CDE药物临床试验登记与信息公示平台显示,上海丽珠制药有限公司已完成注射用醋酸亮丙瑞林微球的人体生物等效性研究,已于2020年10月15日提交补充申请 ( 仿制药一致性评价 ) ;北京博恩特药业有限公司正在开在该品种的人体生物等效性研究。
四、研究内容
4.1处方研究
仿制药的辅料种类和用量通常应与参比制剂相同,即仿制药辅料用量应为参比制剂相应辅料用量的95%~105%。
聚乙交酯- 丙交酯共聚物(poly lactic-coglycolic acid,PLGA) 无毒、无刺激性、无免疫原性和无致癌作用,生物相容性好,可生物降解且降解彻底,是目前应用最广泛的注射用微球缓释骨架材料[15—16]。PLGA作为长效微球制剂常用的关键辅料,可影响微球制剂的体内溶蚀效果,因此应研究该辅料的结构( 如线形、星形等 )、摩尔比、相对分子质量等质量属性对微球释放的影响。如辅料用量相同时,星形PLGA的载药量较线形PLGA高,更适合制备高载药量品种 ;PLGA 的降解速度随着共聚物中羟基乙酸比例的增高而加快,不同相对分子质量和摩尔比的PLGA在体内的降解速度不同,进而影响微球的体内释放情况。PLGA作为羧基封端的聚合物,具有极性高、亲水性强的特点,在制备多肽蛋白类药物微球时,多肽蛋白类分子的碱性氨基酸阳离子基团可与PLGA的羧基发生相互作用,显著降低药物的突释及释放速度。因此,应通过考察不同类型PLGA制备的微球的成球情况、释放情况,选择与参比制剂相同或相似的辅料。
此外,微球在制备过程中用到但最终被去除的有机溶剂,如与参比制剂存在差异,应阐述理由,并研究证明上述不同不会影响仿制药的安全性和有效性。
4.2制备工艺
微球制备目前常用乳化- 溶剂挥发法、相分离法、喷雾干燥法和膜乳化法 [17]。因制剂工艺复杂,不同的制备工艺参数可导致产品体内外释放行为不同,且同工艺也存在较大的批间差异。在多肽蛋白类药物微球仿制制剂的制备过程中,应根据文献资料采用与参比制剂相同制备原理的工艺。以乳化 -溶剂挥发法制备多肽类药物微球制剂为例,在工艺过程中重点关注以下几点 :①乳化过程中剪切速率的控制,该步骤直接对微球粒径产生影响,进而影响微球的释放时间 ;②内水相- 油相的浓度和体积比,该步骤直接对微球的成球性及包封率产生影响;③固化阶段温度和真空度的控制,该步骤直接影响球表面的孔隙,进而影响制剂的突释行为 ;④由于制剂工艺复杂且关键辅料PLGA的玻璃化转变温度较低,在微球制备过程中应全程采用无菌工艺 ;⑤由于生产工艺和批量对产品质量可控性的影响较大,注册批和商业批的生产工艺与批量原则上应保持一致。
4.3 质量研究
微球制剂作为特殊注射剂,其仿制药应通过体外表征证明与参比制剂关键质量属性一致。在质量对比研究中,应至少采用3批商业化规模工艺生产的仿制微球制剂与多批次参比制剂进行对比。除注射剂的一般质量属性外,应重点关注如下项目。
4.3.1 粒径和粒度分布
微球粒度分布直接影响药物的释放行为,对含量均匀度、通针性等有较大的影响,是本品的重要质控指标。可按粒度和粒度分布测定法(ChP2020四部通则 0982 第三法 ) 测定,通过采用群体生物等效性分析法对粒度分布[d(0.1)、d(0.5)、d(0.9)] 进行对比,仿制药应与参比制剂一致。
4.3.2 载药量
根据ChP2020四部通则9014微粒制剂指导原则,微球制剂应对载药量进行测定。通过样品预处理,采用适当的方法进行微球中、微球表面的药物含量测定,再计算仿制药的载药量 ( 载药量= 微球中所含药物量 / 微球的总量 ×100% ),应与参比制剂一致。
4.3.3 溶剂残留
微球制剂的制备过程中会用到有机溶剂,如二氯甲烷、正庚烷等,因此需对工艺中用到的有机溶剂残留量进行控制。有机溶剂残留量的测定应依据ChP2020 四部通则0861残留溶剂测定法,如未规定限度者,可参考人用药品技术要求国际协调理事会 (ICH) 的相关指导原则,否则应制定有害有机溶剂残留量的测定方法与限度。
4.3.4 释放度
微球制剂仿制药在释放度考察的时间范围内,释放行为应与参比制剂一致。目前上市的微球产品质量标准中的释放度项下,有些采用体内释放试验,有些采用体外释放试验。体外释放模型方案的设计应基于体内数据,设计时可选择不同介质和不同条件模拟药物的体内行为,如通过在释放介质中添加助溶剂、表面活性剂和酶,以及变更pH值、离子强度、搅拌速率和温度等对释药模型进行调整,以期建立体内外相关性 (in vitro-in vivo correlation,IVIVC)。
体外释放试验方法有直接释药法、透析膜扩散法和流通池法等 [18]。直接释药法将微球分散于介质中并于不同时间点取样,采用超速离心或过滤进行分离,然后分析测定药物的释放量。该法的缺点为长时间高速离心可能会破坏给药系统,进而改变药物释放机制。透析法是将混悬态的微球置于透析袋中,药物可通过半透膜扩散至接受池中,然后检测接受池中的药物浓度。该方法的缺点如下:首先是缺乏搅动,分散的微球可能聚集 ;其次是当药物从微球中的释放速率大于药物经半透膜的扩散速率时,可能不满足漏槽条件。流通池法将微球置于流通池中而又与介质隔离,从接受池中取样进行检测。该法的优点如下:首先是解决了微球与溶出介质分离的问题 ;其次由于微球与接受介质相互隔离,可对药物的释放情况进行原位监测,从而进行多点分析并描述整个释放曲线的特征;再次,采用流通池法进行试验时,便于更换释放介质,不存在低溶解性药物不符合漏槽条件的问题。综上所述,在缓释微球的释放研究中首推流通池法。
体外释放介质中通常加入表面活性剂助溶或防止微球粘连,释放介质的pH值一般选择与体液接近的pH 7.4,或基于微球进入人体后会引起一定程度炎症反应的考虑,选用模拟体内炎症的偏酸性环境,如pH 3 ~ 7的缓冲液 [19]。由于微球缓释制剂的释放时间长( 如缓释1个月、3个月和6个月等 )、药物含量高,药物的突释可能会带来安全隐患,一般要在第一个释放时间点严格控制药物突释量。此外,由于释放介质中表面活性剂的使用,可能导致药物提前释放,从而低估突释量。
由于长效微球制剂释药周期通常持续数周,因而用加速释药试验预测微球的释药速率,对微球制剂的质量控制具有重要意义。通常,通过调节释放介质 ( 如缓冲液组成成分、pH值、表面活性剂种类和浓度等 )、试验条件 ( 温度、搅拌速度、释放介质更换频率 ) 等因素建立加速释药模型,采用非模型依赖法中的差异因子法和相似因子法进行释放结果曲线比较,建立长期释放结果与加速释放结果的相关性。但加速试验可能会改变药物释放机制,如提高释放温度可能会导致微球中药物的释放行为从受降解机制控制变为受扩散机制控制。
目前,由于微球制剂的体内释放环境很难在体外释放介质中得以模拟,上市的微球制剂品种均未在质量标准中建立IVIVC,仅有少数相关文献报道。例如SHEN等基于美国药典(USP) 装置Ⅳ( 流通池法 ) 开发的利培酮微球体外释放度方法,其测定结果与体内吸收的IVIVC可达A级相关 [20]。通过体外释放度与体内吸收建立相关性联系,可更有效地指导处方工艺开发、缩短质量评价周期、快速识别及评判产品质量。
4.4稳定性考察
应参照NMPA《关于发布化学药物 ( 原料药和制剂 ) 稳定性研究技术指导原则》的通告(2015 年 第 3 号 ) [21],并结合产品说明书开展常规的稳定性考察。考察指标除普通注射剂的质量属性外,还应包括与微球相关的质量属性 ( 如粒径和粒度分布、载药量、溶剂残留、释放度等 )。
此外,应参照CDE制定的关于发布《化学药品注射剂包装系统密封性研究技术指南 ( 试行 )》和《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南 ( 试行 )》的通告 (2020年第33号 )[22],结合产品特点、稳定性、包材相容性和容器密封性等研究结果来证明包材选择合理。
4.5非临床研究
非临床研究目前,已上市微球制剂经肌内、皮下等途径注射,注射后在注射部位形成药物贮库,通过扩散、聚合物的溶蚀降解等机制缓慢释放药物,从而达到长效的目的。相较于常释注射剂,微球制剂可消除多次给药产生的体内药物浓度峰谷现象,获得长时间平稳的有效浓度。仿制药与参比制剂处方和工艺的差异可能导致药物体内药代动力学行为发生改变,从而带来有效性和安全性的变化。因此,应参考CDE在2014年发布的《药物非临床药代动力学研究技术指导原则》[23],开展仿制药与参比制剂的药代动力学研究。微球制剂与相应的普通注射液相比,达峰时间(tmax)、平均驻留时间(MRT)、生物半衰期 (t1/2) 均增加,峰浓度(cmax) 降低。在仿制药开发过程中,通常采用非啮齿类动物进行药代动力学比较研究,采用拟定的临床剂量和给药途径,设置参比制剂组,测定血浆药物浓度( 包括负载药物和释放药物的浓度 )。通过比较 t1/2、cmax、AUC等主要药动学参数,显示仿制药与参比制剂药代动力学行为的一致性。微球制剂在体内的药代行为可能会受给药位点环境的影响。皮下或肌内注射药品时,微球由于粒径原因会停留在给药位点,影响其体内释药的因素主要有以下几点:流体的黏度和结缔组织;给药位点的脂肪量;给药位点的体液体积;肌肉运动;皮下组织细胞间液的体积、血流速度、渗透压及血浆蛋白 ;高分子材料的降解;炎症反应。必要时,可进行组织分布研究,以显示仿制药与参比制剂在药效器官分布的一致性。
4.6 人体生物等效性研究
开展药代动力学终点的生物等效性研究时,通常采用单次给药、随机、交叉设计,试验用样品采用商业批样品。对于亮丙瑞林、曲普瑞林等促性腺激素释放激素(GnRH) 激动药的长效微球制剂,可参考2020年11月CDE制定的关于发布《GnRH 激动剂用于晚期前列腺癌临床试验设计指导原则》的通告 (2020年第45号 )[24]。
五、结语
市场驱动创新,在仿制药一致性评价大洗牌及药品带量采购导致降价成为必然的背景下,长效微球制剂的高附加值愈见突显。2019年,长效微球制剂的国际市场规模已逾60亿美元,国内上市微球制剂产品的市场规模约34亿元,且在高速增长中。我国微球制剂研发紧随欧美日发达国家,但产业化水平仍有很大差距。近几年来,随着药品上市许可持有人(marketing authorization holder,MAH) 制度的执行,极具创新力的研发机构与药品生产企业的联合,将加快国产化长效微球制剂品种的上市步伐。

来源:中国医药工业杂志


