您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-27 22:12
摘要
头孢菌素是临床应用最广泛的一类抗生素,其药品中潜在的微量或痕量水平毒性杂质,在用药过程中可能会威胁到人类的健康,越来越受到制药企业和监管机构的关注。
对微量或痕量水平杂质的安全性评价,给药品研发和监管过程提出了巨大的挑战,也成为药物分析领域的一个重要研究内容。
近年来,随着毒理学研究策略和技术方法的不断进步以及杂质研究要求的不断提高,杂质毒性的研究策略与方法也需要更加具有预测性和精确性。
本文探讨了头孢菌素杂质毒性评价平台所采用的杂质毒性研究策略和方法,尤其是以结构为基础的计算机模拟技术;
同时重点提出了模式生物斑马鱼、LC-MS /MS 技术和系统毒理学研究策略; 并根据头孢菌素的案例研究,明确了头孢菌素杂质毒性预测的一般规则,可用于鉴定潜在的毒性杂质,为药物的安全性评价和杂质限度控制提供基础。
关键词
头孢菌素; 杂质; 斑马鱼; 毒性; ADMET; 分子对接
正文
药物活性成分( active pharmaceutical ingredient,API) 在合成过程中,起始原料、中间体、试剂、反应副产物等作为工艺杂质不可避免地存在于终产品之中。
药品的安全性不仅依赖于API 本身的毒理学性质,且也与其所包含的杂质毒理学性质有关。
一些能诱发遗传物质突变、染色体断裂和/或染色体重排的杂质,称之为遗传毒性杂质( genotoxic impurities,GIs) ,可能导致癌症的发生。
各国监管机构对药品研发及生产过程中的杂质控制和监测越来越重视。除工艺杂质外,药物在合成、制剂生产和储运过程中也可产生降解杂质。
β-内酰胺类抗生素是临床应用最广泛的一类抗生素,其主要包括青霉素和头孢菌素。
头孢菌素按其抗菌谱可分为5 代,其结构特点决定它在合成和贮存中易产生各类降解杂质,而不同头孢菌素的结构差异也导致该类药品中的杂质结构和理化性质具有较大差异,并包括多种微量或痕量杂质。
由于不同的杂质可能具有不同的生物活性/毒性,对头孢菌素毒性杂质的识别和判定是其安全性评价和杂质控制的难点。
目前ICH,FDA 以及国家药品监督管理局( NMPA) 对杂质的鉴别、分类、限度控制均提出了研究和控制方案。
由于遗传毒性杂质具有更大的危害性,伴随着2014 年ICH 遗传毒性杂质研究指导原则[Assessment and Control of DNA Reactive ( Mutagenic)Impurities in Pharmaceuticals to Limit PotentialCarcinogenic Risk, ICH M7 ( R1) ]的颁布,其近年来已受到更广泛的关注。
虽然遗传毒性杂质评估指导原则推荐使用杂质纯品,利用体外细菌致突变试验对杂质的遗传毒性进行评估,但由于药品中的杂质多为微量或痕量,较难通过制备等方法获得。
FDA和欧洲药品管理局( European Medicines Agency,EMA) 等提出可利用基于定量结构-活性关系模型( quantitative structure-activity relationship,QSAR) ,通过计算机模拟预测软件评估药物杂质的遗传毒性,即在对杂质结构进行鉴定的基础上,利用毒性预测软件判断杂质是否具有警示结构,进而评估其是否具有遗传毒性[1]。
近年来,我们借鉴FDA 和ICH 对杂质毒性评估的策略与方法,针对头孢菌素毒性杂质识别和判定中的难点,初步建立了头孢菌素杂质毒性评估平台。
此项研究工作不仅可为头孢菌素的安全性评估提供技术依据,将临床不良反应监测数据与药品质量相关联,且可以更合理地制定药品标准中的杂质限度,进而控制药品质量。
本文系统介绍头孢菌素杂质毒性评估平台中所采用的杂质毒性评价策略与方法。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
1 杂质毒性评价决策树
对化学药品中毒性杂质的识别和判定是杂质安全性评价和限度控制的难点。仿制药品由于原料药的合成路线、工艺以及制剂处方工艺与参比制剂可能不同,因此可能存在某些与参比制剂不同的杂质。
对仿制药中的杂质研究和控制,国外要求参考参比制剂( 或原研药) 的杂质控制信息,通过杂质的对比研究,制定仿制药品中的杂质限度。
根据化学药品杂质毒性的性质,将杂质分为3 类进行控制: 遗传毒性杂质、普通毒性杂质和普通杂质。
遗传毒性杂质大多数具有强亲电性,其可直接或间接损伤DNA 从而产生致突变作用,或者不与DNA 直接作用,通过间接机制产生致癌作用。
一般认为,遗传毒性杂质和潜在致癌物比一般杂质更具有危害性,特点是其在很低的浓度时即可造成对人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤发生。
普通毒性杂质通过其他作用机理产生毒性,导致不良反应的发生,例如某些皮肤致敏物,自身作为亲电基团与蛋白质载体共价键形成半抗原蛋白复合体,从而形成特异性抗原。
目前ICH 对于遗传毒性杂质的鉴别、杂质分类、限度控制及控制策略有较详细的指导,但对于普通毒性杂质的识别和判定、杂质分类、限度控制方法及策略还没有相应的指导原则。
如何识别和判定普通毒性杂质? 如何制定普通毒性杂质限度控制策略? 普通毒性杂质的检测方法? 借鉴ICH 杂质( 特别是遗传毒性杂质) 的鉴别、毒性评价策略,以及我们近年来积累的杂质毒性评价经验,以杂质的结构为基础,利用结构与毒性关系判断不同杂质毒性的性质,进而采用不同质控策略,达到保证或提高此类药品质量的目的,降低其在临床使用中的不良反应发生率。
所建立的化学药品杂质毒性评估决策树基本流程见图1。
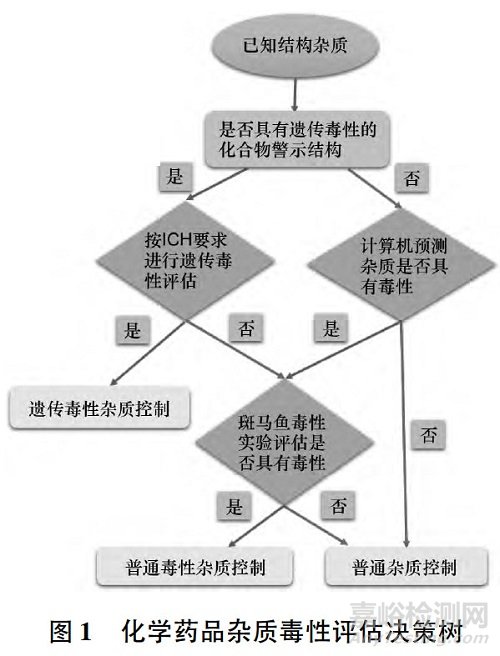
即: 对于已知结构杂质,首先判断其是否具有“警示结构”。如果具有“警示结构”,则依据ICH 指南进行遗传毒性实验( Ames 实验) 。
若结果为阳性,即按遗传毒性杂质控制; 若是阴性,则进一步判断其是否具有其他特定毒性作用。
如果该杂质不具有“警示结构”,则利用计算机模拟与预测技术判断其是否具有其他特定毒性作用。
若结果为阳性,则进行斑马鱼胚胎毒性实验对该特定毒性作用进行验证,进而确定是否将其按普通毒性杂质进行控制。
如果该杂质不具有“警示结构”,计算机模拟预测也没有发现其可能具有特定的毒性作用,则按普通杂质控制。
目前,此项工作仍在探索研究中。
2 遗传毒性杂质评价策略及方法
ICH 颁布的ICH M7 ( R1) 为药品中各类潜在的基因毒性杂质的鉴别、分类、定性和控制提出了具体实施方案,是对ICH Q3A 和Q3B 的重要补充。
其建议首先进行杂质警示结构的评估,然后利用数据库和QSAR 模型进行确认,再开展细菌回复突变( Ames)试验进行验证的实施策略。
并推荐当采用QSAR 模型进行计算毒理学评估时,建议分别使用基于专家规则和统计学方式建立的2 个相互补充的QSAR 模型。
如果2 个互补的QSAR 模型均没有发现结构警示,则可以认为该杂质没有致突变的可能。
例如,利用OECD QSAR Toolbox 和Toxtree 计算机软件对头孢他啶及杂质的警示结构进行评估,预测结果提示,杂质B 和D 可能具有遗传毒性,而主要的警示结构是3 位侧链上的季胺基团[2]。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
3 斑马鱼毒性评价平台
为了更有针对性地控制杂质限度,提高质检水平,我们利用斑马鱼胚胎毒性实验( Fish EmbryoToxicity,FET) 评价头孢菌素及杂质的毒性效应。
见图2。
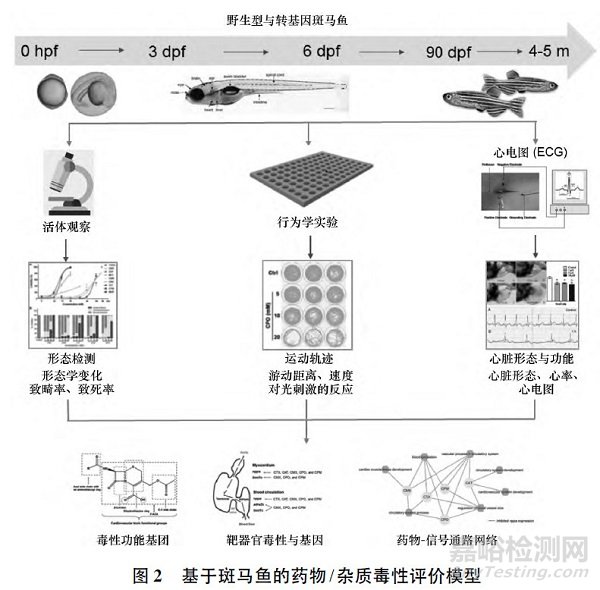
斑马鱼体型纤细,成鱼体长3 ~4 cm,其世代周期短,3~4 个月就能达到性成熟。
斑马鱼常年产卵,卵易收集。卵在体外受精、发育,胚胎发育同步,且速度快。
在世界经济合作与发展组织( Organization forEconomic Co-operation and Development,OECD) 于2013 年发布的FET 检测指导原则中,总结了其在药物毒理学领域研究中的明显优势: 试验时间短( 3 ~5 d) ; 药物用量小; 实验动物数量能达到统计学意义; 试验终点可量化; 处理操作方便; 对大量药物可做出快速评估。
为评估头孢菌素杂质的毒性,建立简便、准确的特定毒性评价方法,并寻找头孢菌素结构-毒性关系,我们利用斑马鱼建立了药物/杂质毒性评价平台包括胚胎毒性、心脏毒性、神经毒性等模型,用于药物的急性毒性和靶器官毒性效应的评价。
利用胚胎毒性中的致畸率、致死率表征药物的急性毒性,不同的毒性表型说明药物不同毒性功能基团的反应特性[3 - 5]; 对于神经毒性,利用幼鱼运动行为( 游动距离、游动速度、对光刺激的反应) 的改变,表征药物对神经系统的作用[3,6]; 对于心脏毒性,以幼鱼心跳速率的改变结合对心脏发育畸形的观测,或成鱼心电图的改变表征药物对心脏功能的影响[7]。
在此基础上总结头孢菌素结构与急性毒性、神经毒性、心脏毒性的关系。
3.1 药物毒性功能基团
药物分子中存在的和/或潜在的导致机体出现毒性效应的化学基团称之为毒性功能基团( toxic functional group) 。
潜在的毒性功能基团可在生物体内经过代谢等途径转化,生成毒性功能基团。
药物分子中可能含有一个或多个毒性功能基团; 不同的毒性功能基团在生物体内产生的毒性效应可能不同; 而对生物体的毒性效应可能是多个毒性功能基团共同作用的结果。
毒性功能基团是研究药物结构与毒性关系的基础。
我们通过对头孢唑林钠和头孢西酮钠杂质的斑马鱼毒性评价研究,提出了头孢菌素毒性功能基团的概念[5]。
利用计算化学的方法,通过头孢菌素3D 结构-毒性功能基团的关系研究,可以预测头孢菌素的毒性功能基团。对33 种头孢菌素水溶液的最稳定构象的理论计算,可以将头孢菌素的最稳定构象分为3 类,如图3 所示。

① 整个分子呈较伸展的结构,如头孢唑林、头孢羟氨苄等,其特点为3 位和7 位侧链均充分暴露,药物所产生的毒性效应由3 位和7 位侧链共同决定。
② 3 位或7 位侧链具有较伸展的结构; 另一侧链与分子中的其他基团形成氢键等相互作用,呈现“折叠”结构,如头孢哌酮、头孢曲松反式异构体等。
处于伸展结构的侧链更易与机体内的受体发生相互作用,产生毒性效应,即药物所产生的毒性效应主要由3 位或7 位侧链中的毒性功能基团决定。
如头孢哌酮的3 位侧链和7 位侧链是不同的毒性功能基团; 头孢哌酮的7 位侧链具有较伸展的结构,低浓度时就显现7 位侧链导致的毒性反应; 头孢哌酮的3 位侧链结构呈“折叠”结构,在较高浓度时才显现巯甲基四氮唑的毒性反应[4]。
③ 整个分子呈折叠结构,即3 位和7位侧链均呈折叠状态,如头孢地嗪、头孢替胺等,该类头孢菌素的分子极性通常较低,易被生物体吸收[8]。
利用毒性功能基团评估头孢菌素( 如头孢克洛、头孢噻肟、头孢吡肟、头孢曲松及其异构体等)的毒性效应,总结出的头孢菌素杂质毒性评价规则如下。
规则1:
头孢菌素的毒性反应由其毒性功能基团的结构决定,结构相近的头孢菌素具有相似的毒性反应; 头孢菌素3 位侧链和7 位侧链通常为不同的毒性功能基团,它们可以独立或协同发挥作用。
计算头孢菌素的3D 结构,可以预测其主要毒性作用。
规则2:
分子的毒性反应不仅与毒性功能基团的平面结构有关,且与其3D 结构有关; 分子中具有2 个毒性功能基团的头孢菌素,具有伸展结构的毒性功能基团在低浓度下首先显现其毒性效应,即较易发挥作用。
规则3:
头孢菌素降解可以形成新的毒性功能基团,进而产生与药物分子不同的毒性反应。
规则4:
药物的毒性反应由毒性功能基团的特性与化合物的吸收特性共同决定; 用空间极性表面积( TPSA) 可表征药物分子同分异构体的吸收特性,通常TPSA 较小的异构体更易被吸收。
规则5:
在已上市的头孢菌素中,7位侧链含氨噻肟结构、3 位侧链含巯甲基四氮唑结构是较常见的2 类药物,相对于其他侧链结构,基于氨噻肟结构和基于巯甲基四氮唑结构形成的毒性功能基团的急性毒性反应通常较弱。
规则6:
头孢菌素△异构体之间,毒性功能基团的空间结构通常不发生较大改变,其对TPSA 的影响也相对较小,故△异构体与药物分子的毒性反应相似。
规则7:
7 位侧链为氨噻肟结构的头孢菌素的E-异构体( 反式异构体) ,由于7 位侧链通常呈折叠状,故更易显现出3 位侧链之毒性功能基团的毒性反应特性; 同时,折叠作用导致分子的TPSA 减弱,吸收作用增强,使得E-异构体的毒性反应相对更强。
规则8:
3 位侧链为巯甲基四氮唑结构的头孢菌素,其3 位侧链通常呈折叠状,因此通常更易显现出7 位毒性功能基团的毒性反应特性。
规则9:
3 位侧链为简单取代基如甲基、丙烯基、氯等的头孢菌素,3位取代基与7-ACA 母核结构共同组成毒性功能基团,发挥毒性效应。
利用上述毒性评价规则,我们对国内创新药物头孢嗪咪钠及其杂质的毒性作用进行了预测[8]。
例如,头孢嗪脒钠的3D 结构揭示其3 位的三嗪环呈外露状态,是导致急性毒性反应的主要毒性功能基团; 斑马鱼胚胎毒性试验揭示三嗪环的主要急性毒性效应表现为致畸,因此头孢嗪脒钠的急性毒性作用主要以致畸反应为主,其对斑马鱼表型的影响与头孢曲松( 3 位侧链的三嗪环) 诱导的致畸反应相似。
头孢嗪脒的TPSA 略大于头孢硫脒,明显小于头孢曲松; 而分子的TPSA 与分子的被动吸收呈负相关,提示其在斑马鱼体内的浓度应与头孢硫脒相近。
因此,头孢嗪脒钠的毒性作用应不大于头孢硫脒和头孢曲松钠,实际测定结果与预测结果相同[8]。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
3.2 药物/杂质体内毒性效应的预测
药物在体内的毒性作用除了与毒性功能基团的结构有关外,还与其在体内的浓度有关。
在进行斑马鱼毒性试验中,通常将药物溶解于斑马鱼饲养液中,通过计算半数致死/致畸时的给药浓度( LD50) 表征化合物的毒性效应。
然而,LD50值是化合物的毒性和其吸收能力的综合毒性效应,此时斑马鱼体内的药物浓度反映毒性功能基团的毒性效应[3,9]。
为更准确地利用斑马鱼毒性评价模型评价头孢菌素毒性功能基团的特性,我们利用LC-MS /MS 定量测定头孢菌素在斑马鱼体内的吸收情况[10],并进一步通过QSAR 方法,建立了斑马鱼体内吸收与药物结构之间的定量关系模型,预测其他头孢菌素及杂质在斑马鱼体内的吸收情况[11],并构建了头孢菌素结构-吸收-毒性评价系统。
不同结构的头孢菌素在斑马鱼体内的吸收差异较大,结合吸收数据,更能准确、有效地评价药物在斑马鱼的胚胎毒性。
通过头孢菌素结构-吸收-毒性评价系统,对头孢唑林钠的诸杂质的毒性评价研究发现,杂质的体内吸收能力明显影响其毒性效应; 头孢唑林钠中杂质G 的毒性效应最强,杂质A最易被机体吸收,而杂质F 的综合毒性效应最强。
结构-毒性关系分析表明,头孢唑林钠中的MMTD结构是引起急性毒性反应的毒性功能基团; 7-ACA结构和MMTD 结构是导致神经毒性的毒性功能基团; MMTD 结构和7-ACA 结构是导致心脏毒性的毒性功能基团。
因此,头孢唑林钠中对含MMTD 结构的杂质( 主要是杂质F) 控制是关键[3]。
目前,我们也在利用药物的斑马鱼LC50值,构建头孢菌素2D/3D QSAR 模型,预测杂质的毒性。
为评估头孢菌素杂质在人体的ADMET 性质,基于计算机预测软件,通过比较杂质与药物ADMET参数的差异,可以预测杂质与药物分子的相对毒性。
我们以头孢噻肟、头孢他啶为例,通过比较药物及杂质的体内ADMET 性质,预测杂质毒性的大小[12]。
3.3 杂质毒性作用机制的研究
在已建立的斑马鱼毒性评价平台中,我们将系统毒理学研究策略和技术应用到对头孢菌素杂质的毒性评价中,提出了头孢菌素杂质毒性作用机制的研究策略。
见图4。

① 利用基因表达谱芯片和转录组测序技术采集转录组数据,通过生物信息学分析方法,筛选头孢菌素及其杂质( 侧链基团) 的差异表达基因( DEGs)和差异共表达基因( CDEGs) 。
② 构建药物-基因、药物-信号通路分子调控网络,探讨特定的靶器官毒性,如神经毒性、心脏毒性等及其分子作用机制。
③ 通过分子生物学技术,如qRT-PCR、原位杂交、Western Blot 等技术验证差异表达基因及其编码蛋白的表达情况。
④ 构建蛋白-蛋白相互作用网络,寻找药物毒性作用的可能靶分子及作用机制。
⑤ 利用同源建模和分子对接技术,预测和模拟杂质与靶分子之间的相互作用,分析作用模式。
⑥ 寻找和确定效应生物学标志( biomarker of effect) ,用于杂质毒性效应的评价。
利用上述研究策略,对C-7位含有氨噻肟结构的头孢菌素结构与神经毒性的关系进行了评价: 头孢菌素对斑马鱼神经行为学的影响主要与母核7-ACA 结构和C-3 位取代基有关; 化合物可通过调节神经递质的水平及感受器受体影响神经行为学; 头孢菌素对gad2,or111-4,or126-3,grm1a,opn8c,or111-5,or113-2 和or118-3 基因表达的影响,可作为效应生物标志用于该类头孢菌素神经毒性的评价[6]。
对该类头孢菌素结构与心脏毒性的关系的评价结果表明,该类头孢菌素的心脏毒性主要与母核7-ACA 结构有关; 头孢菌素在胚胎发育阶段可能通过影响心肌及血管的发育导致心脏毒性; 吸收、分布、代谢、排泄( ADME) 预测结果显示,7-ACA 的C-3 侧链发生改变后,将影响化合物在体内的分布; 头孢菌素对nppa,adra2c 和tnni1c 基因表达的影响,可能作为效应生物学标志用于该类头孢菌素心脏毒性的评价[7]。
对C-3 位含有巯甲基四氮唑结构的头孢菌素( CNMTs) 结构与胚胎毒性关系的评价结果显示,CNMTs 诱导的斑马鱼急性毒性反应具有浓度依赖性,在低浓度时,主要表现为出C-7取代基的毒性作用,在较高浓度下,C-3 取代基的毒性作用才显现;
CNMTs 中的巯甲基四氮唑( MTT) 结构可影响has1 和cnnm2a 基因的表达; 信号通路分析明显指向其与影响神经活性配体受体的相互作用有关,进而影响心肌收缩和血管平滑肌收缩的功能[12]。
基于上述研究,我们对提出的头孢菌素杂质毒性评价规则进行了完善。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
规则10:
导致头孢菌素神经毒性和心脏毒性的毒性功能基团通常由7-ACA 母核结构与3 位侧链共同组成,3位侧链为乙酰氧基结构时,毒性效应相对较强; 7 位侧链通过影响药物的吸收而影响其毒性效应。
规则11:
头孢菌素可能通过与谷氨酸受体代谢型1a( glutamate receptor,metabotropic 1a,GRM1A)蛋白和/或谷氨酸脱羧酶2 ( glutamate decarboxylase2,GAD2 ) 的相互作用产生神经毒性作用,以GRM1A 或GAD2 蛋白为受体与头孢菌素进行分子对接( docking) ,并与7-ACA 的对接结果进行比较,可以评估头孢菌素的神经毒性。
规则12:
头孢菌素可能通过影响nppa, adra2c 和tnni1c 基因的表达,产生心脏毒性,以基因的编码蛋白为受体与头孢菌素进行分子对接,并与7-ACA 的对接结果进行比较,可以评价头孢菌素的心脏毒性。
规则13:
3 位侧链为MTT 结构的头孢菌素可导致has1 和cnnm2a 基因表达的变化; 利用该类头孢菌素与HAS1 蛋白的对接结果可以评估其急性毒性的强弱。
综上,按照ICH 的基本原则,我们提出了评价头孢菌素杂质的基本策略,并依据研究结果,总结出头孢菌素杂质毒性预测的一般规则( 简称规则,共13 条) 。
同时也建立了化学药品杂质的毒性评价与预测平台,用于探索药物/杂质的毒性作用机制并预测杂质的毒性功能基团。
这一研究成果为减少使用动物实验、缩短药物评价周期、评估药物杂质的毒性作用、制定合理的杂质限度,最终保证药品的安全性与有效性具有重要意义。
该研究策略和技术方法将会在新药研发和药品一致性评价中发挥越来越重要的作用。
4 展望
4.1 如何将药物/杂质毒理学信息与药物临床不良反应相关联
2019 年3 月7 日,NMPA 发布了《关于修订含头孢哌酮药品说明书的公告》。该公告要求不良反应项下增加“血小板减少、低凝血酶原血症、凝血障碍、出血”事项。
并警告出血的独立风险因素可能包括有临床意义出血风险增加的损伤或病症,例如近期发生过脑梗死( 缺血性或出血性) 、近期有出血的活动性消化性溃疡、自发性或获得性止血平衡受损的患者、伴随凝血障碍和有临床相关出血风险的肝脏疾病; 系统性合并使用已知影响止血的药物治疗。
还通知头孢哌酮药品生产企业应当对新增的不良反应发生机制进行研究。
截至目前,头孢哌酮引起的出血不良反应机制可能是: 3 位侧链的N-甲巯四氮唑基团( MTT) 干扰维生素K 或维生素B 的循环,通过阻碍凝血酶原的合成,导致较明显的出血倾向发生。
但头孢哌酮致出血的分子机制仍不十分明确,或一些实验数据与临床观察不能完全解释上述的干扰机制。
研究结果初步揭示: 头孢哌酮毒性与其3 位侧链MTT 结构之间的关系[4],以及头孢哌酮可能通过MTT 结构,抑制血管生成调节基因腺苷酸环化酶激活多肽1b ( adcyap1b) 的表达[13],进而诱发机体的血管损伤。
目前,该研究仍在进行中,我们期望将含MTT 结构的药物/杂质的毒性效应与临床不良反应相关联,更好地控制药品质量。
4.2 如何将不良反应信息与产品质量相关联
如何将杂质毒性评价结果与不良反应信息相关联,与药物在杂质信息相关联,是目前仿制药一致性评价中亟待解决的问题,也是本研究的重点。
头孢菌素中很多杂质都属于异构体,在探讨盐酸头孢替安的热异构化( thermo-isomerization) 过程中,发现了2 个头孢替安同分异构体新杂质,利用质谱和一维及二维核磁共振技术确定了同分异构体的结构,通过预测该杂质分子在水溶液中稳定构象,推测其可能的毒性功能基团,再利用分子对接技术比较药物/杂质与HAS1 靶蛋白的相互作用,结果表明它们均可能比头孢替安的毒性效应大[14]。
由于热异构化不仅可发生在头孢替安中,在C-3 含有1-烷基-1H-四唑-5-硫醇侧链的其他头孢菌素中也会发生。
将不同产品中的该杂质含量与不良反应信息相关联,则可以评估不同产品、工艺与特定不良反应的关系。
这项研究对于头孢菌素的杂质评估具有重要意义。

来源:Internet


