您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-10 22:09
药物递送技术(Drug Delivery Technology)是指在空间、时间及剂量上全面调控药物在生物体内分布的技术体系。药物递送要实现的目标:制剂范畴解决药物的水溶性和稳定性,在递送范畴解决药物控释和靶向递送。通过调节药物的递送和释放位置,改变药物体内代谢行为,跨越生理屏障促进药物吸收,增加药物生物利用度,提高疗效,同时降低毒副作用。
一、概述药物递送
药物递送系统(Drug Delivery System,DDS)的研究是药物开发的关键因素,涉及了药学、医学、材料学、机械学等众多学科,需要多种技术的高度融合,研究范畴包括药物理化性质、递送载体材料、递送装置、递送载体的理化性质和修饰等等。随着药学的发展和对疗效的高追求,药物递送技术越来越受到重视,更多的化学物需要药物递送技术去实现高效治疗的“最后一公里”。
鲁迅先生说,在我的后园,可以看见墙外有两株树,一株是枣树,还有一株也是……不好意思,不是这句。鲁迅先生说的是,其实地上本没有路,走的人多了,也便成了路。药物递送技术便是药物进入人体发挥疗效的路,这句话不是鲁迅先生说的。
药物进入人体发挥疗效的路,捷径是注射液、片剂、胶囊这些传统制剂,工艺成熟,疗效稳定。但是随着更多难溶性药物的发现,越来越多的药物难以通过传统制剂手段发挥疗效,此时需要更前沿的制剂技术用于药物递送,这便是拓荒“最后一公里”;有的药物因自身的理化性质导致生物利用度不高,或者药物本身不够稳定,需要更合适的制剂技术用于提高稳定性和生物利用度,这便是拓平“最后一公里”;还有的药物,已有递送技术解决了稳定性和生物利用度等问题,但是随着适应症对药物剂量的高需求,需要更适合的药物递送载体用于降低毒副作用,提高给药剂量,这便是拓宽“最后一公里”。
二、药物递送解决“最后一公里”
药物递送的最终目的,就是通过制剂手段,改善药物的理化性质,改变药物在体内的动力学和代谢学行为,实现更优的药效学,解决药物与病灶部位的“最后一公里”。目前主要的制剂手段,主要是通过各类载体实现对药物的高效递送。
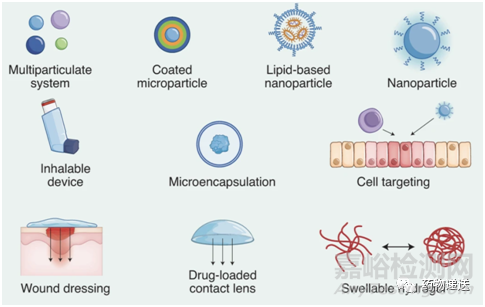
图1 药物递送的部分载体
(一)药物递送:拓荒“最后一公里”
诚如鲁迅先生所说,其实地上本没有路,只是有人走过之后便在地上形成了路,mRNA药物便是如此。全球新冠大流行期间,随着Pfizer-BioNTech的BNT-162b2新冠疫苗和Moderna的mRNA-1273新冠疫苗的上市,生物医药行业进入了全民核酸药物时代,拓荒了mRNA药物的“最后一公里”。
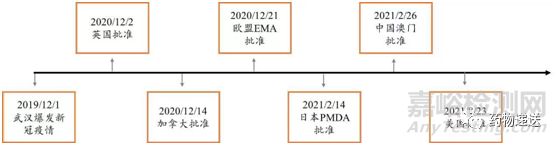
图2 Pfizer-BioNTech的BNT162b2新冠疫苗全球上市时间轴
mRNA,即信使核糖核酸,以遗传物质DNA的一条链为模板转录而来,其携带的遗传信息用于指导蛋白质的合成。但mRNA链是单链大分子,本身极其脆弱,在体内极不稳定,易被体内的多种酶迅速降解;同时mRNA分子结构较大,带负电荷,与同样带负电荷的细胞膜表面静电排斥,难以穿过细胞膜进入细胞内,而无法进入细胞内就无法将mRNA编码信息用于合成蛋白质;即便进入细胞内,也必须要从内涵体中逃逸至细胞质中才能用于编码蛋白,但外源性的mRNA具有免疫原性,易激活人体免疫系统,要避免被免疫系统识别才能最终递送至细胞内编码蛋白。总之,mRNA药物递送主要有三道屏障:胞外膜屏障,胞内酶降解和胞内免疫应答。
mRNA递送最早的技术手段是化学修饰,通过对末端加帽或者改变核苷酸来优化mRNA序列,但化学修饰只能改善药物的稳定性和免疫原性,药物依然会在血液循环中被快速降解,既不会在靶组织蓄积,也不能有效穿过细胞膜递送至细胞质内的作用点。
mRNA药物还得借助递送系统才能实现药物的高效转运。在脂质纳米粒(LNP)之前,曾用鱼精蛋白、高分子聚合物(比如聚乙烯亚胺PEI)、阳离子纳米乳、阳离子脂质体用于递送mRNA药物,最终脂质纳米粒成为第一个成功递送mRNA药物的载体。
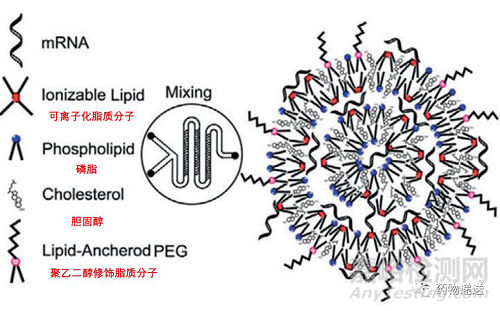
图3 mRNA/LNP复合体结构示意图
早在2018 年,FDA就批准第一款siRNA药物Patisiran上市,这是全球首款采用脂质纳米粒(Lipid Nanoparticle,LNP)递送核酸药物的产品。脂质纳米粒由可电离磷脂、中性辅助磷脂、胆固醇和PEG化磷脂组成。
可电离的磷脂是LNP的技术核心,可随着pH 的变化而变化:低pH值时呈正电荷与呈负电荷的mRNA 分子相互作用形成复合体,包载mRNA 分子;中性pH值时保护LNP结构完整避免药物降解,减少毒副作用的发生。中性辅助脂质多为饱和磷脂,可提高脂质纳米粒的相变温度,支撑纳米颗粒脂质双层结构的形成并稳定其结构排列。胆固醇的膜融合性促进mRNA分子的胞内摄入和胞质递送。PEG化磷脂在纳米颗粒的表面改善其亲水性,避免被免疫系统快速清除,在存储过程中防止颗粒聚集,增加稳定性。
LNP包载mRNA分子的递送原理:生产过程中,呈正电荷的可电离脂质与带负电荷的mRNA分子静电络合形成mRNA/LNP复合体,提高mRNA分子的稳定性;mRNA/LNP到达细胞膜时,可电离磷脂呈正电荷与带负电荷的细胞膜触发膜融合,细胞膜去稳定化,促进mRNA分子的递送;内化进入细胞后,随着含有多种水解酶的溶酶体分解外源性大分子,pH值降低形成偏酸环境,使可电离的脂质质子化,LNP的双层结构遭受破坏,释放mRNA,按照“中心法则”与负责合成蛋白的核糖体结合,翻译成病毒蛋白,即抗体,中和病毒。

图4 BNT162b2新冠疫苗的生产过程
目前,微流控技术结合乙醇稀释法制备脂质纳米粒的工艺已较为成熟,但国内外的研究极度“内卷”。除此之外,还有离子脂质复合物(lipoplex,LPX)、脂质多聚复合物(lipopolyplex,LPP)、聚合物纳米颗粒(Polymer nanoparticles,PNP)、无机纳米颗粒(Inorganicnanoparticles,INP)、阳离子纳米乳(Cationic nanoemulsion,CNE)、GalNac(N-acetylgalactosamine ,N-乙酰半乳糖胺)技术、外泌体递送技术等等,多种技术手段也在研究用于mRNA分子的递送。
脂质纳米粒之于mRNA分子的递送,就好比是在莽荒中开辟了一条可供行走的道路,这便是药物递送拓荒“最后一公里”。很多药物不需要特殊的制剂手段便能发挥治疗作用,但有的药物必须依靠递送技术才能进入人体,退一步讲,哪怕是注射液或者片剂胶囊,也属于历史悠久、技术成熟的制剂技术。
(二)药物递送:拓平“最后一公里”
有的药物本身已有产品上市,但其自身存在稳定性差、治疗效果不理想、毒副作用大等缺陷,而通过药物递送技术,可以避免这些临床劣势。此时,药物递送就好比一柄锄头,能把原本崎岖难行的山路变得平坦,改善行走体验感。
以前列地尔为例。
前列地尔,主要成分是前列腺素E1(PGE1),作为一种很强的扩血管药物,可抑制血小板凝集,在临床上广泛使用改善微循环。截止目前,前列地尔已经历三代产品的发展。
表1 前列地尔三代产品
|
产品发展 |
剂型 |
特点 |
|
第一代 |
粉针剂 |
药物无递送载体包裹,易灭活,无靶向性 |
|
第二代 |
乳剂 |
乳剂包裹药物,具有靶向性,储存和运输过程易破乳,药物易降解或转化 |
|
第三代 |
注射用干乳剂 |
乳剂包裹药物,具有靶向性,复溶后颜色较乳剂浅 |
|
注射用乳剂 |
乳剂以固态形式存在,不会发生破乳,降低药物降解或转化几率 |
第一代前列地尔产品的剂型为普通粉针剂,因为药物自身的代谢稳定性不足,导致能到达病灶部位的有效成分很少,无法发挥足够的治疗效果,用药量大,常用剂量为100-200μg,严重影响产品的临床应用和市场推广。
第二代前列地尔产品的剂型为乳剂,有的文献中也叫作脂微球,具有良好的靶向性、持续性、高效性。日本大正制药于1988年上市了效期为12月的前列地尔脂肪乳注射液。前列地尔脂肪乳注射液中的药物之所以依然会降解,主要是因为磷脂中的磷脂酰乙醇胺会促进前列地尔生成前列腺素A1,因此日本富士制药使用高纯度蛋黄卵磷脂,同时通过加入油酸改善因减少磷脂酰乙醇胺而降低的乳化作用。通过改变处方,使前列腺素E1与磷脂膜之间的结合力更为紧密,药物降解速率降低,富士制药于2013年上市了效期为24月的前列地尔脂肪乳注射液。
表2 前列地尔脂肪乳注射液处方对比
|
处方组成 |
一年效期 (10μg:2mL) |
两年效期 (10μg:2mL) |
|
前列腺素E1 |
200mg |
200mg |
|
大豆油 |
36mg |
35.64mg |
|
油酸 |
4.8mg |
/ |
|
高纯度蛋黄卵磷脂 |
/ |
0.36mg |
|
浓甘油 |
44.2mg |
44.2mg |
第三代前列地尔产品的剂型为注射用干乳剂或注射用乳剂。前列地尔脂肪乳注射液中加入了大量油酸,但油酸依然会引起前列地尔的降解,并且乳剂在储存和运输过程中易破乳,稳定性差。而重庆药友制药开发的第三代注射用前列地尔干乳剂,采用特殊的冻干保护剂制成干乳剂的形态,使其剂型稳定性更高,用药更安全,于2010年获批上市,此产品采用了四川大学张志荣教授等人的静脉注射用脂质类纳米药物制剂关键技术及产业化,该技术荣获国家科学技术进步二等奖。第三代的注射用前列地尔乳剂由中海康生物制药开发,是对乳剂的进一步改良,在保证药物高包封率的前提下,通过改良冻干处方和工艺,将乳剂冻干,延长产品生命周期的同时又能保证乳剂结构的完整性,该产品于2019年获批上市。
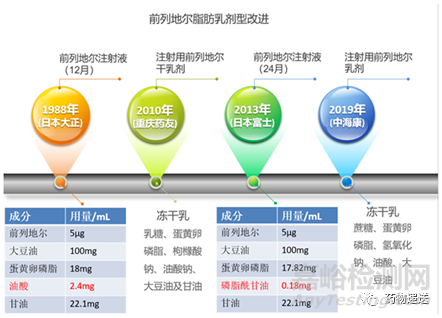
图5 前列地尔脂肪乳改进历程
第二代和第三代前列地尔产品,因为脂肪乳的包裹,药物不易失活,且具有分布于受损血管部位的靶向特性,将第一代普通粉针剂的剂量由100-200μg降低到5-10μg。性质更为稳定的第三代前列地尔产品的上市,既填补了前列地尔临床上未有冻干乳剂的空白,由解决了第二代产品易破乳的缺点。即便如此,前列地尔乳剂的本质还是O/W型亚微乳剂,过量水性媒介的加入会导致乳化膜的稳定性下降,所以必须按照说明书的规定给药,保证产品的最优质量。
拓平“最后一公里”的案例在产品开发中不胜枚举,比如纳米晶技术开发的帕利哌酮、微球技术开发的亮丙瑞林和利培酮、脂质体技术开发的阿霉素和伊立替康等等,通过物理包封延长药物释放周期或者降低药物毒性,药物递送技术改善产品质量,让患者有更优的治疗选择。
(三)药物递送:拓宽“最后一公里”
有的药物虽然理化性质不好,但是良好的疗效使其被开发成各类剂型,毒性越来越低,剂量越来越高,适应症越来越广。逐代更新进化的产品,正如泥泞山路变成平坦水泥路,再由水泥路变成高速公路,药物递送逐渐拓宽“最后一公路”。
作为最优秀的天然抗肿瘤药物,紫杉醇在临床上已经被广泛应用于乳腺癌、卵巢癌和部分头颈癌和肺癌的治疗。紫杉醇是首个具有抗癌活性的二萜生物碱类化合物,其新颖复杂的化学结构、广泛而显著的生物活性、全新独特的作用机制备受生物医药开发者的青睐。自百时美施贵宝公司的紫杉醇注射液(Taxol,泰素)于1992年12月获批上市以来,已成为举世瞩目的重磅药物。
表3 紫杉醇产品进化之路
|
产品 |
Taxol |
Lipusu |
Abraxane |
Cynviloq |
Paclical |
|
厂家 |
BMS |
绿叶 |
Celegene |
Samyang |
Osamia |
|
上市时间 |
1992.12 |
2003.01 |
2005.02 |
2007.01 |
2015.10 |
|
制剂技术 |
注射液 |
脂质体 |
白蛋白纳米粒 |
聚合物胶束 |
聚合物胶束 |
|
辅料 |
聚氧乙烯蓖麻油 |
卵磷脂、胆固醇、苏氨酸 |
人血白蛋白 |
聚丙交酯聚乙二醇嵌段共聚物 |
XR-17 |
|
静脉滴注 |
3~72 h |
3 h |
1 h |
30 min |
1 h |
|
MTD (mg/m2) |
175 |
175 |
260 |
>300 |
>300 |
|
预处理 |
需要 |
需要 |
不需要 |
不需要 |
不需要 |
1991年,百时美施贵宝公司(BMS)与美国国家癌症中心合作以半合成途径合成紫杉醇,最终紫杉醇注射液(Taxol,泰素)于1992年12月获FDA 批准用于治疗卵巢癌,为全球第一个上市的紫杉醇制剂。1994 年,又批准用于治疗乳腺癌。每毫升Taxol中含有6 mg紫杉醇,527 mg聚氧乙基代蓖麻油和49.7%无水乙醇。在上市的前十年间,Taxol的销售额合计为90亿美元,到2017年时销售额已超过145亿美金。
尽管如此,Taxol处方中过多的聚氧乙烯蓖麻油会刺激机体释放组胺,导致严重的过敏反应甚至神经毒性,包装上还印有“过敏及严重过敏反应2%-4%发生率”的黑框警告,所以必须在用药前经过皮质激素及抗组胺药等预处理。此外,Taxol易产生耐药性,血药浓度维持时间短,无靶向性,在肿瘤组织中的浓度低等缺点,这都为紫杉醇的后续开发提供了广阔的空间。
力扑素(Lipusu)是针对Taxol的临床缺陷而成功开发上市的全球第一个紫杉醇新型制剂,也是目前全球唯一获批的紫杉醇脂质体,由我国绿叶制药研发上市,拥有完全独立自主的知识产权。力扑素于2003年1月获批在国内上市,用于卵巢癌一线治疗、不可手术切除的局部晚期或转移性非小细胞肺癌(NSCLC)一线(顺铂联用)治疗、乳腺癌二线治疗。
与Taxol相比,力扑素不含聚氧乙烯蓖麻油和无水乙醇,主要辅料有卵磷脂、胆固醇、苏氨酸和葡萄糖,大量的临床数据表明,该药不良反应显著降低。力扑素为冻干粉针,以5%葡萄糖溶液复溶分散后,静脉滴注3小时。为预防可能发生的过敏反应,在使用力扑素前三十分钟,需要静脉注射地塞米松或西米替丁、或肌肉注射苯海拉明进行预处理。至于为何力扑素不含聚氧乙烯蓖麻油仍需要进行预防过敏预处理,有专家认为这是因为脂质体的生产过程复杂,可能是由原料药或者中间体的控制不足所引起的。
白蛋白纳米粒技术由美籍华人黄馨祥(Patrick Soon-Shiong)开发,利用均质时的气穴空化作用,使白蛋白的游离巯基交联形成二硫键,在白蛋白彼此交联的过程中将药物包裹在纳米粒内部。紫杉醇白蛋白纳米粒(Abraxane)的载药量相比于Taxol提高了50%,且能高效地进入癌细胞内部。2005年2月,Abraxane作为全球首个白蛋白结合型紫杉醇纳米粒获FDA批准上市,至今仍是制剂改良最经典的案例。Abraxane目前已有三个适应症:转移性乳腺癌二线治疗、不可手术切除的局部晚期或转移性非小细胞肺癌(NSCLC)一线(卡铂联用)治疗、晚期胰腺癌一线(与吉西他滨联用)治疗。
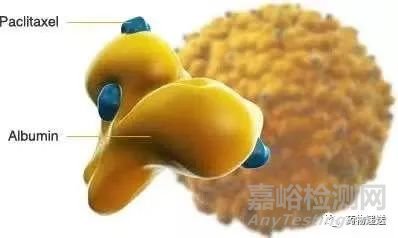
图6 白蛋白纳米粒示意图
Abraxane的临床优势主要体现在使用前无需用皮质激素及抗组胺药等预处理,可直接给药,规格为260mg/支,并且给药时间仅需三十分钟,极大地改善了病人的顺应性。鉴于其巨大的临床优势,截止2020年8月17日湖南科伦的该产品获批,国内已有四家企业攻克紫杉醇白蛋白纳米粒技术。
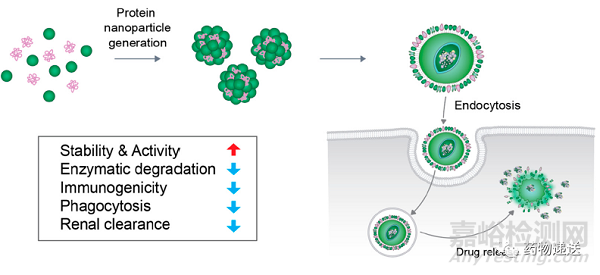
图7 白蛋白纳米粒作用示意图
2021年10月28日,上海谊众的紫杉醇胶束在国内获批上市,成为紫杉醇的新一代新型制剂产品。
谊众的紫杉醇胶束是剂型改良型新药,以创新药用辅料甲氧基聚乙二醇2000-聚丙交酯两亲嵌段共聚物(mPEG-PDLLA 53/47)为载体制备成胶束,在安全性、疗效方面均具有一定优势,获批适应症:本品联合铂类适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。
在此之前,国外已有三款紫杉醇胶束上市。由韩国Samyang公司研发的Cynviloq,作为全球首个紫杉醇胶束于2007年1月在韩国获批上市,并先后在印度、菲律宾、越南和印尼等亚洲国家上市;由瑞典Oasmia公司研发的Paclical,于2015年10月在俄罗斯上市,其核心技术是该公司独有的新型辅料XR-17;印度Sun Pharm公司研发的PICN,于2014年5月在印度上市,但因为有效性和安全性与紫杉醇白蛋白纳米粒相比无统计学差异,市场价值不大。
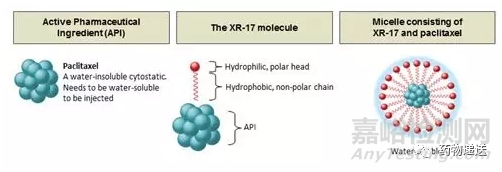
图8 Paclical结构示意图
总的来说,与紫杉醇的其他纳米制剂相比,紫杉醇胶束的临床价值主要有两点:增加耐受剂量以扩展适应症至胰腺癌、膀胱癌、卵巢癌等等;采用化学高分子材料以降低微生物污染和免疫抵抗等风险。
药物递送技术对不同类型的药物解决了“最后一公里”,只要能通往罗马,不管是怎样的路,都是人类福音的“大路”。希望药物递送技术能让通往罗马的“最后一公里”更平坦,走起来更轻盈。

来源:药物递送


