您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-16 05:19
摘 要 Abstract
本文通过对国际先行国家(地区)医疗器械命名数据库在框架结构、数据信息、检索服务等方面对比分析,探讨医疗器械命名数据库建设的工作思路,旨在为我国医疗器械命名数据库的建设提供参考。
By comparing and analyzing medical device nomenclature databases in advanced countries and regions in terms of database structure, basic data, retrieval service and other aspects, this paper discusses pathways for establishing medical device nomenclature database in China.
关键词 Key words
医疗器械;通用名称;术语;数据库建设
medical device; generic name; nomenclature; database construction
医疗器械产品种类繁多、所涉技术领域广、技术发展快,加之生产、经营、使用和监管各方对产品的关注角度不同,导致部分产品同物异名、同名异物的现象较为普遍,对医疗器械的注册审评、上市后监管等造成困难,甚至误导使用,影响了医疗器械科学监管和产业规范有序发展。
近年来,国家药监局针对医疗器械通用名称的命名管理提出了“规则统领、术语支持、数据库落地”的总体思路,稳步推进命名规则发布、医疗器械通用名称命名指导原则研究制定等工作,为医疗器械通用名称的规范提供了文件依据。随着具体技术领域通用名称命名指导原则的不断出台, 通过对国际先行国家(地区)医疗器械命名数据库进行研究,理清先进管理经验,为我国构建科学、规范、先进的医疗器械命名数据库(以下简称命名数据库)提供参考,为医疗器械的科学监管、智慧监管奠定良好基础。
一、国外医疗器械命名数据库简介
(一)全球医疗器械术语系统(Global Medical Device Nomenclature, GMDN)
GMDN 基于国际标准ISO15225 建立并实时更新,旨在提供一种医疗器械识别的“全球共同语言”,由各方自愿采用,以非营利性质的商业化运作进行管理维护。GMDN 机构采取有偿会员制度,通过网站或其他方式提供数据服务及信息产生收益。虽然GMDN 被称为“全球医疗器械术语系统”,但是其并不对收录产品进行属性界定,实际上是“健康相关产品”的术语系统。
GMDN 以优选术语为基本构成要素,形成了具有“器械类目-优选术语- 器械类型”三个层次结构的动态体系。优选术语是用于同类器械识别的唯一术语,由术语名称、术语描述和代码三部分组成,其中5 位代码是识别的核心指标,均由数字组成[1]。截至目前,GMDN 包含17 个器械类目,约25000 条优选术语和超过50 万个器械类型。此外还有2300 多个集合术语,将具有共同属性的优选术语进行关联[2]。
使用时,GMDN 支持关键词查询,通过器械类目、集合术语等关键词搜索后将关联的产品名称列出,可以查看产品的优选术语、术语描述、代码、术语状态、创建日期和修改日期等具体信息。在GMDN 网站上,各类术语可随时根据用户需求不断更新,用户可通过术语检索或分类检索两种方式查询已有产品术语。如无匹配项,可向GMDN 机构申请制定新术语。
(二)欧洲医疗器械术语系统(European Medical Device Nomenclature,EMDN)
基于欧盟医疗器械法规MDR(EU)2017/745 中第26 条,以及体外诊断医疗器械法规IVDR(EU)2017/746 中第23 条的相关要求, 欧盟委员会在意大利“国家医疗器械分类数据库”(Classificazione Nazionale Dispositivi medici,CND)的基础上建立EMDN [3]。EMDN 旨在支持欧洲医疗器械数据库(the European database onmedical devices, EUDAMED)相关功能的落地实施,将用于制造商在EUDAMED 中进行医疗器械产品的注册,与每个唯一器械标识中的医疗器械唯一标识(UDI-DI)相关联。EMDN 第一版已于2021 年5 月4 日发布。
EMDN 采用CND 中“类别-组别- 类型”3 个主要层次的整体架构,设置7 个产品等级,其中类别1 级、组别1 级、类型可根据产品实际灵活设置为0 至5个等级。同时,基础数据单元由英文版和意大利语版的医疗器械产品名称和相应的代码组成。其中代码由字母和数字组成,字母位作为首位,为A 至Z 中的某个字母;数字位最多为12 位,可根据具体等级设置选择代码位数,每两位数字对应1 个等级。当前公布的EMDN 中,共有22 个器械类别,172 个器械组别和8619个器械类型组成。
使用时,EMDN 支持关键词查询,以及树状浏览式查询,免费为用户展示英文版和意大利语版的医疗器械产品名称和相应的代码。此外,EMDN 免费为各方提供Excel、pdf 格式的电子版全部信息。在Excel 版本中,EMDN 还提供了与CND 数据的对应情况。
(三)日本医疗器械术语系统(Japanese Medical Device Nomenclature,JMDN)
2004 年, 日本厚生劳动省以通告的形式公布了JMDN,该通告为公开且要求强制执行的文件,其要求制造商不仅在注册时需要提供产品对应的JMDN 数据信息,而且还需要在产品标签等文件中标明产品的一般名称、JMDN 代码等信息。创建时,JMDN 参考了当时GMDN 的命名术语体系,并充分考虑了日本医疗器械监管实际。JMDN 根据监管需要和行业发展情况,采取公开发布变更文件的形式对个别条目内容进行调整,数据库随后会根据公告内容进行更新[4]。
JMDN 采用“品类- 类别-一般名称” 三个层级的整体结构,其核心为一般名称,类似于GMDN 中的优选术语,但包含的产品信息更为丰富,具体为:一般名称、代码、定义、分类、规则,以及相关管理文件的索引信息等。JMDN 代码为8 位,均由数字组成,是在GMDN 数据库的5 位数字后新增了3 位数字的后缀。2020 年数据显示,JMDN 数据库中收录产品共6 个品类、105 个类别和4349 条一般名称信息[4]。
使用时,JMDN 支持关键字查询、产品定义查询两种方式,提供日文和英文两个版本,以一般名称为基本单位免费展示相关信息,并提供产品适用的认证基准/ 承认基准/ 审查指导原则(如有)的文件链接。此外,JMDN免费向公众提供完整版(日文版本)和简化版(英文版本)下载服务。
(四)美国FDA 医疗器械分类数据库
美国食品药品监督管理局(FDA)采用法规文件和分类数据库的形式对医疗器械产品进行分类管理和编码识别,对产品命名并无明确要求。分类数据库采用“器械专业- 器械类型- 器械品种”三个层次的结构,以代码对器械品种进行识别,名称对代码予以辅助。
分类名称是目前美国FDA 唯一指定的、用途最为广泛的官方名称。分类名称是由一个名词加一至多个形容词组成,以逗号隔开,首位名词是产品的核心,其代码由3 个字母组成[5]。分类名称在医疗器械上市前(PMA、510K、IDE 等)、上市后(不良事件、进出口、召回、厂商注册及产品列表)、生物学评价许可过程中都需要提交。如果在分类数据库中查不到合适的名称和代码,可与美国FDA 相应部门联系,或提交一份分类申请,由专家咨询委员会指定相应名称和代码或制订新的名称和代码。
使用时,美国FDA 医疗器械分类数据库支持关键词查询,免费为公众提供产品名称(分类名称)、器械分类、法规编号和产品代码等具体信息。
二、医疗器械命名数据库对比研究
考虑到美国FDA 医疗器械分类数据库并非为医疗器械命名专门设计,产品名称仅为分类数据库的辅助识别信息。因此,本文对比研究未将其考虑在内,仅对GMDN、EMDN 和JMDN 三个医疗器械术语系统进行对比,具体详见表1。
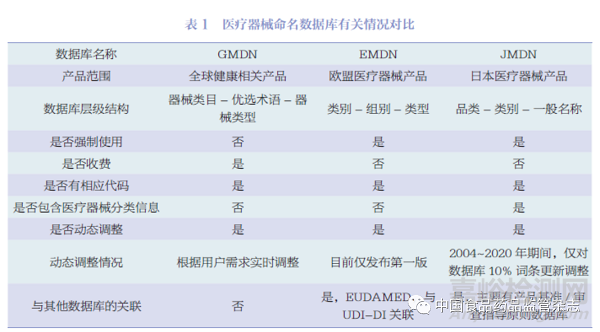
通过对比可知,GMDN、EMDN 和JMDN 三个数据库基本架构相对一致,均采用三级架构,具有与命名信息配套的代码,且设置了动态调整的工作程序。不同之处在于GMDN 服务于全球健康相关产品涉及的各方,由各方自愿采用,以有偿会员制提供服务,更注重用户需求,数据更新快。对于新的申请,GMDN机构大约在3 周之内处理完成有关工作。EMDN、JMDN 则注重于服务监管机构,范围仅包含所辖地区的医疗器械产品,相关信息均免费提供,在产品注册阶段有强制性要求且与本地区医疗器械产品的其他数据库有关联,以实现高效监管。动态调整方面, 尤其是JMDN 更注重长期的一致性和稳定性。数据显示,2004~2020 年期间, 仅对442个词条进行调整, 未更新词条3907 条,占比达90%[4]。
三、我国医疗器械命名数据库建设构想
我国在医疗器械通用名称命名体系建设中,曾专门就GMDN的管理情况、技术架构、应用情况开展研究,对其适用性进行分析[2]。从目前国际先行的医疗器械命名数据库建设情况来看,不同国家(地区)医疗器械命名数据库的建设框架基本一致,根据其工作目的在管理运行上有所不同,尤其是JMDN 的建设与我国情况更为贴近,在保证与国际接轨的基础上,更加注重服务监管实际,可为我国在医疗器械命名数据库建设中提供参考和借鉴。
(一)建设医疗器械通用名称数字词典
参考《医疗器械分类目录》中22 个子目录的划分,22 个技术领域医疗器械通用名称命名指导原则组成了我国医疗器械通用名称命名的术语词典。该词典包含了各技术领域典型产品适用的核心词和特征词,具体产品的通用名称采用“活字印刷式”命名技术方案,按照“特征词1(如有)+ 特征词2(如有)+ 特征词3(如有)+ 核心词”的结构编制[6]。虽然命名术语的结构有所不同,但GMDN、EMDN 和JMDN 均提供确定的产品名称。因此,我国在命名数据库建设中应首先建立医疗器械通用名称的数字词典,将特征词和核心词按要求组合,列举出具体产品的所有名称,开发关键字查询、树状浏览式查询等功能,以供各方根据产品的实际情况使用。
(二)探索命名术语与有关代码的对接
代码是互联网时代、数字化时代最通用且易于被识别的语言符号。虽然GMDN、EMDN 和JMDN 的编码方式各不相同,但是命名术语均配有相应的代码,以便识别,或与其他医疗器械产品数据库信息进行关联。目前,我国医疗器械通用名称在编制过程中并未单独编制与命名术语相对应的代码。然而,随着智慧监管、大数据监管的不断推进,数据整合将成为未来科学监管的趋势。因此,建议我国命名数据库建设过程中,可提前考虑命名术语与有关代码的对接,并预留相应的接口,不仅有利于国内医疗器械命名的落地实施,而且有助于与国际医疗器械命名的并行接轨。
(三)建立信息反馈机制,明确动态调整程序
无论是GMDN、EMDN 或JMDN 均设置了动态调整程序,考虑命名术语将随着医疗器械产品的不断发展调整更新。不同的是,GMDN 注重用户服务, 可根据用户需求申请更新;JMDN则注重服务监管,强调稳定性,通过发布变更文件的方式进行调整。因此,我国在命名数据库建设中同样可考虑建立需求及使用信息的反馈模块, 以便充分了解命名术语使用中的问题,明确符合我国监管实际的动态调整程序,平衡规范使用和产品发展之间的关系。
(四)为关联产品的其他数据库保留接口
JMDN 的“医疗器械一般名称+ 管理类别+ 分类规则”数据库模式,即将一般名称与产品分类数据、认证基准/ 审查指导原则相关联的做法[7],值得我国借鉴。在我国命名数据库建设初期,科学规划数据库的整体架构,并为下一步的命名数据开发利用预置接口非常必要。此模式可以使医疗器械命名数据库在重点解决命名问题的基础上,将医疗器械产品其他信息进行有机整合,既服务于从业者,也有利于监管方,从而促进医疗器械的智慧监管、科学监管。

来源:中国食品药品监管杂志