您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-25 15:42
目的: 通过对比溶出曲线,研究处方中的辅料对瑞舒伐他汀钙片溶出的影响。
方法:采用粉末直接压片工艺,通过单因素试验,考察处方中乳糖的型号、微晶纤维素的来源、钙盐的种类、交联聚维酮的型号及用量、硬脂酸镁的用量和包衣粉的用量对瑞舒伐他汀钙片溶出的影响。
结果:不同的乳糖型号(T80、PW80、315)、微晶纤维素来源(PH102、M102、102)、硬脂酸镁用量(0.5%、1%、2%)、包衣粉用量(2%、3%、4%)对溶出的影响差异较小,钙盐的种类(磷酸钙、无水磷酸氢钙、碳酸钙)、交联聚维酮的型号(XL、XL-10)及用量(3%、5%)对溶出的影响有一定差异。
结论:处方中的稳定剂及崩解剂对瑞舒伐他汀钙片的溶出有影响,填充剂、润滑剂及包衣粉对溶出影响较小。
关键词:辅料;瑞舒伐他汀钙片;溶出;直接压片
正文
瑞舒伐他汀钙是一种选择性HMG-CoA 还原酶抑制剂[1],由盐野义(Shionogi)与阿斯利康(AZ)联合开发研制,用于治疗原发性高胆固醇血症、混合型血脂异常症及纯合子家族性高胆固醇血症[2-3]。已在全球多个国家和地区上市,剂型为片剂,全球上市规格有2.5,5,10,20,40 mg,国内上市规格为5,10,20 mg。
瑞舒伐他汀钙片活性成分为瑞舒伐他汀钙,参比制剂辅料:微晶纤维素、乳糖一水合物、磷酸钙、交联聚维酮、硬脂酸镁以及包衣材料[4]。本品参比制剂中无粘合剂成分,推测为粉末直接压片工艺。粉末直接压片工艺简单易行,节能且高效,该工艺常用辅料[5]的发展及引入,推动了制剂工艺的发展,使其得以推广和实现。本文以瑞舒伐他汀钙片为研究对象,采用粉末直接压片工艺,以参比制剂为标准,系统研究处方中各辅料对制剂溶出的影响,旨在为仿制药开发和上市后辅料变更提供依据。
1材料
1.1 仪器
HBD-5 型固定料斗混合机(迦南科技集团有限公司);C&C800 型旋转压片机(北京创博佳维科技有限公司) ; BG1-5 高效包衣机( 北京航空制造工程研究所) ; AT7 Smart 型溶出仪(STOAX);1260 型高效液相色谱仪(Agilent)。
1.2 试药
瑞舒伐他汀钙原料药(山东朗诺制药有限公司,含量100.1%,批号170902001);瑞舒伐他汀钙对照品(中国食品药品检定研究院,含量97.6%,批号101028-201202);参比制剂(阿斯利康,10mg 规格,批号131956);乳糖(T80,MEGGLE,批号L104315215A552);乳糖(PW80,江苏道宁药业有限公司, 批号P181001 ) ; 乳糖( 315 ,KERRY, 批号8516031051 ) ; 微晶纤维素(PH102, FMC,批号P216829643);微晶纤维素(102,JRS,批号5610273519);微晶纤维素(M102,明台化工股份有限公司,批号C1808050);交联聚维酮(XL,ASHLAND,批号NPC-0042 ) ; 交联聚维酮( XL-10 ,ASHLAND, 批号0001964827 ) ; 磷酸钙( TRI-CAFOS 250 ,Budenheim,批号MV5730E);无水磷酸氢钙(DCPA 128,PRAYON,批号A057339);碳酸钙(SUDEEP,批号3GH0036);硬脂酸镁(浙江中维药业有限公司,批号180402);薄膜包衣预混剂(32K640002-CN,上海卡乐康包衣技术有限公司,批号THL52944)。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
2方法
2.1 处方工艺
处方:瑞舒伐他汀钙、乳糖、微晶纤维素、交联聚维酮、磷酸钙、硬脂酸镁及薄膜包衣预混剂。处方中辅料用量设计参考俄罗斯药监局公布的10 mg 规格瑞舒伐他汀钙片(阿斯利康)的辅料用量[6]:乳糖(89.50 mg/片)、微晶纤维素(29.82 mg/片)、磷酸钙(10.90 mg/片)、交联聚维酮(7.50 mg/片)、硬脂酸镁(1.88 mg/片)、薄膜包衣预混剂(组分总和4.50 mg/片)。为便于生产投料的折算,自研制剂在此基础上通过适量优化调整,片芯总重150 mg,瑞舒伐他汀钙10.40 mg/片,辅料用量:乳糖(90.00 mg/片)、微晶纤维素(30.00 mg/片)、磷酸钙(10.60 mg/片)、交联聚维酮(7.50 mg/片)、硬脂酸镁(1.50 mg/片)、薄膜包衣预混剂(组分总和4.50 mg/片)。本文研究中按照2 000 片处方投料。
工艺:在混合料斗中顺次加入1/2 的乳糖、原料药、微晶纤维素、交联聚维酮和磷酸钙,以10r·min-1 混合20 min;之后加入剩余的乳糖,以10 r·min-1 混合20 min;再加入硬脂酸镁,以10 r·min-1混合10 min;最后进行压片和包衣。
2.2 溶出方法
瑞舒伐他汀钙片在pH 1.0 盐酸溶液中溶出速率最慢,故以此介质作为筛选条件[7]。照溶出度与释放度测定法[8]( 桨法) , 以pH 1.0 盐酸溶液为溶出介质(900 mL)、转速50 r·min-1,温度(37±0.5)℃进行溶出试验,在5,10,15,30,45,60 min 取样,测定累积溶出量,绘制溶出曲线。
2.3 溶出曲线相似性
根据国家药品监督管理局药品审评中心发布的《普通口服固体制剂溶出曲线测定与比较指导原则》中推荐使用的相似因子(f2)法,评价溶出曲线相似度,若50≤ f2 ≤100,表示自研制剂与参比制剂溶出行为相似[9]。指导原则明确了f2 法最适合3~4 个或更多取样点,且溶出量超过85%的时间点不超过1 个,故根据参比制剂及自研制剂的溶出情况,选择5,10,30 min 取样点累积溶出量计算f2。
2.4 检测方法及验证
按高效液相色谱法[10](中国药典2020 版四部通则0512),参考进口注册标准(JX20050198)[11]溶出度项下的色谱条件,按外标法以峰面积计算。
2.4.1 色谱条件
色谱柱:XBridgeC18(4.6 mm×150 mm,3.5 μm);以水-乙腈-磷酸(600: 400: 1)为流动相;检测波长:242 nm;柱温:40 ℃;流速:1.0 mL·min-1;进样量:10 μL。
2.4.2 溶液的制备
对照品溶液:精密称取瑞舒伐他汀钙对照品约11 mg,置100 mL 量瓶中,加溶出介质溶解并稀释至刻度,摇匀作为对照品贮备液。精密量取对照品贮备液1 mL,置10 mL 量瓶中,加溶出介质稀释至刻度,摇匀即得。
供试品溶液:取瑞舒伐他汀钙片,照“2.2”项下方法取样10 mL,过0.45 μm 水系滤膜,弃去初滤液3 mL,取续滤液即得。
空白溶液:取处方量的辅料混合均匀,照“供试品溶液”操作方法,制成空白溶液。
2.4.3 专属性
分别精密吸取空白溶液、对照品溶液及供试品溶液各10 μL,注入液相色谱仪,记录色谱图(图1),结果表明溶出介质及辅料对测定无干扰,方法专属性良好。
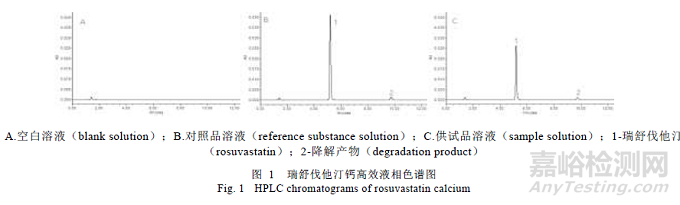
2.4.4 溶液稳定性
精密量取“2.4.2”项下对照品溶液,按“2.4.1”项下色谱条件分别在0,2,4,8,12,16,20,24 h测定其峰面积。以主峰面积计,各时间点主峰面积随时间的增加呈降低趋势(37 ℃条件下,从0 h 的100.0%降低到24 h 的75.6%;10 ℃条件下,从0 h 的100.0%降低到24 h 的91.5%。),样品不稳定。以主峰面积和降解产物峰面积的和计算,在37 ℃和10 ℃条件下各时间点峰面积相对0 h 均在98.0%~102.0%范围内,表明按此法计算,稳定性良好。
2.4.5 滤膜吸附
取对照品溶液和供试品溶液各两份,一份离心后取上清液,另一份用0.45 μm 的水系滤膜过滤,分别弃去初滤液0,1,2,3,5 mL 后取续滤液进行测定。对照品溶液和供试品溶液在弃去不同体积初滤液后,与离心样品峰面积的比值均在98.0%~102.0%范围内,可认为滤膜对样品无吸附作用,选择弃去初滤液3 mL。
2.4.6 线性范围
精密量取“2.4.2”项下对照品贮备液适量,加溶出介质,分别稀释成质量浓度为1.12,2.23,5.58,11.17,16.75,22.34,33.50 μg·mL-1 的7 份线性溶液,以溶液浓度(X)为横坐标、峰面积(Y)为纵坐标进行线性回归。瑞舒伐他汀钙在1.12~33.50 μg·mL-1 浓度范围内,回归方程Y=22449.655 3X+822.060 9,r= 0.999 9,表明线性关系良好。
2.4.7 精密度
精密量取“2.4.2”项下对照品溶液,按“2.4.1”项下色谱条件连续进样5 次(峰面积为251593,251081,250118,251196,252887),计算峰面积RSD 为0.4%,表明方法精密度良好。
2.4.8 重复性
取 6 份“2.4.2”项下供试品溶液,按“2.4.1”项下色谱条件测定各样品溶出量(分别为93.08%,90.69%,90.02%,93.88%,93.54%,90.59%),计算RSD 为1.9%,表明方法重复性良好。
2.4.9 准确度
在处方量空白辅料的 900 mL pH 1.0 介质溶出液中,分别加入相当于制剂中药物含量50%、100%、150%的对照品,搅拌混匀,制备低、中、高3 种浓度溶液各3 份,按“2.4.1”项下的条件进样,记录色谱图,计算回收率(表1)。所有浓度回收率均在98.0%~102.0%范围内,9 个回收率数据的RSD 为0.8%,小于2.0%,表明该方法准确度良好。
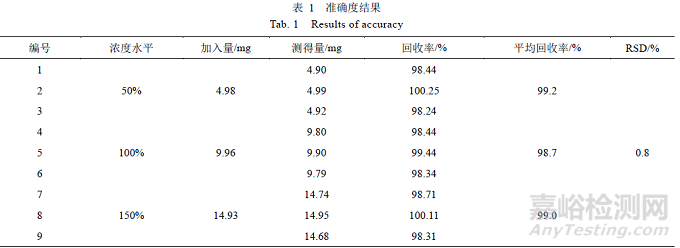
经验证,所建HPLC 方法专属性、稳定性、线性、精密度、重复性、准确度良好,适用于瑞舒伐他汀钙片在pH 1.0 盐酸介质溶出液的测定。
3结果
3.1 乳糖型号的影响
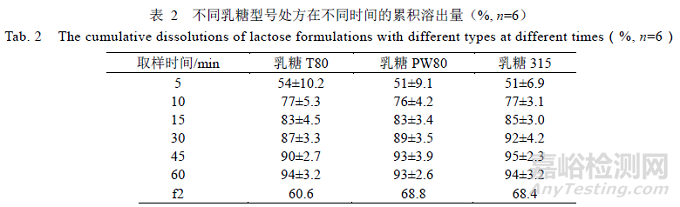
乳糖作为填充剂,占比达到60%,选择3 种不同厂家乳糖型号制备样品,对比结果,见表2,溶出曲线f2 均>50,与参比制剂相似。表明所选乳糖对处方溶出的影响差异较小,在制剂开发过程中均可作为选择。
3.2 微晶纤维素来源的影响
微晶纤维素作为填充剂,占比为20%,选择3 种不同来源、相同型号的微晶纤维素制备样品,对比结果,见表3,溶出曲线f2 均>50,与参比制剂相似。表明所选微晶纤维素对处方溶出的影响差异较小,在制剂开发过程中均可作为选择。

3.3 交联聚维酮型号及用量的影响
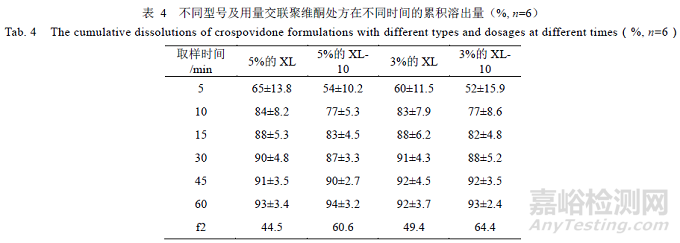
交联聚维酮作为崩解剂,在处方中占比较小,为5%,选择不同型号及用量的交联聚维酮制备样品,对比结果,见表4,交联聚维酮XL(3%、5%)处方,溶出曲线f2 均<50,与参比制剂不相似;交联聚维酮XL-10(3%、5%)处方,溶出曲线f2 均>50,与参比制剂相似。表明交联聚维酮的型号及用量对处方溶出的影响有一定差异,优选交联聚维酮XL-10,用量在3%~5%。
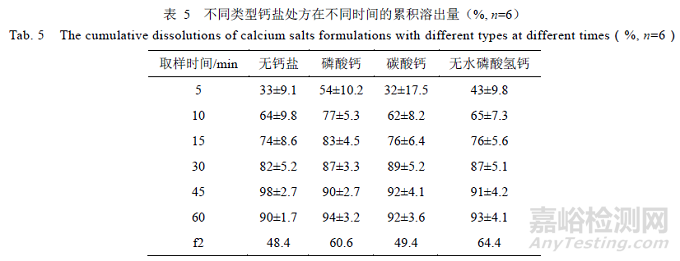
3.4 不同类型钙盐的影响
钙盐作为稳定剂,占比7.1%,通过稳定片剂微环境(pH 值),从而抑制内酯的生成[7]。选择不同类型的钙盐制备样品,对比结果,见表5,没有加钙盐的处方和碳酸钙处方,溶出曲线f2<50,与参比制剂不相似;磷酸钙与无水磷酸氢钙处方溶出曲线f2>50,与参比制剂相似。表明不同类型的钙盐对处方的溶出有一定影响,磷酸钙与无水磷酸氢钙的处方可作为选择。
3.5 硬脂酸镁用量的影响
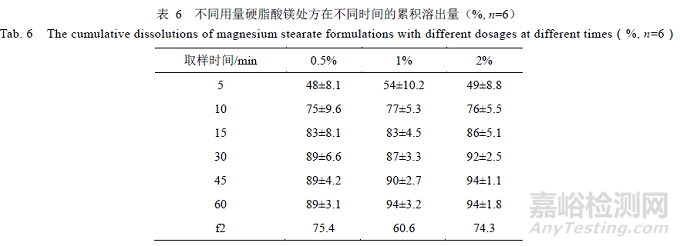
硬脂酸镁作为润滑剂,占比较小,为1%,具有疏水性,能减缓药物的溶出速度。选择不同用量的硬脂酸镁制备样品,对比结果,见表6,溶出曲线f2 均>50,与参比制剂相似。表明硬脂酸镁用量(0.5%、1%、2%)对溶出的影响较小,用量可选择0.5%~2%。
3.6 包衣粉用量的影响
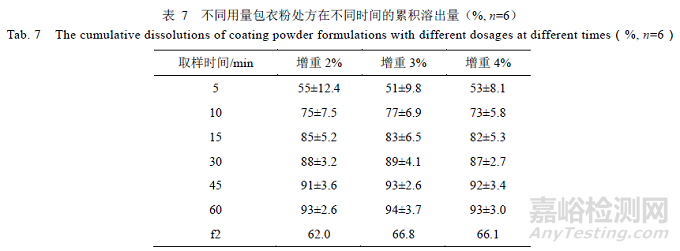
包衣粉可以优化产品外观,改进产品的口味及气味,也能避免速释片剂受潮,用量为片芯的3%。采用同一批片芯,分别在包衣增重2%、3%和4%时取样,对比结果,见表7,溶出曲线f2 均>50,与参比制剂相似。表明不同用量包衣粉(2%、3%、4%)对溶出的影响较小,包衣增重可选择2%~4%。
3.7 处方重现试验
根据以上研究情况,按照相同的处方工艺,重复3 次,如表8 所示,自研制剂与参比制剂在pH 1.0,4.5,6.8 及水4 种介质的溶出结果见表9~12 所示。
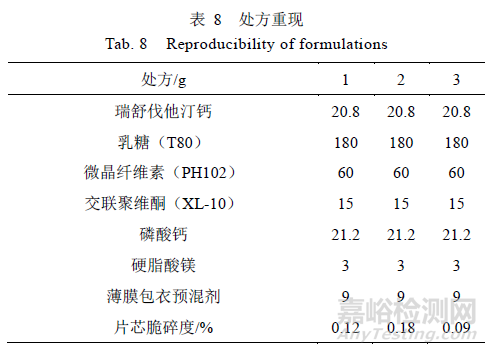
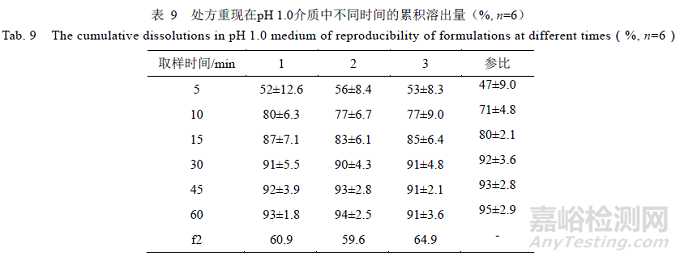

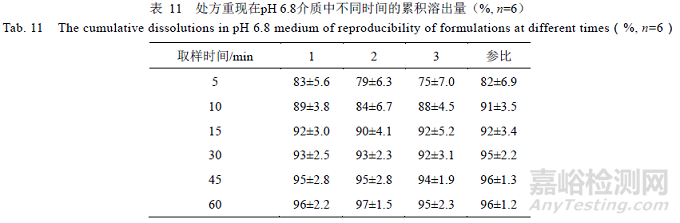
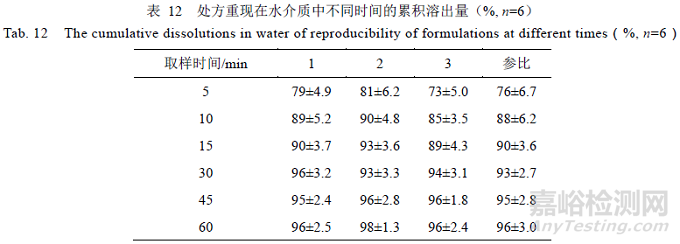
结果表明,重现处方样品在pH 1.0 介质溶出曲线f2 均>50,与参比制剂相似;在pH 4.5,6.8 和水介质中,15 min 累积溶出量均>85%,与参比制剂相似。综上,筛选的处方重现性良好。
3.8 小结
通过研究瑞舒伐他汀钙片中各辅料对溶出的影响,结果表明乳糖、微晶纤维素型号及来源、硬脂酸镁用量、包衣粉用量对溶出的影响差异较小,在产品开发及上市后辅料变更中可作为低风险因素控制;交联聚维酮型号及用量、钙盐种类对溶出的影响有一定差异,在产品开发及上市后辅料变更中需作为高风险因素控制。通过处方重现试验,最终筛选的辅料型号及用量可作为本品开发及辅料变更的依据。
4讨论
4.1 溶出介质的选择
瑞舒伐他汀钙属于BCS Ⅲ类物质,具有高溶解性[12]。根据参比制剂在pH 1.0,4.5,6.8 及水4种介质中溶出情况,pH 1.0 介质中溶出速率最慢[7],自研与参比的相似程度不同,最具有区分力;其它3 种介质中,自研与参比在15 min 溶出量均达到85%以上[9],溶出相似,无明显区分力。美国FDA 公布的溶出方法参照2018 年溶出指导原则[13],该指导原则推荐首选0.1 mol·L-1 盐酸溶液(即pH 1.0 介质)。为使自研与参比在体外溶出相似,减小生物等效性风险,故选择pH 1.0 介质作为筛选的溶出曲线。
4.2 吸收部位
瑞舒伐他汀钙绝对生物利用度低,约为 20%,绝大部分以原形药从粪便及尿液中排泄[4],目前国内外文献尚无报道其在人体内的具体吸收部位。日本的原研制剂IF 文件[14]中显示瑞舒伐他汀钙在大鼠的整个胃肠道吸收程度相同(胃内74.7%、小肠上段82.4%、小肠中段91.9%、小肠下段78.0%、结肠87.3%、直肠78.1%),由此推测在人体的胃肠道吸收程度类似。因此瑞舒伐他汀钙在胃内的溶解情况可能对其吸收有影响,为减小生物等效性风险,应提高自研与参比在pH 1.0 介质中的溶出相似性。
4.3 工艺的选择
已有文献报道了瑞舒伐他汀钙片制备工艺[15-18],瑞舒伐他汀钙在酸性条件下容易产生降解杂质[7,19],湿法制粒工艺复杂,对产品的稳定性要求较高,风险较大。粉末直压因工艺简单、对产品的稳定性要求低、生产成本低等优点,已逐渐成为制剂工艺的趋势。故本文采用粉末直接压片工艺对处方中的辅料进行研究。
4.4 辅料的影响
不同的乳糖型号、微晶纤维素来源、硬脂酸镁用量、包衣粉用量的处方在pH 1.0 介质中溶出曲线均与参比制剂相似。不同处方均在2 min 内全部崩解,崩解现象基本一致。推测乳糖和微晶纤维素型号及来源不同,粉体性质有差异,但本质和比例未发生变化,与原料药混合均匀,压片后,原有的粉体性质被破坏、重组,形成结构相似的片剂,故溶出现象及溶出曲线相似。硬脂酸镁和包衣粉占比小,对片剂崩解及溶出难以形成延迟效应,因此溶出曲线相似。
钙盐的种类、交联聚维酮的型号及用量的处方在pH 1.0 介质溶出有差异。磷酸钙与无水磷酸氢钙处方崩解速度与参比制剂基本一致,溶出现象及溶出曲线相似。碳酸钙处方可能是碳酸钙与盐酸反应产生气体导致片剂上浮,且气体在片剂内部导致水分不易进入,崩解剂无法充分发挥作用,致使崩解较慢,影响溶出。交联聚维酮XL 比XL-10 粒径大,崩解作用更强,在用量较低3%~5%时,辅料粒径的作用更加明显,从而导致XL(3%、5%)在前15min 的溶出比参比制剂快,与参比制剂不相似;XL-10 粒径小,崩解作用较弱,用量在3%~5%时,崩解作用差异不大,与参比制剂相似。
4.5 试验设计及数据分析
本文基于粉末直压工艺及原研制剂处方设计试验,采用单因素试验考察辅料对溶出的影响。考虑到乳糖、微晶纤维素型号较多及产品上市后的辅料变更诉求,选择粉末直压用辅料型号,湿法制粒或者干法制粒等用途的型号未列入考察范围,因此有一定的不足。根据指导原则[9],采用非模型依赖法中的相似因子(f2)法进行数据分析及比较,选择3 个取样点,f2≥50,溶出行为相似;f2<50,溶出行为不相似。

来源:中国医院药学杂志


