您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-28 10:53
什么是胰岛素泵治疗?
胰岛素泵治疗是采用人工智能控制的胰岛素输入装置,通过持续皮下输注胰岛素的方式,模拟胰岛素的生理性分泌模式从而控制高血糖的一种胰岛素治疗方法。内装有一个放短效或速效胰岛素的储药器,外有一个显示屏及一些按钮,用于设置泵的程序,灵敏的驱动马达缓慢地推动胰岛素从储药器经输注导管进入皮下。保持全天血糖稳定,以达到控制糖尿病的目的。
1、为什么要开展药物相容性研究?
胰岛素泵在临床使用时,可能会与药物发生相互作用,这些相互作用主要包括器械对药物的吸附作用以及器械中的某些物质向药液的迁移等。一方面,医疗器械中的可沥滤物伴随着药物输注进入人体,可能会存在影响临床给药质量或安全性方面的潜在风险。另一方面,器械对药物的吸附可能导致对临床治疗效果的影响,尤其是某些需要低剂量给药,或者是需要较为精确给药的治疗过程。因此,监管机构会要求企业提供医疗器械的药物相容性研究报告。综上,胰岛素泵的药物相容性研究应从器械的可沥滤物、对药物质量的影响和药物吸附几个方面入手。
2、如何开展已知可沥滤物研究?
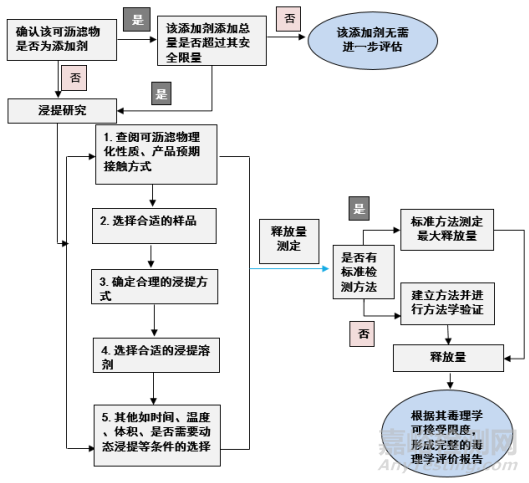
我们先通过医疗器械审评中心(CMDE)发布的指导原则看一下医疗器械已知可沥滤物测定的一般流程(图2)。首先我们可以通过一些途径来获取已知可沥滤物的信息,例如原材料供应商,生产工艺文件,已有的医疗器械标准或者是通过浸提试验来获取潜在的可沥滤物。接下来需确认该可沥滤物是否超过了其安全限量。如果添加总量没有超过其安全限量,则无需进一步评估。如果可沥滤物不是添加剂或者添加量超过了安全限量。我们采取的策略是进行浸提研究,此时需查阅可沥滤物的理化性质,产品的临床接触方式,使用方式来确定合理的浸提方式和浸提溶剂,以及浸提时间,温度,以及是否采用动态浸提等。
对于药物相容性研究而言,由于器械会用于很多种不同的胰岛素药物,不同胰岛素药物对拟研究可沥滤物的迁移能力影响也不相同,很难找到一个满足所有要求的浸出溶剂,所以一般优先建议选用极限浸提或加严浸提方式最大程度模拟临床最恶劣条件下的浸提环境,否则建议选择酸性、碱性、脂溶性药物,或者特殊成分组成药物作为典型药物研究。浸提结束后,测定可沥滤物释放量,当然如果有标准方法优先选用标准方法,如果没有应该先进行方法学验证,再测定释放量,根据其释放量是否超过允许限量,形成完整的可沥滤物安全性研究报告。
医疗器械已知可沥滤物测定的一般流程
已知可沥滤物的信息可以通过以下途径获得:
(1)从原材料供应商处获得材料的组成信息并预测潜在的可沥滤物;
(2)通过生产工艺文件获得额外的加工助剂信息,例如脱模剂、粘合剂、抛光膏等;
(3)通过已有医疗器械用材料的标准、文献等资料查阅获得潜在的可沥滤物信息;
(4)通过浸提试验获得信息,预测潜在的可沥滤物
可沥滤物安全性评价:
(1)建立拟研究物质的允许限量
(2)应在模拟临床最坏使用环境下测定其释放量
(3)根据其释放量是否超过其在该产品该预期用途下的允许限量
(4)形成完整的可沥滤物安全性研究报告
医疗器械的常见可沥滤物一般包括材料中的单体及添加剂、灭菌残留、加工工艺残留、溶剂或降解产物等(图3)。这些物质通过相关介质进入人体,会形成可沥滤物的安全性风险。例如BPA是合成聚碳酸酯和聚砜等高分子聚合物的常用单体。有文献报道,BPA 具有一定的胚胎毒性和致畸性,可明显增加动物卵巢癌、前列腺癌、白血病等癌症的发生[4-5]。聚氨酯材料常采用MDI或HMDI作为异氰酸酯类单体。但有研究表明MDI具有致突变性。在亚慢性毒性、慢性毒性、致癌性试验中,MDI均有毒性反应[6-8]。部分增塑剂例如DEHP会对人体生殖系统,特别是未成年男性发育产生影响。那么对于一些工艺的残留,例如DMAC, NMP等也对生殖系统有损害。因此,监控一些常见的可沥滤物,以确保最终医疗器械的安全有效就显得尤为重要。
3、如何开展医疗器械未知可沥滤物研究?
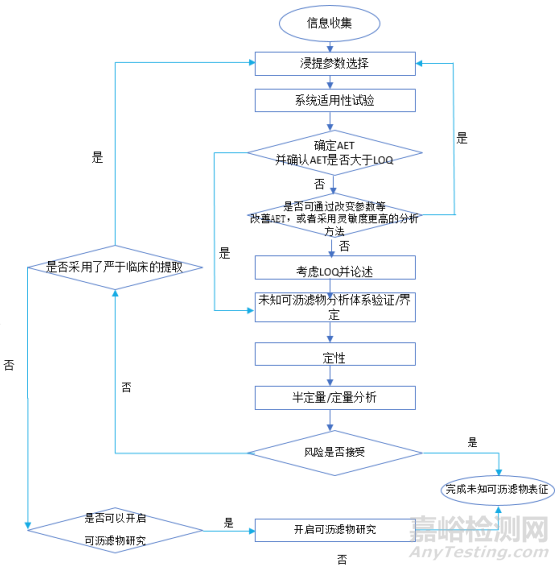
对于未知可沥滤物研究也就是可浸提物研究的基本程序(图4),与已知可沥滤物研究不同的是一开始我并不知道目标物质是什么?我们需要去发现潜在的、存在风险的可沥滤物。所以需要基于一个广泛认可的毒理学关注阈值来设一条警戒线,那么这条警戒线如何设定呢?
医疗器械未知可沥滤物研究程序
信息收集:
充分的信息搜集有助于产品的可沥滤物研究分析
器械的结构及材料组成信息
来自于原材料供应商的信息
拟研究材料/器械的理化特性及与可沥滤物相关的文献信息
器械的生产工艺信息
已有的历史数据库信息
与未知可沥滤物研究相关的临床应用信息
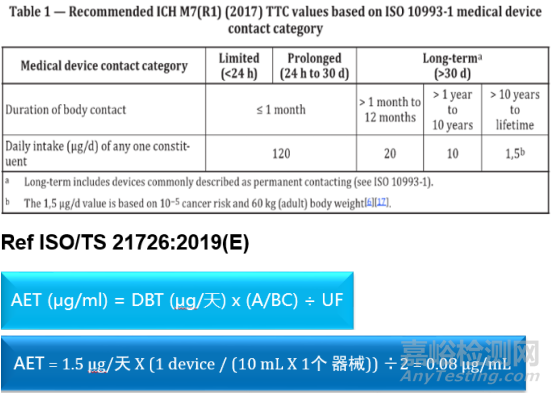
需要一个分析评估阈值(AET)的概念,可把它当做化学家和毒理学家沟通的一个桥梁。一般情况下,毒理学家会给出一个物质每日的最大耐受量单位是ug/day。对于分析化学家来讲开发一个分析方法需要满足衡量这一限度的要求。如何进行这种思维方式的转换,我们引入了一个公式(图5)。那么对于长期给药医疗器械选取最严苛TTC 1.5 ug/day进行计算,结合器械的临床使用情况、浸提溶剂需求量以及不确定因子,可计算出对应的AET。

那么计算出AET后,我们需要确保我们的分析方法的LOQ或LOD要小于我们的AET。如果大于我们的AET,我们需要采用灵敏度更高的分析手段或者采用浓缩的方式来改善我们的AET。如果满足要求,我们需要进一步的做定性和半定量或定量分析,获取器械的每日最大暴露量,并进行毒理学风险评估。如果器械的风险可接受,我们就完成整个研究过程,如果不可接受,还需要开启可沥滤物研究来排查风险。
4、为什么只测试已知可沥滤物
并不能涵盖所有风险?
已知可沥滤物一般来源于原材料或最终医疗器械生产过程中添加的添加剂,如抗氧化剂、稳定剂等成分。例如抗氧剂1010为酚类抗氧剂,是抗氧剂的优秀品种之一。抗氧剂1010对聚丙烯、聚乙烯有卓越的抗氧化性能。可有效地延长制品的使用期限。抗氧剂1010能有效地防止聚合物材料在长期老化过程中的热氧化降解,同时也是一种高效的加工稳定剂,能改善聚合物材料在高温加工条件下的耐变色性。对于药物相容性的迁移研究,常以抗氧剂1010作为已知可沥滤物为研究对象,以临床常见药物或酸碱缓冲液作为浸提介质进行迁移研究。但实际情况下,抗氧剂1010实际在浸提介质的迁移并不只是它本身,而是它的一些降解产物,如图6。因此开发分析方法只关注抗氧剂1010并不科学,会引起毒理评估的误判。
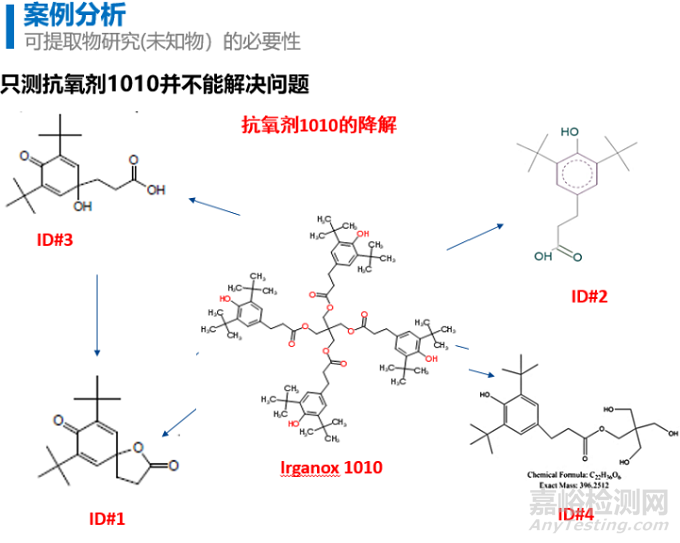
图 抗氧剂1010和降解产物
5、如何开展医疗器械的药物吸附研究?
药物吸附研究包括三部分内容:1. 药物选择;2. 方法验证;3. 吸附试验(图2)。在选择药物时,应选择临床的代表性药物,一般情况下选择酸性、碱性、脂溶性或特殊成分的代表性药物为宜。同时结合产品的临床使用条件,如输注方式、给药剂量、药物浓度、输液载体、输注流速,选取最严苛的临床条件进行研究。一般情况下,药物浓度较高的吸附率小于较低浓度,药物浓度越低,吸附的风险越高。对于药物吸附而言,输注的流速越低,药物在输注器具的留存时间就越长,那么产生吸附的概率就越高。但可沥滤物的迁移可能并不存在相同的规律,所以通常在吸附试验中采取最快和最慢两种流速来考察流速对药物吸附的影响。

图 医疗器械药物吸附研究
在选取好药物后,就需要开展药物的方法学验证,可以采用药典方法并进行方法确认,也可以参考YY/T 1550.1考察专属性、线性、精密度和稳定性等参数,进行方法验证。对于药物吸附试验,应选取具有代表性的器械材料种类和规格,在考虑温度、输注流速和光照影响等条件下,在不同时间点考察药物的吸附率。此外,一些要求严格的监管机构还要求企业参照药典对药物质量进行研究, 并提供对应的方法学确认资料。
参考资料
1. FDA Guidance: Use of International Standard ISO 10993-1, “Biological evaluation of medical devices – Part 1 : Evaluation and testing within a risk management process”
2. 医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则 (2019)
3. 医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则(征求意见稿)
4. 邓茂先,吴德生,詹立. 环境雌激素双酚A的生殖毒理研究[J]. 环境与健康杂志,2001,18(3):134- 136,150.
5. 李勇,裴新荣,龙鼎新,等. 双酚A对植入后大鼠、小鼠胚胎致畸性的体外实验研究[J]. 卫生研究,2003, 32(2):89-92.
6. 季宇彬,于蕾,纪红蕊等. 甲苯二异氰酸酯对免疫系统的毒性及作用机制[J]. 哈尔滨工业大学学报,2005, 37(3):362-367.
7. Robyn L,Prueitt Lorenz R.Rhomberg,管娜,等. 甲苯二异氰酸酯(TDI)致癌性的综合评估[J]. 生态毒理学报,2016,11(4):26-60.
8. 刘保峰,封琳敏,张明. 甲苯二异氰酸酯毒性及其对职业接触人群健康影响研究进展[J]. 中国职业医学, 2016,43(1):101-104,111.
9. YY/T 1550.1-2017 一次性使用输液器具与药物相容性研究指南第1部分:药物吸附研究
10. YY/T 1550.2-2019 一次性使用输液器具与药物相容性研究指南 第2部分:可沥滤物研究 已知物
11. GB/T 16886.1-2011, 医疗器械生物学评价-第1部分:风险管理过程中的评价与试验
12. GB/T 16886.12-2017, 医疗器械生物学评价-第12部分:样品制备与参照材料
13. GB/T 16886.17-2005,医疗器械生物学评价 第17部分:可沥滤物允许限量的
14. GB/T 16886.18-2011, 医疗器械生物学评价-第18部分:材料化学表征
15. ISO/TS 21726: 2019, Biological evaluation of medical devices- application of the threshold of toxicological concern (TTC) for assessing biocompatibility of medical device constituents.
16. ISO 10993-1: 2018, Biological evaluation of medical devices – Part 1: Evaluation and testing within a risk management process
17. ISO 10993-12: 2021, Biological evaluation of medical devices – Part 12: Sample preparation and reference materials
18. ISO 10993-17:2002,Biological evaluation of medical devices — Part 17: Establishment of allowable limits for leachable substances
19. ISO 10993-18: 2020, Biological evaluation of medical devices – Part 18: Chemical characterization of medical device materials within a risk management process
20. 叶成红,王永清,杨宇希,孟颖,骆红宇,沈永.医疗器械可沥滤物安全性研究(Ⅰ):常见可沥滤物[J].中国药事,2019,33(08):875-879.DOI:10.16153/j.1002-7777.2019.08.006.
21. 叶成红,邓洁,肖丽,杨宇希,骆红宇,沈永.医疗器械可沥滤物安全性研究(Ⅱ):残留量检测[J].中国药事,2019,33(10):1116-1120.DOI:10.16153/j.1002-7777.2019.10.006.
22. 叶成红,王永清,孟颖,王全军,刘成虎,柯林楠.医疗器械可沥滤物安全性研究(Ⅲ):允许限量建立[J].中国药事,2019,33(11):1259-1263.DOI:10.16153/j.1002-7777.2019.11.008.

来源:药明康德


