您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-05-31 12:54
前言
随着近些年我国生物医药行业的改革不断展开,药学开发与国际接轨已成大势所趋。对于药物固体形态研究,中、美、欧各国及ICH方面均有指导原则。在“立足国内,放眼世界”的新一轮药物研发浪潮中,如何在国际申报的相关要求下,有的放矢地进行晶型研究显得尤为重要。我们特邀制药行业专家,结合相关法规要求梳理药物晶型的研究流程,作为行业同仁的工作参考。
近年来,药物晶型受到的关注越来越多,这一方面是由于晶型本身自带专利属性,具有排他性,可通过专利确权进行破防,仿创皆有可为;另一方面,晶型作为一项重要的质量属性,承载了多种理化性质(溶解度、稳定性、粒度粒形等),对药品的安全、有效和质量可控影响甚巨,故而需要加以控制。当下,对于晶型的专利属性,业内同仁通过晶型筛选和结晶工艺的研究,破防有道,各显神通,各国专利局及专利链接制度对晶型专利的要求不尽相同;而对于晶型的质量属性,各国药监机构对晶型质量的研究程度及控制要求基本趋向一致。
本文梳理了国内外的晶型研究相关指导原则,并就其主要的异同点进行简要的对比分析与解读。
一、国内外晶型研究相关指导原则概览
1国内对药物晶型的相关规定
中国药典
(2015年版)
《9015 药品晶型研究
及晶型质量控制指导原则》
中国药典
(2020年版)
《9015 药品晶型研究
及晶型质量控制指导原则》
国家药审中心
(2022年)
《化学仿制药晶型研究
技术指导原则(试行)》
国内与晶型研究直接相关的指导原则最早见于2015年版的《中国药典》<9015药品晶型研究及晶型质量控制指导原则>,该指导原则涵盖晶型的基本概念、制备方法、稳定性及评价方法,重点着力于晶型质量的控制方法,包括原料药以及制剂晶型的定性和定量方法。
在2020年版的《中国药典》中,该指导原则又新增了关于共晶的阐述及其鉴别方法。
而国家药审中心2022年1月4日发布的《化学仿制药晶型研究技术指导原则(试行)》,明确了仿制药晶型研究的总体思路和研究方向,并主要以晶型对生物利用度的潜在影响来建构了晶型控制决策树。关于该指导原则的解读可参考晶研谈第7期,也是笔者的文章《仿制药晶型研究到底怎么做?CDE指导原则定基调》。
2国外对药物晶型的相关规定
ICH(1999年)
《Specifications: Test Procedures And Acceptance Criteria For New Drug Substances And New Drug Products: Chemical Substances Q6A》
FDA(2007年)
《ANDAs: Pharmaceutical Solid Polymorphism》
EP(2008年)
《Polymorphism》
EMA(2015年)
《Reflection paper on the use of cocrystals
of active substances in medicinal products》
FDA(2018年)
《Regulatory Classification of Pharmaceutical
Co-crystals Guidance for Industry》
WHO(2018年)
《Polymorphism Draft chapter for
The International Pharmacopoeia》
国外与晶型研究直接相关的指导原则最早见于1999年ICH Q6A中,该指导原则通过决策树4明确了新原料药和新制剂的晶型控制策略。
2007年FDA首次对仿制药的晶型研究总体思路和控制策略进行了系统的阐述。2008年欧洲药典在《5.9 Polymorphism》中对晶型的概念、分类、稳定性、制备方法和表征方法做了简单的介绍。
2015年和2018年EMA及FDA相继对药物共晶的应用及注册分类发布了指导原则。
此外,2018年WHO也结合各国的晶型研究相关指导原则对多晶型作了更详细的阐述。
总的来说,国内外晶型研究相关指导原则对于晶型的概念、稳定性、制备方法、表征方法以及决策树基本趋同。我国相对于其他国家在晶型控制方法上发布了专门的指导原则(《药品晶型研究及质量控制指导原则》),而美国及欧洲对药物共晶给出了相关指导原则,下面笔者将从晶型控制决策树和共晶两方面对相关指导原则的异同点进行简要的的对比分析。
二、关于晶型控制决策树
晶型控制决策树主要用于指导原料药和制剂中晶型检查项的制定,是晶型研究指导原则的核心内容,也是保证药物安全有效、质量可控的重要保障,更是业界同仁关注的焦点。下图分别为摘录的中国、美国和ICH的晶型控制决策树。
1图1晶型控制决策树(中国)
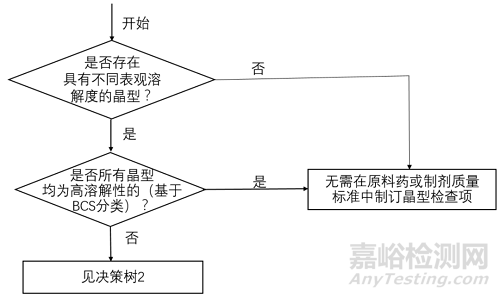
决策树1 制定晶型检查项的必要性
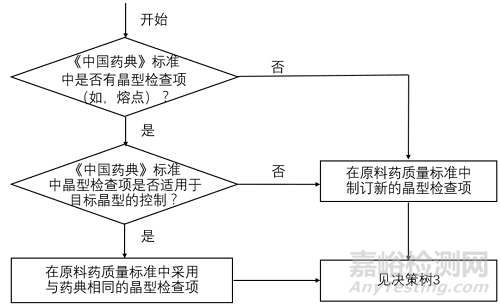
决策树2 原料药晶型检查项的制定
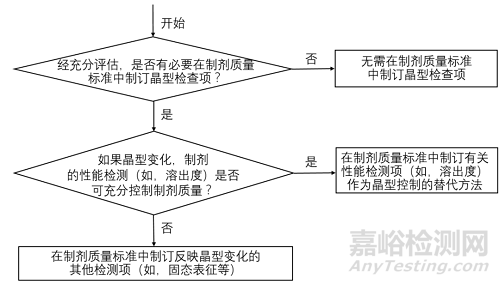
决策树3 制剂晶型检查项的制定
*摘录自《化学仿制药晶型研究技术指导原则(试行)》
2图2晶型控制决策树(美国)
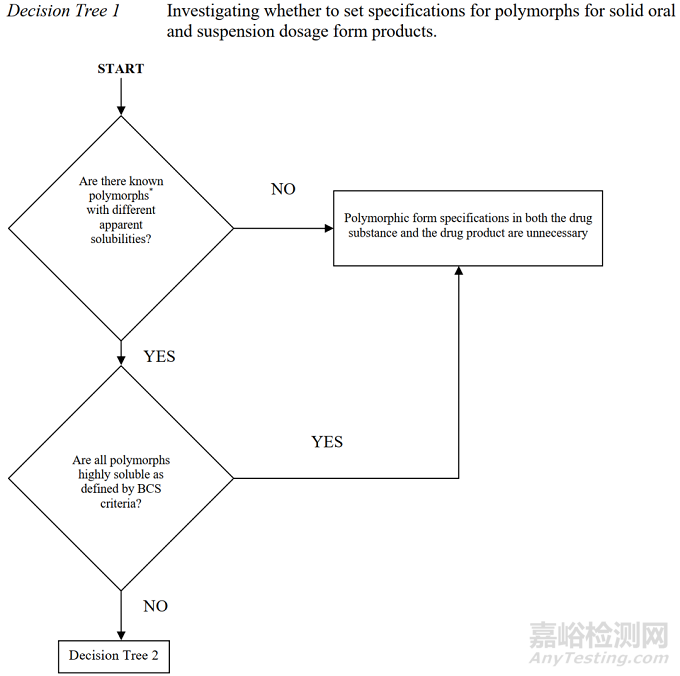
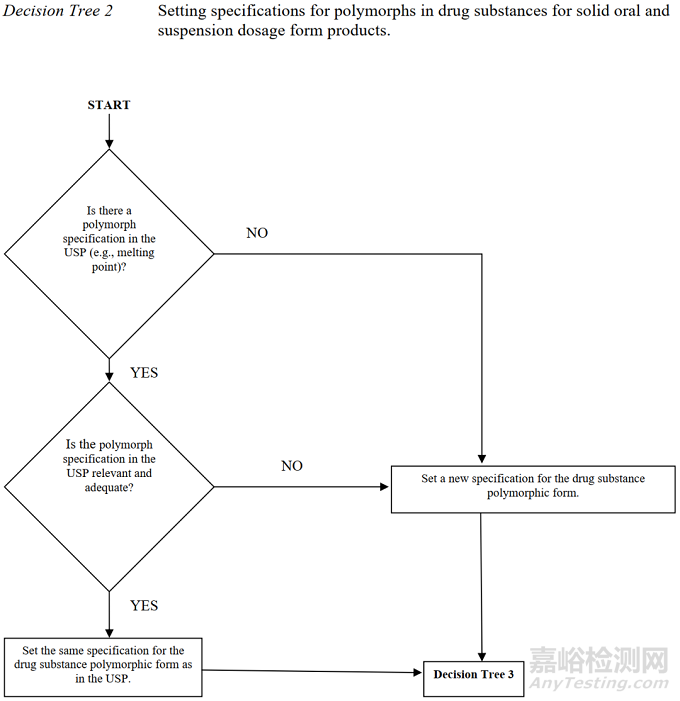
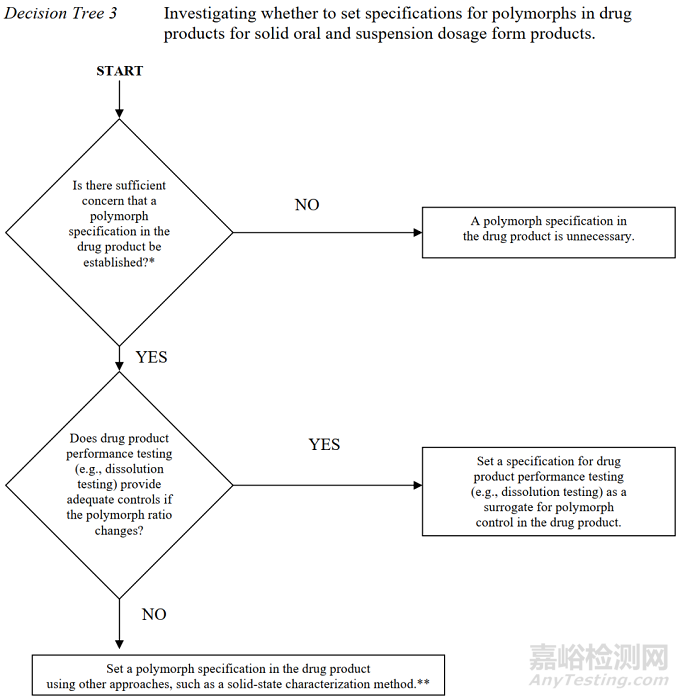
*摘录自《ANDAs: Pharmaceutical Solid Polymorphism》
3图3晶型控制决策树(ICH)
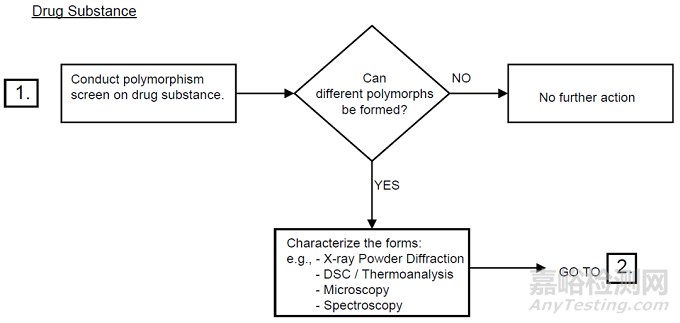
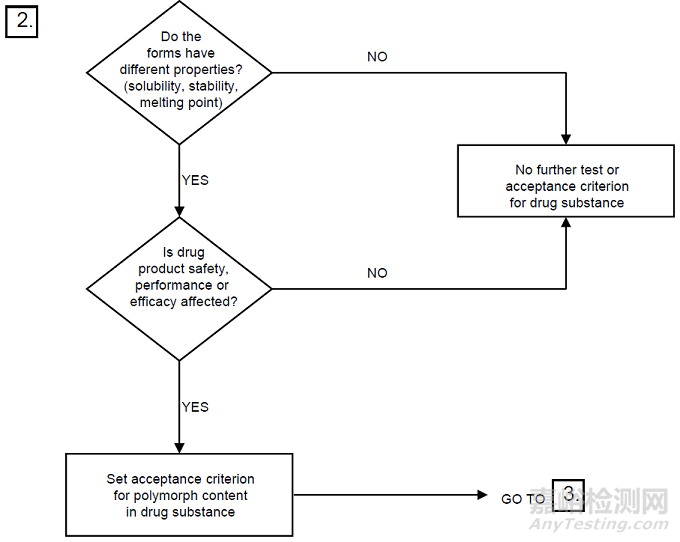
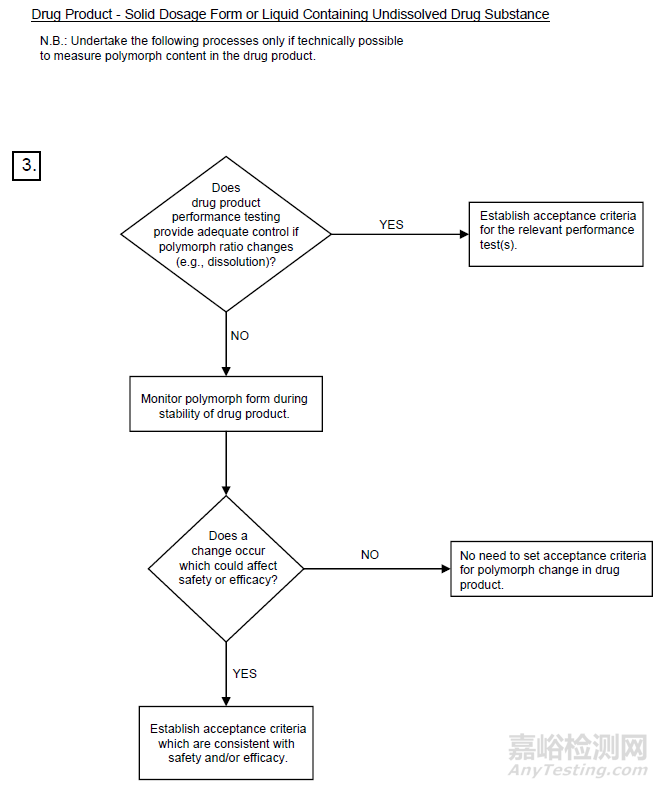
*摘录自《Specifications: Test Procedures And Acceptance Criteria For New Drug Substances And New Drug Products: Chemical Substances Q6A》
将上图1-3对比后不难发现,中国和美国的晶型控制决策树几乎是完全一致的,主要表现为以下几个方面。
1适用的药品注册分类一致:均适用于化学仿制药。
2适用的药品剂型一致:均适用于口服固体制剂或混悬剂。
3晶型质量控制的出发点一致:均是从晶型对生物等效性/生物利用度/溶解度的影响出发,逐步构建原料药和制剂的晶型控制策略。
然而,中美的晶型控制决策树与ICH却有一定的差别,主要异同点如下:
1适用的药品注册分类不一致:中美的晶型控制决策树适用于化学仿制药,而ICH的决策树适用于创新药。
2适用的药品剂型一致:均适用于口服固体制剂或混悬剂。
3晶型质量控制的出发点基本一致:中美的晶型控制决策树以仿制药的生物等效性为主要出发点,ICH的晶型控制决策树以创新药的安全有效及性能为主要出发点。
整体来看:
无论是创新药还是仿制药,中国、美国以及ICH晶型控制决策树的总体框架与核心思想基本都是一致的,均是以保证制剂产品安全有效和质量可控为制定晶型控制策略的总体出发点。然而,除了满足药品质量控制的要求以外,笔者还建议,对于开发非原研晶型的仿制药申请人来说,即使非原研晶型与专利晶型的质量性能差异甚微,但是出于对专利侵权风险的考虑也需要制定适当的晶型检查项。
三、关于共晶
共晶作为一种特殊的固体形态也有其特殊的应用价值。首先,它极大地拓宽了固态化学研究的边界,提高了难溶且无成盐位点新分子实体的成药可行性;其次,它给改良型创新带来了更多的可能性,通过共晶配体的科学设计,可实现化合物多种理化性质的调控,可用于提高生物利用度,也可用于改善药物稳定性,甚至达成溶解度和稳定性等多种优势兼备的目的;最后,在保证生物等效的前提下,共晶也为仿制药打开了突破专利晶型的空间,既有利于固态化学领域的技术进步,也有利于形成制药行业仿创并举的良性竞争格局。基于此,美国和欧洲均发布了相应的共晶指导原则,下面笔者对其进行简单的对比分析。
1 FDA:《Regulatory Classification of Pharmaceutical Co-crystals Guidance for Industry》
1共晶药品的注册分类

FDA对共晶药品的注册分类持开放态度,共晶可应用于创新药或者仿制药,但是均需要提供与监管分类相匹配的数据。
2开发共晶需要提供的数据


无论是仿制药还是创新药,若声明为共晶药物,需提供三个证据:
1共晶配体进入晶格
2API与配体的结合非离子键作用力,可通过pKa或其他光谱学的方法确证
3
共晶中的API在到达药理活性部位前从共晶中充分解离
3共晶与盐、溶剂合物、多晶型的区别


首先,共晶与盐不同,因为共晶的结合形式是非离子键作用力;其次,共晶也与溶剂合物和多晶型不完全相同,因为共晶配体一般是非挥发性的;最后,共晶不是一种新的API,可将共晶当做API的一种特殊的多晶型,类似于溶剂合物(因为结合形式都是弱键)。
2 EMA:《Reflection paper on the use of cocrystals of active substances in medicinal products》
1共晶药品的注册分类



欧洲药监局并未明确提出共晶药品是作为创新药还是仿制药进行监管,而是从共晶对药物的安全性和有效性是否产生影响来判断其是否为新的活性物质,进而确定其注册分类的归属。如果共晶对药物的安全性和有效性影响甚微,则可将其按照仿制药进行监管。
2共晶与盐、溶剂合物、多晶型的区别



欧洲药监局认为,共晶与盐虽然结合形式不一样,但在有些情况下也不能完全区分开(如两性化合物和多组分盐的共晶),而应该关注固体形态是否能满足特定的用途;共晶与溶剂合物也不必完全按照配体的挥发性进行明确的区分,而只是将溶剂合物这一普遍概念保留,但是应将其视为共晶的一部分(或者亚群);无论是盐、共晶、水合物、溶剂合物,均有可能存在多晶型现象。
3共晶配体的适用性

共晶与盐不同,可用于成盐的反离子种类相对较少,而可用于形成共晶的配体却非常多,如常用的辅料和食品添加剂(琥珀酸、糖精、咖啡因)。因此,共晶配体的安全性和质量必须是药学上可接受的,如果之前未在制剂产品中使用过则应通过适当的方式进行证明。
对比美国与欧洲的共晶指导原则可发现,其对共晶的定义基本趋同,但是对于其监管分类却有一定的区别。
四、结语
笔者以为,国内外的晶型研究相关指导原则,其核心思想是大同小异的,均是以实现药品的安全有效和质量可控为总目标。而对于企业来说,晶型质量研究到底怎么做,做到什么程度,主要取决于晶型对生物利用度的影响程度,同时应适当关注晶型稳定性及其在制剂工艺过程中的变化规律,按照决策树的流程,该总结的总结,该研究的研究,该控制的控制,不缺项留白,也不求全责备,相信都能交出一份满意的答卷。
参考文献:
1、中国药典,《9015 药品晶型研究及晶型质量控制指导原则》
2、CDE,《化学仿制药晶型研究技术指导原则(试行)》
3、ICH,《Specifications: Test Procedures And Acceptance Criteria For New Drug Substances And New Drug Products: Chemical Substances Q6A》
4、WHO,《Polymorphism Draft chapter for The International Pharmacopoeia》
5、EP,《Polymorphism》
6、EMA,《Reflection paper on the use of cocrystals of active substances in medicinal products》
7、FDA,《ANDAs: Pharmaceutical Solid Polymorphism》
8、FDA,《Regulatory Classification of Pharmaceutical Co-crystals Guidance for Industry》

来源:Internet


