您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-06-03 00:43
参比制剂(RLD)有时也可以称为商品名产品、处方药产品和创新产品,是指用于经国家药品监管部门评估确认的仿制药研制使用的对照药品。作为仿制药研发过程中的关键因素之一,同时也是开展仿制药一致性评价工作的重要先决条件,一般采用境内外首个获批上市且具有完整和充分安全性、有效性数据的原研药品或在美国、日本或欧盟等批准上市并获得参比制剂地位的国际公认同种药品。
本研究通过对截至2021年9月16日,国家药品审评中心(CDE)公示的未通过审议品种目录和已公示参比制剂调出品种目录进行详细梳理,归纳总结未通过审议及调出原因,进一步厘清参比制剂的遴选思路,并提出切实可行的建议,为今后参比制剂的遴选提供借鉴。
截至2021年9月16日,国家药品监督管理局(NMPA)已发布44批化学仿制药参比制剂目录,CDE已累计公示27批化学仿制药参比制剂目录(征求意见稿),其中包含23批未通过审议品种目录(征求意见稿),涉及207个品种(321个品规),其中23个品种(31个品规)提出了异议申请,经一致性评价办公室评估后,全部维持一次审议意见,二次审议未通过。各批次目录中未通过审议的品规数量详见图1。
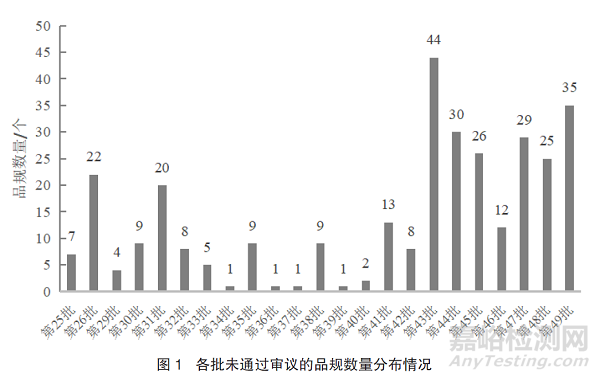
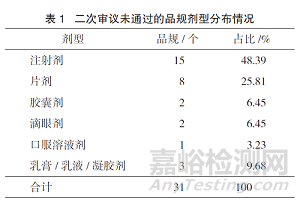
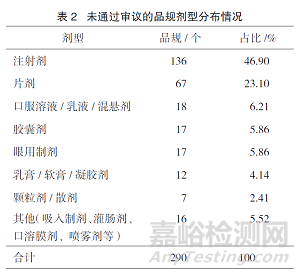
在二次审议未通过的31个品规中,注射剂占比最大,为48.39%,其次是片剂,占比25.81%,详见表1。除去二次审议不通过的31个品规,在未通过审议的290个品规中,注射剂占比达46.90%,片剂占比23.10%。详见表2。
对上述290个品规未通过审议的主要原因进行整理,具体原因包括拟申请参比制剂具有处方、工艺、质量控制等方面问题。详见表3。


在临床价值方面,临床中关注静脉输注速度的情况一般出于三种考虑,一是要提高药物的有效性,使药物在有效血药浓度水平维持更长时间。如美罗培南作为时间依赖性抗菌药物,《抗菌药物药代动力学/药效学理论临床应用专家共识》(2018版)指出,减慢美罗培南的滴注速度,可以使其血药浓度更长时间维持在最低抑菌浓度(MIC)之上,从而对已经对其产生耐药的微生物继续有效;二是降低药物毒性。如更昔洛韦氯化钠注射液,减慢其滴注速度,可以降低其肾毒性;三是缩短起效时间。如加快甘露醇注射液的滴注速度,可以快速降低危重症脑出血患者的颅内压,改善预后。因此,申请人在遇到类似问题时,应持审慎的态度,在药物开发项目立项前积极跟临床专家沟通药品用法用量和临床实际用药后患者的生化指标及生命体征,及时发现潜在风险因素。
在对25号公告的遴选原则方面,如拟申请的参比制剂不具有参比制剂地位;原研地位不明;拟申请参比制剂未首选欧盟、美国以及日本批准上市的原研药品等。只要申请人能认真理解25号公告及有关要求,一般可避免类似问题再次发生。
在制剂技术方面,企业在选择参比制剂时,要关注产品处方的对比分析和产品的历史沿革,并不是在国外具有参比制剂地位,国内就一定会认可。当出现上述情况时,应仔细分析产品处方组成、储存条件、有效期等因素,选择各个因素最为合理的参比制剂,同时严格按照25号公告要求遴选参比制剂。
任何影响药品安全性、有效性和质量可控性的因素,都可能影响参比制剂的遴选。申请人在遴选参比制剂时还需关注以下因素:一是项目立题合理性;二是拟选参比制剂的市场可及性和处方工艺合理性;三是临床用药习惯;四是国内已上市品种和拟选参比制剂用法用量、规格等的匹配性;五是同适应症竞品可及性和疗效优劣;六是充分利用数据库资源;七是持续关注拟选参比制剂在上市国的GMP检查情况等。结合这些因素综合判断分析拟选参比制剂的合理性,必要时,在研发项目立项前应及时与有关监管部门沟通,以降低研发风险。

来源:《中国药事》


