您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-10 22:49
摘 要 / Abstract
在药品和医疗器械评价中,利用真实世界数据开展研究得到各国政府监管决策机构的重视,各国相继出台政策法规支持采用这类研究证据来评估产品的安全性和有效性。真实世界数据多源异构,开展高质量的真实世界数据研究需要多学科共同参与。在真实世界药品和医疗器械疗效比较研究中,当内对照难以获得时,设置合适的外对照有助于结果的合理解读和促进证据转化。
In the evaluation of drugs and medical devices,regulatory departments in various countries pay increasing attention to studies using real-world data,and have successively developed policies and regulations for applying real-world evidence to the safety and effectiveness evaluation of medical products.Real-world data are multi-source and heterogeneous,and conducting high-quality studies using these data involves multiple disciplines.In real-world drug and medical device comparative effectiveness research,when internal controls are not available,using an appropriate external control will be helpful for result and evidence transformation.
关 键 词 / Key words
真实世界数据;外对照;药品/ 医疗器械评价;疗效比较研究
real-world data; external control; drug and medical device evaluation; comparative effectiveness research
01 引 言
真实世界证据(real-world evidence,RWE)可以作为随机对照临床试验(randomized controlled trial,RCT)证据的补充,已逐渐受到公共卫生管理部门、医疗机构、科研院所、药品生产销售企业和患者等各方的共同关注[1],并催生出系列政策法规[2]。真实世界数据(real-world data,RWD)既可以来自临床实践,也可以来自家庭及社区等常规收集的数据[3-5]。随着信息技术的发展,基于RWD研究的成本降低,研究可行性增大[4]。
在基于RWD的研究中合理设置对照是控制偏倚的关键,当研究内对照(internal control,IC)缺失或者不充分时,可以在研究之外寻找补充替代的对比组,称为外对照(external control,EC)[5],又称为外对比(external comparator)或合成对照(synthetic control)[6]。本文将概述EC相关法规和指南主旨、数据基础及EC的设置原则,进而对基于RWD的研究及EC应用进行案例解析,以期为药品和医疗器械研发和评估中RWE的结果解读及质量评价提供参考依据。
02 指南对外对照设置的要求
世界各国在进行卫生决策时所使用的证据逐渐多元化,基于RWD的研究在美国、中国和欧洲等国家和地区已受到政府监管机构的重视,相继出台了法规或指南[5,7-9](表1),旨在鼓励和指导RWD的应用与评估,从而规范开展基于RWD的研究,产生高质量的RWE来补充RCT研究证据,提高药品、医疗器械研发和审批效率,满足市场对突破性应用或新疗法的需求,以及加快上市后有效性和安全性评估[10]。

针对EC设置的法规最初由美国政府制定,随后其他国家也出台了相应的政策。主要包括:①《美国联邦法规》第21篇314章126节(21 CFR 314.126)[21],规定美国食品药品监督管理局(Food and Drug Administration,FDA)在新药上市审批中必须依据高质量临床研究证据,分析方法描述应充分,并设置良好的对照;②国际人用药品注册技术协调会(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)E10[22],为临床试验对照组的选择提供指南。在此基础上,FDA于2010~2020年起草制定了EC设置指南[23],指导医疗产品生产企业在特殊情况下(如:罕见病、重症等)充分利用EC评估产品的干预效果。
03 外对照数据来源、形式与特点
RWD和EC可以有共同的来源,如病历登记、医保数据、电子病历等[24]。除此之外,RWD的来源还包括社交媒体及患者驱动研究网络(patient-powered research networks,PPRN),如针对多发性硬化症的“加速痊愈计划”(Accelerated Cure Project),与研究人员共享3000多例患者病历信息及生物样本[25]。EC还可以来自临床试验原始数据或基于文献的二次数据,形式上可以是整合后的标准参照对比(benchmark comparators),也可以是个体数据水平对比(individual-level comparators)[23,26]。按时间轴上与试验组的重合关系可以分为三种外对照:历史外对照(historical EC)、同期外对照(contemporaneous EC)及混合外对照(hybrid EC)[5]。各种数据来源都有其优缺点(表2)。
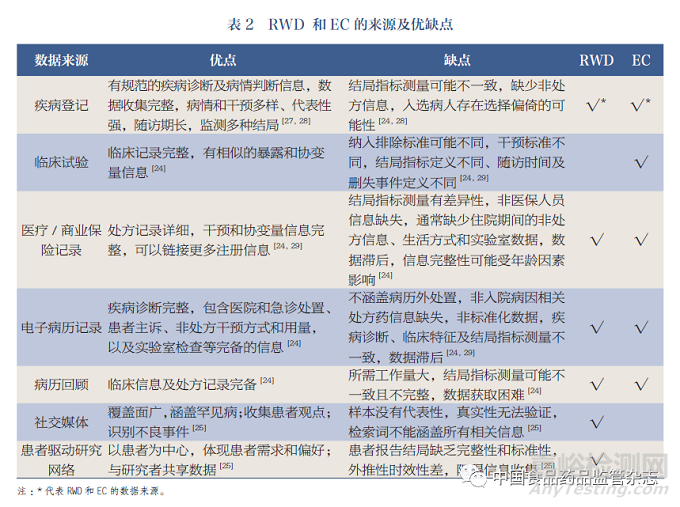
RWD和EC数据来源广泛,并且数据类型和结构差异性大,在利用RWD开展研究时,需要在医学伦理和信息安全的法律框架下,以信息技术为支撑,根据医学问题制定研究设计和统计分析计划,并对统计结果给予合理的解释,因此跨学科合作至关重要。
04 外对照设置案例分析
4.1 设置外对照的条件
药品和医疗器械评估需要临床试验提供详实可靠的证据支持。试验设计中通常需要设置对照控制干预之外的影响因素,如疾病自然病程、安慰剂效应及选择偏倚等。IC与干预组来自同一目标总体,且在相同的干预时间里接受了对照处理,如安慰剂对照、阳性干预对照、剂量对比和空白对照[23]。临床研究设计中应优先考虑设置IC,但在一些特殊的临床研究场景中,设置IC不可行或者IC不充分时,可以选择EC。这类特殊情况包括:①设置安慰剂对照不可行或不符合伦理要求;②缺乏可用的阳性干预方式作对照;③疾病预后明确;④处理效应显著且客观,与干预措施间存在非常强的时间关联,且不受试验各方主观意志影响;⑤EC与干预组间临床特征相近,变异小,专业上可认为来自同一总体;⑥其他影响干预效果的因素已知[23]。
4.2 设置外对照的研究案例
鉴于设置EC知晓度低且较难实现,目前EC应用和报告还比较少见,常见于单臂研究和病例系列研究,且这类研究常需要效应量有非常显著的临床意义,而干预效果评价往往需要具备较丰富的专业知识。如实体瘤评价标准[30]中的总缓解率(overall response rate,ORR)和缓解持续时间(duration of response,DOR),对于缺少专业背景知识的患者及其家属而言不易理解,阻碍干预药物的推广与应用。在这种情况下,EC的设置可使试验结果更容易理解。下面通过案例,说明EC在药品和医疗器械评估中提高证据可靠性方面的价值。
2019年6月1日,FDA批准Zolgensma(一种基因替代疗法)用于治疗婴儿型脊髓性肌萎缩症(SMA)。SMA是一种由基因突变引起的罕见病,预后差,未经治疗的患儿在24个月大时要么死亡,要么需要永久性机械通气。基于以23例历史病例数据为EC的Ⅲ期单臂试验,FDA评估了Zolgensma治疗SMA的有效性。一阶段试验2019年3月截止,主要疗效指标为30秒以上不通气存活比例,试验组与对照组分别为90%和25%,即试验组90%可以不需要机械通气存活,而历史外对照只有25%可以免于机械通气,治疗效果显著;二阶段试验中19例患儿继续接受治疗7.9~15.4月,结果67%的患儿生存达到14个月月龄,较历史对照组提高42%,并且47%的患儿可以脱离机械通气,达到无支撑坐姿,提高了患儿的生存质量,而这个评价指标在历史对照组中为0[32](表3)。

该案例为单臂试验设置了历史EC,是平行随机对照试验的补充替代,使得试验结果更加容易解读[26]。当干预效应量不具备显著的临床意义,但是达到中等强度实际意义时,EC提高了证据和决策的可靠性,从而有利于研究成果转化,服务社会。
4.3 设置外对照药物审批部分成果
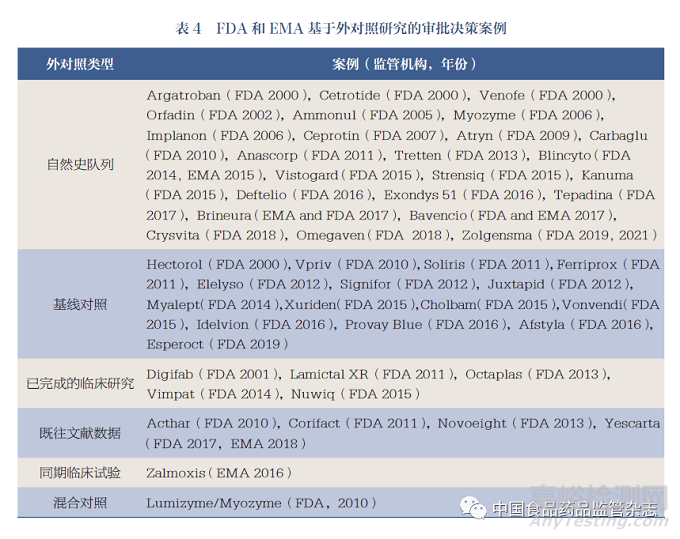
随着RWD方法学持续更新,RWE在医疗产品的评价和监管决策中得到前所未有的应用,其价值逐渐得到认可,其中外对照的使用也得到了重视。表4列出了过去20年间美国FDA和欧洲药品管理局(European Medicines Agency,EMA)基于设置EC的相关研究批准的药品情况[23,33],共计50种药品,外对照类型有自然史队列(24个)、基线对照(15个)、已完成的临床研究(5个)、既往文献数据(4个)、同期临床试验(1个)和混合对照(1个)。
05 小结和展望
当前,利用RWD设置EC产生RWE的应用场景主要集中在罕见病和恶性肿瘤等领域。通过设置EC产生RWE辅助临床研究,能够将受试者招募数量减少约50%,研究费用和耗时均有中等以上程度的降低。未来,设置EC的临床研究可以进一步拓展到其他研究领域,提升其实用价值,加速研发进程,使病患尽早得到有效治疗[34]。
高质量的流行病学研究需要严格控制偏倚,在基于RWD的研究中设立EC是提高研究质量的方法之一,可以增强研究结果的解释性,便于科研机构、生产企业及监管机构以此为依据评估药品及医疗器械临床应用的有效性和安全性,加快产品研发速度,并加强上市后长期评价和监测,为人群健康服务提供科学保障。真实世界证据正在改变整个医药健康行业,优化并丰富临床干预方式,改进临床研究设计。因此,应加强设置EC的真实世界研究的方法学及临床实证研究,从而提供充分的证据支持我国药品和医疗器械研发和监管决策。

来源:中国食品药品监管杂志


