您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-11 21:57
在产品管理中,生命周期概念越来越受到重视,它关注的是产品从投资到运营,最后到退休的整个过程的总成本,图1。对于分析方法,近年来制药人士对这一概念的兴趣越来越大。一般而言,分析方法的生命周期包括设计、开发、验证(包括仪器验证、连续方法性能验证和方法转移)以及方法的最终失效。ICH和美国药典在相关的章节中对分析方法生命周期进行了讨,美国药典验证专家小组已经提出了一个新的通则“<1220>分析方法生命周期”,发表在美国药典论坛PF43(1)。
1975年科学文献首次提到了生命周期管理的概念。随后几年人们对这一概念越来越感兴趣,导致越来越多的科学出版物提到生命周期管理。如图2所示,在科学网上搜索出940篇文章。在制药领域化学分析方法,使用“生命周期管理”和“制药”这两个术语进行的搜索产生了58篇文章,第一篇文章发表于2003。将“生命周期管理”的数据库搜索细化到科学类“化学分析”的网络中,数据库中识别出14篇文章。
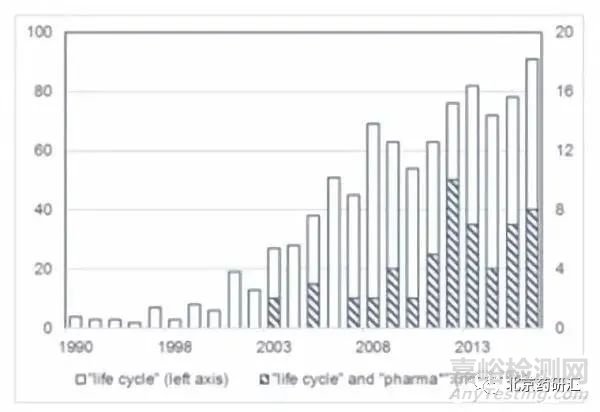
图2. 根据《科学网》1990-2016年引文数量,用于搜索“生命周期”(白条)或“生命周期”和“制药*”(阴影条)
分析方法生命周期包括基于质量设计的方法开发、验证和操作使用,如图3。FDA的工业设计指南和ICH的Q8、Q9、Q10、Q11和Q12将生命周期模型应用于分析方法,从科学和质量风险管理应用中获得知识,用于持续改进和保证方法产生数据的质量,这其中包括了将分析方法生命周期管理应用到GMP生产相关的分析方法开发、改进、验证、转移和维护活动。
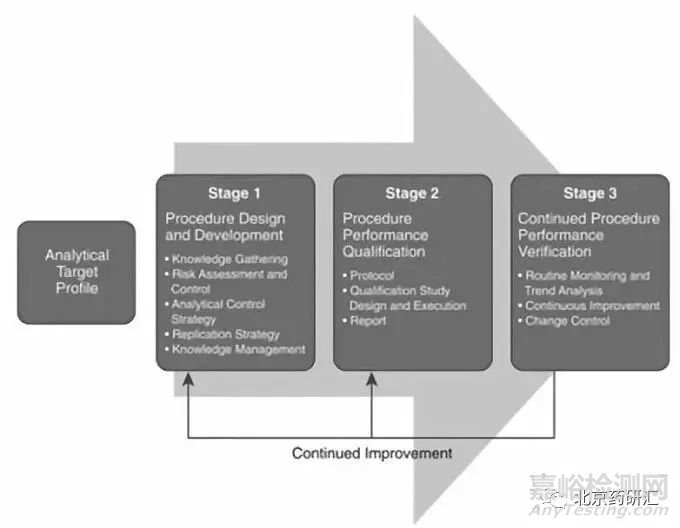
图3. 分析方法生命周期管理
2016年至2017年两年期间,美国药典的验证专家在PF上发表了四篇与分析方法生命周期相关的重要文章:
“分析程序的生命周期管理:方法开发、程序性能鉴定和程序性能验证”
“适用性:决策规则和目标测量不确定度”
“分析控制策略”
“分析目标概要:整个分析生命周期的结构和应用”。
这四篇文章中基本概括了关于分析方法生命周期中的一些重要概念,本文结合目前美国药典论坛、专业杂志发表的关于生命周期的文章,以及笔者亲身经历,细说关于分析方法的生命周期管理。
1. 分析目标概况(Analytical Target Profile, ATP)
分析方法生命周期可以使用一个三阶段的概念,与目前工艺验证技术保持一致:
第1阶段:方法设计和开发(知识收集、风险评估和控制、分析控制策略、知识管理、确认准备)
第2阶段:分析方法性能确认
第3阶段:持续方法性能确认(日常监测、分析方法变更)
分析方法生命周期的一个基本组成部分是要有一个预先确定的目标,该目标规定了分析方法的性能要求。ATP被视为分析方法生命周期的参考点,它是分析方法要求的预定义记录。它应该在方法开发之前建立,并与方法的目的相联系。
ATP的标准应基于分析方法的预期用途。客户要求或监管规范和指南可作为ATP的基础。如果没有预设外部要求,实验室应选择适当的方进行定义。对于定量方法,ATP通常基于目标测量不确定度(Target Measurement Uncertainty, TMU),即报告结果中的最大可接受不确定度。
因此,评估方法合规性的关键是“决策规则”。考虑到做出错误决定的概率的可接受水平,这些规则根据测量的数量值、其不确定度和规格限值决定是否接受或拒绝一个产品。
根据方法的预期用途,方法的要求包括性能标准精度、选择性、灵敏度、线性和耐用性,但也包括样品周转时间、通过能力、分析总成本和易操作性。一旦定义了ATP,就需要根据分析人员的知识选择最有可能提供符合ATP的分析数据的分析技术。随后,可通过方法设计和风险评估继续分析方法的生命周期。
2. 方法设计
分析方法生命周期管理与方法的设计有关。对于成功的方法开发,了解方法的基本原理是很重要的。需要对分析方法的关键变量以及它们如何影响分析方法有充分的了解。此外,重要的是要在开发阶段考虑收集所有信息,包括样品制备和标准溶液制备,以确保最终方法适用性和耐用性。因此,方法设计不仅要考虑ATP,还要考虑分析实验室的能力和人员教育状况。
3. 方法开发
方法开发的策略受到方法设计决策过程中选择的分析类型的影响。样品制备方法的开发和分析方法同等重要,适用于复杂样品的样品制备方法通常对整个方法的结果至关重要。当样品制备方法不理想时,可能会影响到方法的回收率、耐用性、方法转移,甚至缩短分析仪器寿命。
大多数分析技术需要分析物的均匀溶液,因此固体样品的溶解是必要的。只有少数技术,如拉曼或近红外(NIR)光谱,允许直接分析固体样。样品制备的进一步的操作可用于减少基质成分,并提高整个方法的选择性。生物分析样品通常需要对分析物进行进一步的预浓缩,有时也需要在分析前对结合物进行分解。
使用仪器直接用于方法开发。高效液相色谱系统可以是模块化的,也可以是集成的,并且可以利用等度或梯度溶剂输送。由于流动相和柱筛选是方法开发中的一个关键步骤,为进一步优化方法条件,仪器系统包括梯度溶剂输送管理器、溶剂切换阀、带多柱选择阀的柱烘箱、自动样品管理器,检测器包括光电二极管阵列和质谱。不同的检测器有助于识别分析物,并根据ATP评估最佳选择。
传统方法开发。方法开发取决于样品复杂性、分析员的经验和直觉、色谱柱和溶剂等材料的可用性以及分离的目标。以前,选择最终分离的条件通常是跟踪方法误差。这种方法耗时,传统的方法开发策略在方法失败的风险较高,并且在方法转移或替代方法后,需要广泛的再验证,它导致方法成本的增加。
系统方法开发。与传统方法相比,一种更系统的方法是使用统计方法和软件辅助作为快速有效的测试工具。在过去的几年里,对系统方法开发策略进行了大量的研究,FDA的“21世纪药品当前良好生产规范(CGMPS)——基于风险的方法”倡议也推荐了一种系统方法。
QbD概念可以扩展到分析方法开发,包括方法目标的定义、风险评估、设计空间的规范、实施控制策略和持续改进,以提高方法的耐用性。质量风险管理(QRM)过程在ICH Q9指南中有详细描述,包括风险评估、风险控制和风险评审(图4)。在开发分析方法的各个阶段,可以使用“鱼骨”图或失效模式影响分析(FMEA)和优先级矩阵(PM)进行风险评估,以评估对方法性能影响最大的因素。
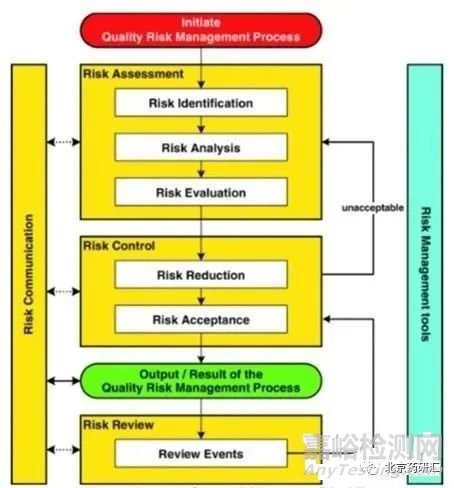
图4. QRM过程概要
基于化学计量学的方法开发。在全因子或部分因子设计中,进行一组实验(DOE)。利用统计工具(例如全因子设计或部分因子设计、普莱克特-伯曼设计),可以计算出各因子对分离的影响,并利用数据找出一种方法的最佳条件。
建模软件辅助方法开发。作为辅助方法开发的替代方案,软件辅助可用于预测选定条件下的色谱图。专门为RP-HPLC方法开发而设计的商用解决方案的示例有Drylab、Fusion L、Chromsword、ACD/Autochrom。基于少量实验,这些软件应用程序可以预测在改变流动相组成、pH、温度、流速或柱尺寸和粒径时,预测反相液相色谱分离中峰的移动情况。
基于分析物预测的方法开发。高效液相色谱法开发的另一个策略是基于样品组分的分子结构或物理化学性质(如logp、logd和pka),以估计其保留率,从而确定最佳分离条件。
4. 方法验证
生命周期的第二阶段,需要对分析方法进行性能的验证。
方法性能验证的目的是确认该方法将按预期运行,并满足先前定义的ATP标准。方法验证中通常考虑的参数包括选择性、线性、准确度、精度、检测限(LOD)、定量下限和上限(LLOQ和ULOQ)、稳定性、回收率、耐用性、矩阵效应。它们的相关性很大程度上取决于ATP。
5. 方法转移
在大多数产品生命周期的某个阶段,从开发、扩大、制造、生产和投产到批准后阶段,都会将工艺转移到另一个地点。对于分析方法的转移,也有类似的程序。目前的方法转移包括比较测试、方法联合验证、方法验证或再验证或转移豁免作为替代策略。方法转移过程中,应当进行严谨的风险评估,来确定需要进行对比的参数。
6. 连续方法性能验证
方法开发和验证完成后,根据方法生命周期可用的风险评估和数据建立方法控制策略,然后将该方法用于常规用途,其中建立对方法性能随时间变化的连续监测,并可在需要时进行改进。技术进步与监管要求的变化都有可能导致分析方法的变更。
作为分析方法生命周期的一个重要方面,性能验证用于检查方法在日常使用中的运行方式,以及结果数据是否适合其预期用途。USP<1010>“分析数据-解释和处理”,提到了对分析性能数据进行常规监测的连续程序,可通过跟踪实际样品或标准结果、系统适用性数据趋势分析、稳定性研究的精度评估或参考批次的分析来实现。
7. 适用性概念
在分析方法的整个生命周期中,满足预先定义的ATP和持续评估非常重要。为了评估方法性能和验证过程中获得的分析方法数据的适用性,需要根据预设的ATP进行判断。
仪器和系统的性能也会对分析生命周期产生积极或消极的影响。如果分析系统安装不正确,环境不适合仪器或仪器操作不正确,分析数据无效。因此,应将系统适用性试验视为分析程序的组成部分。
根据USP<1058>的规定,分析仪器的合格可被视为数据可靠性的基础。针对QBD原则,通常使用基于“4Q模型”的验证过程来证明分析仪器适用于目的。4Q模型包括四个阶段:DQ是对仪器的要求与仪器制造商的规范进行比较。订购和交付系统后,安装确认(IQ)阶段从交付组件的文档、所有模块的安装以及为用户提供的培训开始。在运行确认(OQ)期间,仪器在标准化条件下进行测试,从而根据其规范确认仪器的正确运行。随后,性能验证(PQ)根据良好的科学实践论述了仪器在实际使用条件下的适用性。
每次新仪器进入实验室时,都要进行完整的4Q认证过程。在仪器生命周期内的特定时间段后,需要对现有仪器进行再验证,通常与预防性维护程序相关联,以证明系统仍然适用。此外,当仪器的位置发生变化或进行重大修理或修改时,应重复相关的IQ、OQ和PQ测试。
8. 方法失效
作为方法生命周期的最后阶段,其终止也应遵循质量管理原则。一方面,需要考虑数据存储,特别是在规范环境中使用该方法时。然而,越来越多的研究机构否认原始数据存储也值得关注。为了能够在原始分析方法终止后的几年内重新评估数据,还需要考虑相关软件的存储。由于实验室范围的变化,一种方法可能被完全终止,或者一种新的方法可能基于结论,以满足新定义的ATP要求。如果一个新方法是基于失效的方法,则可以使用早期生命周期的某些部分来启动新方法。
9. 展望
在制药行业,实施ICH指南Q8-Q11旨在使目前的药品开发和制造方法现代化,以更科学和风险为基础。尽管ICH指南Q8没有明确提及分析方法的开发,但要求在药物开发中采用按质量进行设计方法。因此,QBD概念可以扩展到分析方法。
虽然ICH Q8、Q9、Q10和Q11为评估整个生命周期变化提供了更科学和基于风险的方法,但存在的一些差距,限制了预期效益的充分实现。因此,新提出的ICH准则Q12将提供指导,以便在整个产品生命周期内以更可预测和更有效的方式管理批准后的变更。

来源:Internet