您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-06-27 15:40
刚刚,国家药监局器审中心发布《PD-L1检测试剂临床试验—结果重现性研究注册审查指导原则》,全文如下:
PD-L1检测试剂临床试验—结果重现性研究注册审查指导原则
一、前言
近年来,以程序性细胞死亡蛋白1 (Programmed cell death protein 1, PD-1)/程序性死亡配体1 (Programmed death-ligand 1, PD-L1)免疫检查点抑制剂为主的免疫治疗在多个恶性肿瘤中取得了突破性进展,一系列抗肿瘤药物应用于临床。PD-L1检测试剂是目前应用最为广泛的免疫治疗适宜人群筛选和疗效预测的生物标志物。免疫组织化学(immunohistochemistry,IHC,简称“免疫组化”)检测是评估肿瘤组织PD-L1表达状态的一种有效且常用的方法,广泛应用于多种恶性肿瘤中,以识别或辅助预测可能从免疫治疗中获益的患者。
基于免疫组化法的PD-L1检测试剂操作程序和结果判读较为复杂,该类检测试剂临床应用的准确性与重复性是产品重要的临床性能,本指导原则旨在规范产品检测结果重现性临床研究的开展。
本指导原则是针对PD-L1检测试剂结果重现性临床研究的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。该文件为供申请人和审查人员使用的指导性文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料。本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准的不断完善和科学技术的不断发展,本文件相关内容也将适时进行调整。
二、适用范围
本指导原则适用于基于免疫组化法的PD-L1检测试剂,该类产品用于定性检测人中性福尔马林固定石蜡包埋(FFPE)的肿瘤组织中PD-L1蛋白的表达水平。
三、临床试验要求
PD-L1检测试剂结果重现性临床研究包括两部分内容:环比试验与阅片一致性研究。临床试验的开展、方案的制定以及报告的撰写等均应符合相关法规及《体外诊断试剂临床试验技术指导原则》的要求。
(一)临床试验设计
1.环比试验(Ring study)
环比试验是从病理切片开始,按照试剂说明书进行样本处理、染色及结果判读,评价各临床试验机构对同一样本集从染色到结果判断的一致性。
环比试验应选择至少三家临床试验机构开展,试验所需的病例为三家临床试验机构共同提供的样本组成的样本集。在样本集构建过程中,每家临床试验机构提供的阳性病例、阴性病例及总病例数应相对均衡。每个病例应至少提供足够三次按照申报产品说明书进行检测的病理切片数量。
临床试验牵头单位研究者将样本集中每一病例的病理切片分配至每家临床试验机构,保证每家临床试验机构均能够对该病例按照申报产品说明书进行至少一次染色并报告结果。因此,每家临床试验机构均能对样本集中所有病例的病理切片进行染色及结果判读。
各临床试验机构收到临床试验牵头单位分配的病理切片后,选择具有一定资历的研究者,按照申报产品说明书的要求对病理切片进行染色及结果判读。针对整个样本集的染色建议尽快完成。三家临床试验机构通过对样本集中病理切片进行染色及判读,最终各机构的数据形成环比试验的数据集,用于后续统计分析。环比试验设计见图1。
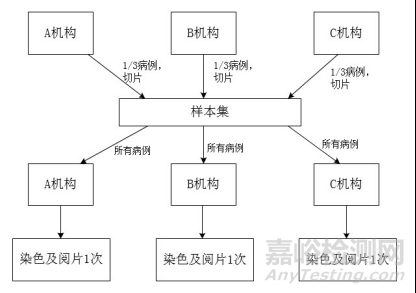
图1.环比试验设计示意图
2.阅片一致性研究
阅片一致性研究的对象为经申报产品按照产品说明书进行染色的病理切片,各临床试验机构研究者根据产品说明书中结果判读方法对切片进行判读,评价不同研究者对染色切片判读结果的一致性。
阅片一致性研究应选择至少三家临床试验机构,研究内容包括:机构内同一病理医师阅片一致性研究、机构内不同病理医师阅片一致性研究、不同机构间病理医师阅片一致性研究。各临床试验机构可根据临床试验内容,在科学设计的前提下将上述阅片一致性研究合并进行,但应在临床试验方案中明确各机构不同研究者参与的具体研究内容,临床试验应严格按照临床试验方案进行。
2.1机构内同一病理医师阅片一致性研究
机构内同一病理医师阅片一致性研究应在三家临床试验机构开展,每家临床试验机构针对本机构所提供的临床试验所需的已完成染色的病理切片进行本研究。用于临床试验的病理切片应包括判读结果为阳性的切片及判读结果为阴性的切片。
每家临床试验机构选择一名一定资历的病理医师对该机构入组的所有病理切片进行3次判读,每次判读间隔一定的时间,同一病理医师的不同次阅片结果组成分析数据集。机构内同一病理医师阅片一致性试验设计如图2。
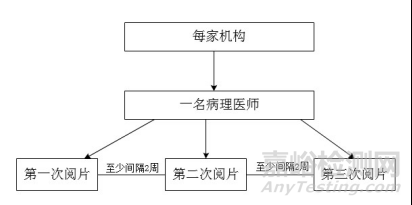
图2.机构内同一病理医师阅片一致性试验设计示意图
2.2机构内不同病理医师阅片一致性研究
机构内不同病理医师阅片一致性研究应在三家临床试验机构开展。每家临床试验机构针对本机构所提供的临床试验所需的已完成染色的病理切片进行本研究。用于临床试验的病理切片应包括判读结果为阳性的切片及判读结果为阴性的切片。
每家临床试验机构选择3名不同资历的病理医师参与临床试验,临床试验过程中由每名病理医师对该机构入组的所有病理切片进行判读,所有病理医师的阅片结果组成分析数据集。机构内不同病理医师阅片一致性试验设计如图3。
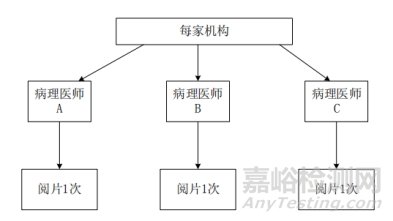
图3.机构内不同病理医师阅片一致性试验设计示意图
2.3不同机构间病理医师阅片一致性
不同机构间病理医师阅片一致性研究应在三家临床试验机构开展。临床试验所需病理切片为三家临床试验机构共同提供的切片组成的切片集,在切片集构建过程中,每家临床试验机构提供的阳性切片、阴性切片及总切片数应相对均衡。每张病理切片应为按照申报产品说明书进行染色的病理切片。
各临床试验机构根据临床试验进展开展切片集的阅片,建议每家临床试验机构完成全部阅片后,再将切片集转运至下一家机构。保证每家临床试验机构研究者均能对切片集中所有病例的病理切片根据产品说明书要求进行结果判读。
各临床试验机构收到切片集后,选择具有一定资历的研究者,按照申报产品说明书的要求对病理切片进行结果判读。三家临床试验机构对切片集中所有病理切片判读,最终各结构的数据形成阅片一致性研究的数据集,用于后续统计分析。不同机构间病理医师阅片一致性试验设计如图4。
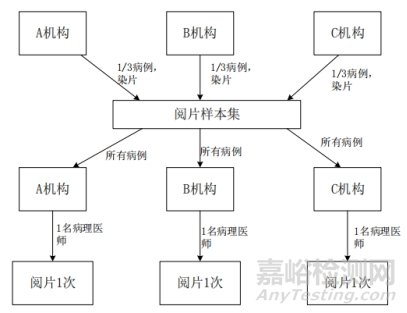
图4.不同机构间病理医师阅片一致性试验设计示意图
(二)受试者选择及样本收集
环比试验与阅片一致性研究入组的受试者应为产品预期适用人群,如待评价产品PD-L1检测试剂盒预期用途为定性检测中性福尔马林固定石蜡包埋(FFPE)的食管鳞状细胞癌(ESCC)组织中的PD-L1蛋白表达,则入组病例应为临床明确诊断为食管鳞状细胞癌的病例。
为了更加科学的评价产品性能,各部分研究均应包含部分PD-L1表达阳性阈值临近范围内病例(用于指导抗肿瘤药物使用的阈值),该部分病例所占比例应不少于阳性病例的30%。
(三)机构和人员
临床试验机构应获得国家药品监督管理局备案认可。临床试验机构应具有严格的质量管理体系,执行实验室内部日常质量控制。
临床试验中应根据试验设计设定不同资历的病理医师参与试验,病理医师资历划分应合理。
(四)样本量估算
临床试验应进行科学的样本量估算,建议采用参数估计的方法估算样本量,样本量估算过程建议设定合理置信水平和允许误差。可采用如下公式:
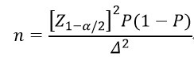
公式中n为样本量,Z1-α/2为置信度标准正态分布的分位数,P为评价指标预期值,Δ为P的允许误差大小。
如研究者采用其他的合理的样本量估算模型,在进行合理解释的前提下亦可采用。
1.环比试验
各机构检测结果的阳性符合率应不低于85%,阴性符合率应不低于85%,置信水平取0.05。研究者应设定合理的Δ值,据此估算环比试验所有成对比较结果中阳性病例数及阴性病例数。在保证合理的允许误差的前提下,临床试验中,环比试验样本集中样本例数不应低于60例,其中阳性不应低于30例,阴性病例不低于30。环比试验样本集构建过程中,提供的阳性样本及阴性样本应尽量均衡。
2.阅片一致性研究
2.1机构内同一病理医师阅片一致性研究、不同病理医师阅片一致性研究
该部分研究应以每个临床试验机构为单位,进行样本量估算。样本量估算过程中应选定合理的主要评价指标,如基于与参考结果的一致性评价或成对结果的一致性评价。各机构可以采用同一病理医师多次阅片汇总统计或不同病理医师汇总统计的阳性一致率(或平均阳性一致率)、阴性一致率(或平均阴性一致率)进行阳性及阴性病例的估算,最终入组的病例应为估算病例的1/3。样本量估算过程应相关参数的设定应科学、合理,该部分研究临床性能不应低于环比试验,置信水平取0.05。研究者应设定合理的Δ值,当预期值更高时还应考虑更优的精度。
2.2不同机构间阅片一致性研究
该部分研究应以三家机构提供的切片集进行样本量估算,样本量估算过程中主要评价指标的选择应为每家临床试验机构与参考方法或与其他机构对比的阳性一致率、阴性一致率。样本量估算过程中相关参数的设定应科学、合理,该部分研究临床性能不应低于环比试验,不应高于机构内同一病理医师阅片一致性研究、不同病理医师阅片一致性研究,置信水平取0.05。研究者应设定合理的Δ值,当预期值更高时还应考虑更优的精度。据此估算的样量应为本研究切片集样本量,切片集由三家临床试验机构提供,各机构提供的阴性及阳性切片的数量应相对均衡。
2.3在科学合理设计的前提下,机构内同一病理医师阅片一致性研究、不同病理医师阅片一致性研究及不同机构间阅片一致性研究三个研究中切片可重复使用。重复使用切片过程中应避免同一病理医师在短时间内对同一张切片多次判读。
(五)评价指标及统计分析
环比试验及阅片一致性研究统计方法为一致性评价,可采用四格表分析的方法。包括与参考结果的一致性评价及成对结果的一致性评价。参考结果一般为同一样本或同一个染色切片在不同阅片者判读过程中,出现频率最多的结果。与参考结果对比过程中主要评价考核试剂与参考结果的阳性一致率(PPA)、阴性一致率(NPA)、总一致率(OA)。成对结果的一致性评价主要评价研究者两两成对比较的结果,成对一致性评价指标为平均阳性一致率(APA)、平均阴性一致率(ANA)、平均总一致率(OA)。上述统计分析应采用合理的方法进行置信区间的估算。
1.环比试验
环比试验的统计分析主要为各临床试验机构间结果的两两成对比较,成对分析包括以下三组:机构1与机构2、机构2与机构3、机构3与机构1。以第一组机构1与机构2成对分析为例,以机构1的结果为准,以四格表形式统计机构2结果与机构1结果的一致率,包括阳性一致率及阴性一致率。根据上述方法分析机构2与机构3、机构3与机构1的一致率。最终将三组结果汇总,分析环比试验的平均阳性一致率、平均阴性一致率及平均总一致率。
2.阅片一致性研究
阅片一致性研究统计分析包括与参考结果的一致性评价及成对结果的一致性评价。
2.1 机构内同一病理医师阅片一致性研究
与参考结果的一致性评价,每张病理切片的参考结果为本机构同一位病理医师多次阅片结果中,出现频率最多的结果。病理医师单次阅片结果分别与该参考结果进行比对,评价阳性一致率、阴性一致率及总一致率,三次阅片结果汇总为该机构同一病理医师阅片一致性,三家机构结果汇总为所有机构同一病理医师阅片一致性研究。
同一病理医师成对结果的一致性评价,评价过程包括三组:第1次阅片与第2次阅片、第2次阅片与第3次阅片、第3次阅片与第1次阅片。以第一组第1次阅片与第2次阅片成对分析为例,以第1次阅片的结果为准,以四格表形式统计第2次阅片的结果与第1次阅片结果的一致率,包括阳性一致率及阴性一致率。根据上述方法分析第2次阅片与第3次阅片、第3次阅片与第1次阅片的一致率。最终将三组结果汇总,分析机构内同一医生阅片的平均阳性一致率、平均阴性一致率及平均总一致率。三家机构结果汇总为所有机构同一病理医师阅片一致性研究。
2.2机构内不同病理医师阅片一致性研究
与参考结果的一致性评价,每张病理切片的参考结果为本机构三位病理医师阅片结果中,出现频率最多的结果。具体分析方法可参考本节2.1机构内同一病理医师阅片一致性研究。
成对结果的一致性评价,评价过程包括三组:病理医师1与病理医师2、病理医师2与病理医师3、病理医师3与病理医师1。具体分析方法可参考本节2.1机构内同一病理医师阅片一致性研究。
2.3机构间病理医师阅片一致性研究
与参考结果的一致性评价,每张病理切片的参考结果为不同机构病理医师阅片结果中,出现频率最多的结果。具体分析方法可参考本节2.1机构内同一病理医师阅片一致性研究。
成对结果的一致性评价,评价过程包括三组:机构1阅片结果与机构2阅片结果、机构2阅片结果与机构3阅片结果、机构3阅片结果与机构1阅片结果。具体分析方法可参考本节2.1机构内同一病理医师阅片一致性研究。
(六)原始数据
1.提交病例数据汇总表,内容应至少包括:性别、年龄、病理诊断结果、研究者判读结果等。
2.提交入选样本染色代表性彩色图片,并对染色特点包括组织形态、染色强度和背景染色特点进行简要评述。
(七)偏倚控制
为了控制临床试验的偏倚,各部分研究过程中应针对病例/切片应进行设盲,使研究者在试验过程中不知晓受试者疾病诊断或其他相关检测等信息,从而避免引入偏倚。
在进行同一病理医师阅片一致性研究过程中,病理医师在进行下一次阅片时应保留一段时间的记忆清除期(脱敏期),此段时间一般不少于两周。
同一病理医师阅片一致性研究过程中,每次阅片时建议人为纳入一定数量的不同的干扰病例。干扰病例应同时具有阳性和阴性病例,将干扰病例混入分析组中,使研究者同时针对分析组中的病例及干扰病例进行操作,但干扰病例结果不纳入统计分析。
(八)质量控制
临床试验开始前,建议进行相关培训,以确保研究者熟悉并掌握相关试验方法的操作、仪器、技术性能等,最大限度控制试验误差。整个试验过程都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
临床试验中应制定严格的样本转运方案,确保样本转运过程不对临床试验产生影响,样本转运过程中应做好样本交接记录,各临床试验机构的样本应能够溯源。
临床试验应严格按照产品说明书进行操作,应根据相关要求进行必要的HE染色,应设置合理对照。
四、起草单位
国家药品监督管理局医疗器械技术审评中心。
五、参考文献
1.《体外诊断试剂临床试验技术指导原则》(国家药品监督管理局通告2021年第76号),2021年9月28日。
2.Xiao-Hua Zhou,Nancy A.Obuchowski,Donna K.McClish. 诊断医学中的统计学方法(第二版)[M].北京:高等教育出版社,2016。
3.李卫.医疗器械临床试验统计方法(第二版) [M].北京:科学出版社,2016。

来源:国家药监局


