您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-06-28 05:57
摘要:该文通过电子问卷和现场交流两种方法,调研了上海市 47 家无菌药品代表企业生产过程消毒现状,了解企业生产过程消毒现状及存在的风险问题,以期为生产企业合理规范使用消毒剂以及相关标准的制定完善提供支持。结果发现生产企业使用的消毒剂种类多达 16 种,其中乙醇使用比例最高(74%),其次是成品杀孢子剂(36%)、苯扎溴铵(34%)、季铵盐类(30%)等;47 家企业有 34 种消毒剂组合;21%的企业未进行消毒效果验证,仅有 38%的企业会采用生产环境分离菌株进行消毒效果验证;核心生产区域的消毒方式共有 12 种不同组合,其中擦拭-喷洒-熏蒸的组合方式占比最高(38%)。主要问题有:部分无菌药品企业存在消毒剂产品种类选择不全面,无法覆盖可能出现的微生物污染风险;消毒剂轮换措施不合理,未结合标准规范要求和实际操作定制科学方案;消毒剂验证方案无法充分体现消毒剂的有效和适用性。
药品尤其是注射液、注射用无菌粉末、眼用制剂等高风险无菌产品中的污染微生物,是影响药品质量安全的重要因素,往往会造成临床患者感染,甚至导致死亡等严重不良后果[1—3]。发生在我国的“欣弗事件”“刺五加事件”,以及 2018 年“院内凝胶剂感染事件”等,主要是由微生物原因引起的,对公众直接造成了致命的伤害[4—6]。此外,2015 年至 2017 年美国 FDA 公布的药品召回事件中,由微生物污染风险引起的召回事件占到近 50%[7]。
药品中的污染微生物可能来源于药品生产、运输、使用等多个环节[8—10],其中加强药品生产过程中微生物控制是防止问题药品流入市场的关键[11]。无菌药品在生产过程中会受到环境负载微生物的污染威胁,因此使用消毒剂对生产环境进行消毒灭菌是非常必要的。目前国内外《药品生产质量管理规范》(Good Manufacture Practice of Medical Products,简称 GMP)都明确规定制药企业在生产过程中要使用消毒剂。虽然我国 GMP 2010 年版附录 1 明确要求企业应按操作规程对洁净区域的清洁和消毒[12],但目前无论是 GMP 还是《中华人民共和国药典》(ChP),对制药企业消毒剂的选择、消毒效果的验证均无具体规定,导致药品生产企业在开展相关工作时无标准可循,无法完全有效保障药品的微生物质量安全。
本研究对上海市 47 家无菌药品企业消毒剂的使用现状进行了调研,主要目标是了解无菌药品企业消毒剂使用过程中存在的问题,为合理规范企业消毒剂的使用以及我国制药企业消毒剂相关标准的制定完善提供支持。
1、研究方法
1.1调研方法
调研对象为上海市无菌药品生产企业,目的是了解生产过程消毒剂使用现状与存在问题。调研方法包括电子问卷和企业现场交流两种形式,其中问卷要求企业质量负责人进行填写。调研问卷由上海市医药质量协会与 2020 年 11 月向 47 家无菌药品企业发放,共回收 47 份有效调查问卷。调研企业涉及无菌原料药、大容量注射液、小容量注射液、血液制品、生物制品、粉针剂以及植入剂等产品类型。在问卷调查基础上,选取 10 家代表性企业进行现场交流。
1.2调研对象
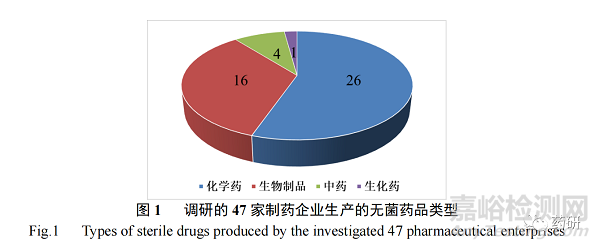
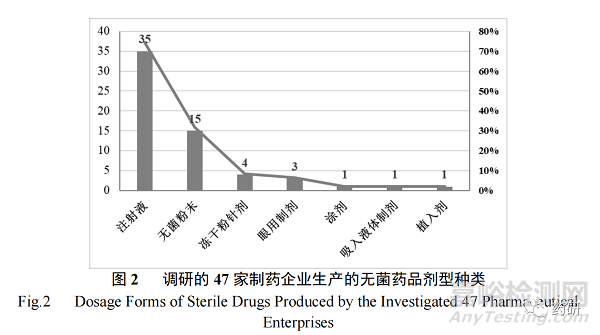
调研的 47 家企业生产的无菌药品类型包含化学药、生物制品、中药及生化药,其中以化学药(26 家)和生物制品(16 家)为主(图 1);无菌药品剂型则涵盖了注射液、无菌粉末、眼用制剂、冻干粉针剂、涂剂、吸入液体制剂和植入剂等,其中以注射液(35 家)和无菌粉末(15 家)剂型最多(图 2)。
1.3数据分析
使用 Excel 等统计分析软件进行数据处理和分析。
2、结果与分析
2.1无菌药品企业使用消毒剂种类及组合信息统计结果
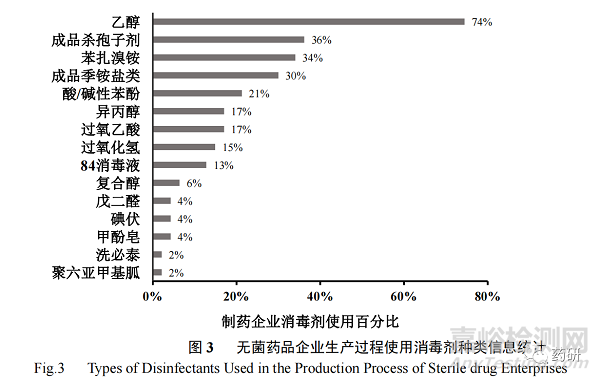
调研结果表明 47 家无菌药品生产企业使用的消毒剂种类多达 16 种(图 3),其中乙醇的使用比例最高(74%),其次是成品杀孢子剂(36%)、苯扎溴铵(34%)、成品季铵盐类(30%),而洗必泰、聚六亚甲基胍则分别仅有 1 家企业使用。
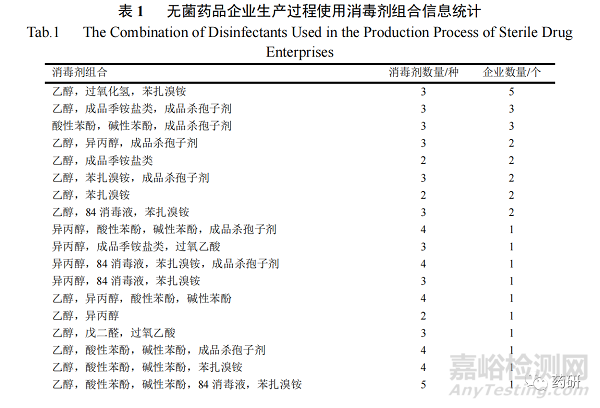
不同企业使用的消毒剂组合信息如表 1 所示。统计分析结果表明不同企业选择的消毒剂组合具有非常强的多样性,47 家企业有 34 种不同的消毒剂组合,其中乙醇-过氧化氢-苯扎溴铵组合使用比例最高(5 家企业),其次是乙醇-成品季铵盐类-成品杀孢子剂(3 家企业)和酸性苯酚-碱性苯酚-成品杀孢子剂(3 家企业)。此外,有 3 家企业分别使用了最多的 5 种消毒剂,有 2 家企业分别仅使用了 2 种醇类消毒剂。

2.2消毒剂验证试验参考标准规范统计分析结果
为确保消毒剂的有效性,在使用前应对其消毒效力进行评估。调研结果表明 47 家无菌药企中有 37 家(79%)公司,在其自有微生物实验室或委托第三方检验实验室开展了消毒效果验证,但仍然有 21%的企业未进行相关验证工作(图 4)。而在进行消毒效果验证试验时,仅有38%的企业在标准菌株范围外,纳入了生产环境分离菌株进行验证,而其余的 40%的企业仅选择推荐的参考菌株进行验证。
根据调研信息,制药企业进行验证试验时参考的标准或规范详见表 2,共涉及 12 个国内外标准规范,包括 4 个国内标准规范和 8 个国外标准规范。其中有 49%的企业参考《消毒技术规范》,其次为《药品 GMP 指南(无菌药品)》和 ChP。
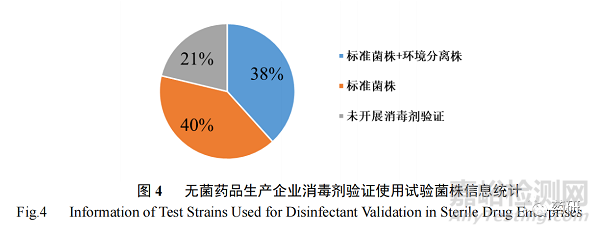


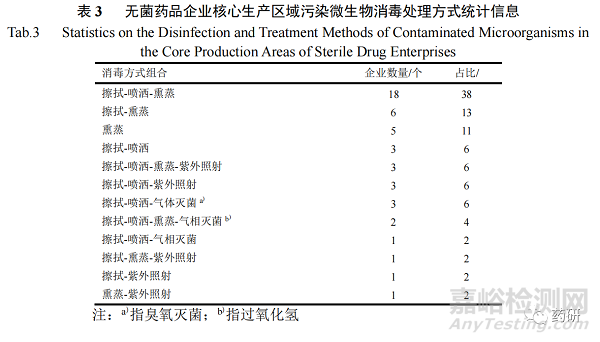
2.3核心生产区域污染微生物消毒方式统计分析结果
47 家无菌药品企业核心生产区域污染微生物的消毒方式如表 3 所示。结果表明制药企业采用的消毒方式主要有擦拭、喷洒、熏蒸、紫外照射、气相灭菌(过氧化氢)和气体灭菌(臭氧)等 6 种方式,共有 12 种消毒方式组合,其中擦拭-喷洒-熏蒸的消毒方式组合使用率最高(38%),其次是擦拭-熏蒸(13%),有 11%的企业仅采用熏蒸方法进行核心生产区域污染微生物的消毒处理。
3、讨论
无菌药品企业制定完善的洁净区域清洁和消毒管理规程,不仅可以规范企业人员消毒剂使用程序确保消毒效果,又能预防药品发生微生物污染,保障药品质量和微生物安全[13]。其中恰当的消毒剂产品选择和应用对于控制环境微生物负载和污染至关重要[14]。
本研究调研结果表明制药企业使用的消毒剂种类多达 16 种,具有较强多样性。其中乙醇的使用比例最高(74%),其次是苯扎溴铵等季铵盐类消毒剂共占比 64%。乙醇和季铵盐类消毒剂分别为中水平和低水平消毒剂,具有杀灭细菌繁殖体、部分真菌和病毒的功能,但无法杀灭细菌芽孢[12]。研究表明能够形成芽孢的细菌在药品生产环境中的污染率高达 13%,仅次于与人员操作相关的微球菌(38%)和葡萄球菌(21%)[1]。因此杀孢子剂的使用是无菌药品生产中微生物污染控制必不可少的环节。欧盟 GMP 附录 1 无菌产品和 USP<1072 消毒剂与灭菌剂>中均明确提到了生产过程使用杀孢子剂的要求[15—16]。常用的杀孢子剂主要包括戊二醛、过氧化氢、二氧化氯、过氧乙酸和次氯酸钠和以上某几种成分的混合物等。本次调研结果显示有 36%的企业选择了商业成品杀孢子剂,有部分企业使用了过氧化氢、过氧乙酸、84 消毒液(次氯酸钠)等补充其芽孢杀灭能力。但仍有 12 家企业(26%)选择的消毒剂未涵盖对芽孢菌污染的控制,存在生产过程微生物污染失控的风险。杀孢子剂一般具有强氧化性,过度使用可能导致设备腐蚀,生产人员长期暴露也会产生潜在的安全问题[17]。因此建议企业在对环境监控数据和趋势全面评估的基础之上,制定合理的消毒剂使用方案,定期或者预防性使用杀孢子剂,在保证人员和设备安全的前提下,达到良好的污染控制效果。
中国 GMP 附录 1 第 43 条规定:“一般情况下所采用的消毒剂种类应当多于一种”[12]。本次调研结果显示全部企业都选择两种及以上的消毒剂进行轮换,但从实际使用的消毒剂种类信息表明企业对 GMP 中“消毒剂种类应多于一种”的描述存在理解误区。2022 年最新发布的欧盟 GMP 附录 1 中对消毒剂的轮换进行了明确阐述,即“应使用多于一种不同作用机制的消毒剂,以保证对细菌和真菌都有效”[15]。因此企业应将不同作用机制和广谱有效作为制定消毒剂轮换措施时主要考虑因素。此外,本次调研发现部分企业选择使用多种甚至同种不同供应商的消毒剂进行轮换,如两种酚类、季铵盐类、醇类或此类产品交叠轮换使用,以防止耐受性环境菌株的出现,导致消毒方案过于复杂。PDA TR70 表明不同于临床中抗生素耐药情况,消毒剂因其效力强(>99.9%)、作用快(5~10 min)、使用浓度高的特点,迄今还没有明确论据支持消毒剂耐受性突变菌株的出现[18]。过于复杂的消毒剂产品和应用方案,例如本次调研中发现一些企业使用高达 5 种消毒剂,往往会增加工作人员的操作失误风险、人员培训负担,因此建议企业根据标准要求进一步优化消毒方案。
为确保消毒剂的适用性和有效性,根据 GMP 等相关标准要求,应对消毒剂消毒效果进行验证[19]。本次调研发现约 20%的企业未进行消毒剂消毒效果验证,存在质量保证风险。虽然标准法规中明确要求用户应对消毒剂消毒效果进行验证,但现有国内外的标准验证方法主要针对消毒剂生产厂家而非药品生产企业。药品企业可根据实际应用情况,如表面材质,环境温湿度,洁净室污染程度等,对接种量、作用表面或判定标准等进行调整,建立更加合理科学的验证方案。在进行消毒效果验证时,试验菌株的选择对于消毒剂的适用性和有效性的评判至关重要。一般情况下,标准验证方法中仅要求使用标准菌株。但其菌种选择范围与药品生产环境菌种的实际分布存在一定差异。USP 1072[16]和 PDF TR70[18]等相关标准和技术指南中都有将实际生产环境分离菌株加入验证方案的要求。因此企业在制定消毒剂消毒效果验证方案时,可根据过往环境监控数据,将生产区域高频分离污染菌种,以及文献中报道的药品生产环境中易污染、难杀灭的菌种纳入验证范围;并定期对环境监控数据进行分析,评估污染菌种分布和发展趋势,及时补充更新消毒剂验证数据。本次调查的无菌药品企业中,仅有49%的企业将环境分离菌株纳入消毒剂消毒效果验证。通过现场调研问询,主要有两方面原因:一是很多企业不具备微生物菌种鉴定能力,因而无法对具体环境分离菌株信息进行确认;二是企业未意识到环境菌株对消毒剂消毒效果验证的重要性及实际意义。因此提升制药企业生产中的微生物污染控制相关理论基础和技术能力,是帮助完善消毒制度,保证产品质量的重中之重。
无菌药品生产企业核心生产区域一旦发生微生物超标,轻则导致停工停产影响生产效率,重则导致产品污染、召回甚至影响企业声誉,因此合理使用、规范使用消毒剂对于保障产品质量安全至关重要。通过本次对无菌药品生产企业消毒剂使用现状的调研分析,可初步发现目前生产过程中消毒剂使用存在的主要问题包括:①消毒剂产品种类选择不全面,无法覆盖可能出现的微生物污染风险;②轮换机制不合理,未结合标准规范要求和操作实际定制科学方案;③消毒效果验证数据不完整,消毒剂验证方案无法充分体现消毒剂的有效性和适用性。综上所述,制定适用于制药企业的消毒效果验证标准方法或指导原则必要且紧迫,本次调研数据可为企业制定微生物污染控制策略、合理使用消毒剂,以及相关标准法规及技术指南的制修订提供数据支持。

来源:Internet


