您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-22 00:32
天然牙周组织具由复杂的矿化与非矿化的有序结构组成,构建一个完整的、生理功能性的牙周复合结构仍然是一个巨大的挑战。本研究从仿生角度出发,构建仿生牙周有序双层纳米结构的支架材料,从微纳结构、机械性能、因子微环境等多方面模拟了天然牙周组织,可募集并调控自体干细胞多向分化,最终实现牙周软硬组织协同再生。
01、研究内容简介
牙周病患病率高,常导致牙周支持组织缺损,是导致牙齿丧失、危害全身健康的主要口腔疾病之一。天然牙周组织是由软、硬组织共同构成的一个功能系统,软组织包括牙周膜和牙龈,硬组织包括牙槽骨和牙骨质。由于牙周组织具有复杂的矿化与非矿化多层有序结构,因此很难重建天然牙周组织结构,实现牙周组织功能性再生。
生物可降解支架与生长因子相结合的新型组织工程技术在再生医学领域显示出巨大的潜力。生物可降解支架提供生理微环境并传递生长因子,有助于调节牙周膜干细胞的迁移、增殖、分化和细胞外基质的产生,为牙周组织再生提供了一种有前景的治疗方法。目前,很多搭载生物因子的支架材料被开发,如共组装基质细胞衍生因子1(SDF1)和骨形态发生蛋白2(BMP2)的超分子水凝胶可同时持续释放两种生物活性因子,从而有效促进牙周骨组织的重建。然而,以往多数研究仅制备了单相支架,难以再生出复杂的牙周多层组织结构。
具有明显不同的物理性能和化学结构的双相或多相支架已用于牙周组织再生。基于引导性组织再生的原理,有学者制备出模拟软硬组织界面的多相支架,包括半刚性聚乳酸-共乙醇酸和磷酸钙双分子层生物材料、聚己内酯-聚乙醇酸双分子层生物混合材料、几丁质-聚乳酸-共乙醇酸/纳米生物活性玻璃陶瓷/牙骨质蛋白三相水凝胶支架材料。尽管先前报道模拟牙周组织差异结构和力学特性的多相支架能够在一定程度上形成牙周样结构,但完整的牙周组织功能性再生仍具挑战性。另外,模拟牙周组织的分级微/纳米结构和独特的生长因子微环境的报道较少,干细胞多向分化形成软硬组织的机制仍存在争议。
牙周组织再生必须满足以下三个条件:(1)构建具有不同力学性能的矿化与非矿化双相支架;(2)构建分级的微/纳米拓扑结构以模拟天然牙周组织结构;(3)提供生物活性因子以募集宿主干细胞,并调控其多向分化。
在本研究中,我们利用纳米蚀刻模板将新一代血小板浓缩生长因子(CGF)制成仿牙周膜样平行结构,通过自组装技术构建仿牙槽骨样多孔结构的纤维内矿化胶原(IMC)支架,最后采用微压印技术将CGF与IMC机械结合制成仿牙周有序双层CGF/IMC纳米支架材料,并表征了双层材料的微纳结构、力学性能、生长因子的释放和对成纤维向和成骨向分化的调控作用及机制。仿生有序双层支架的CGF层表现为平行有序纤维结构,其杨氏模量为42.62 ± 4.58 MPa,接近天然牙周膜,可诱导干细胞平行排列和成纤维向分化;IMC层呈现骨样横纹结构和纳米均匀多孔微观结构,其杨氏模量为1409.00 ± 160.83 MPa,接近天然牙槽骨,可诱导干细胞交错排列和成骨向分化。材料CGF层和界面均高表达生长因子TGF-β 1和VEGF,并持续缓释至14天。CGF/IMC支架表面的干细胞高表达TGF-β 1和p-Smad3(Fig.1和Fig.2)。
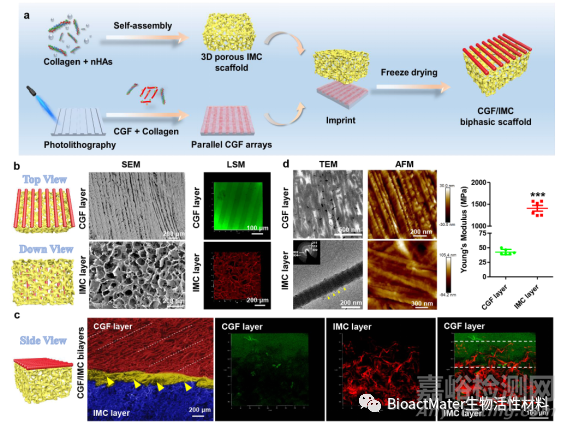
图 1.矿化/非矿化双层结构的制造和表征。a) 用于制造分层 CGF/IMC 双相支架的示意图。b) CGF层和IMC层的SEM和LSM图像在自上而下的视图中。c) 侧视图中分层 CGF/IMC 双层界面的 SEM 和 LSM 图像。黄色开口箭头和白点线表示 CGF/IMC 的界面(约 150 μm)。d)TEM和AFM纳米结构,以及CGF层和IMC层的杨氏模量。CGF原纤维是平行排列的,IMC具有典型的D周期(〜67nm,在两个黄色开放箭头之间)。所选区域电子衍射表明,IMC中的纳米羟基霰石表现出完美的晶体结构,c轴优先沿胶原轴定向(插图)。: P < 0.001.
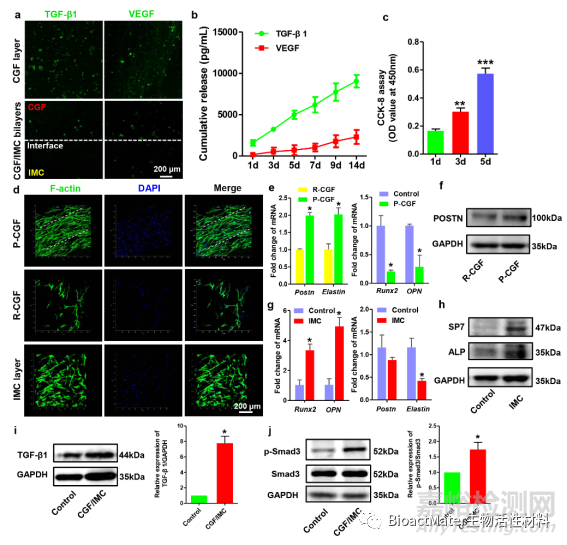
图 2.体外多级CGF/ IMC双层结构的生长因子丰富的微环境和细胞调控。a) TGF-β1 和 VEGF 在 CGF 层和 CGF/IMC 双分子层的横截面中的免疫荧光染色。b)从CGF / IMC双层体外累积释放TGF-β1和VEGF1,持续14天。c) CCK-8 测定。d)平行排列的CGF(P-CGF),随机排列的CGF(R-CGF)和IMC层中的细胞排列在1天。e)在7天培养的P-CGF和R-CGF培养的PDLSCs中纤维分化相关基因(Postn和弹性蛋白)的mRNA表达水平,以及在6孔板(对照)和P-CGF上培养的14天培养的PDLSCs中的成骨分化相关基因(Runx2和OPN)的mRNA表达水平。f) 7天在P-CGF和R-CGF中对POSTN进行蛋白质印迹。g)14天在6孔板和IMC上培养的PDLSCs中成骨分化相关基因(Runx2和OPN)的mRNA表达水平,以及在6孔板和IMC上培养的PDLSCs中成纤维分化相关基因(Postn和弹性蛋白)的mRNA表达水平。h) 在 6 孔板和 IMC 培养的 PDLSC 中 SP7 和 ALP 的免疫印迹,在 7 天时进行。i, j) 在 6 孔板和 CGF/IMC 培养的 PDLSC 中 TGF-β1、Smad3 和 p-Smad3 的蛋白质印迹 3 天。*: P < 0.05;**: P < 0.01;: P < 0.001.
将该仿生支架材料植入大鼠牙周缺损区8周后,CGF/IMC组新生骨密度与天然骨密度一致,可见连续完整的新生牙周膜、牙槽骨和牙骨质,新生牙周膜胶原纤维较成熟,并有丰富的血管新生;而阳性对照组(BIO-OSS骨粉与CGF直接混合)缺损区多为未降解材料,可见少量新生牙槽骨和周牙膜;Blank组(无材料植入)缺损区未见新生牙周组织。牙槽骨标记物BMP2、OCN,牙周膜标记物COL-1,血管标记物VEGFR-1,干细胞标记物CD90和CD105,TGF-β 1和Smad3在CGF/IMC组的表达量均明显高于其他组(Fig.3, Fig.4和Fig.5)。
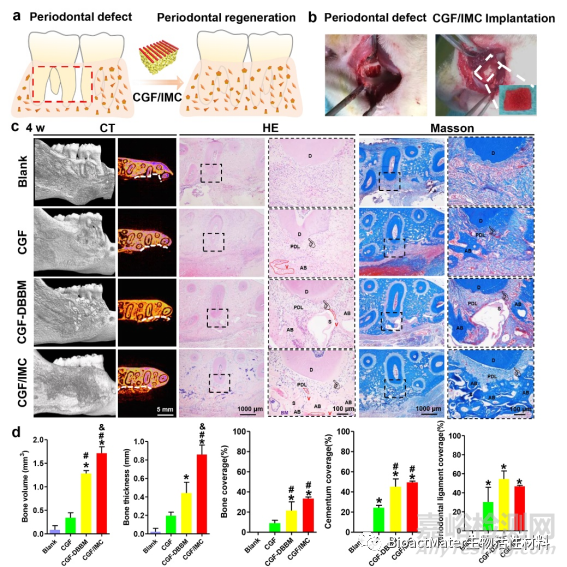
图 3.CGF/IMC双层架构的原位多谱系分化。a)将CGF / IMC双层移植到大鼠牙周组织缺损中的方案。b)牙周缺损和CGF / IMC双层植入的手术图像。c)Micro-CT,HE和Mason的三色染色在4周时对牙周缺损修复的横截面进行染色。白线表示显微 CT 图像中的缺陷边界。D:牙本质,PDL:牙周韧带,AB:肺泡骨,S:支架,BM:骨髓,V:血管。d) 在显微CT和HE图像中对新形成的肺泡骨,骨水泥和牙周韧带百分比进行半定量分析。*: P < 0.05 对空白,#: P < 0.05 对 CGF, &: P < 0.05 对 CGF–DBBM。
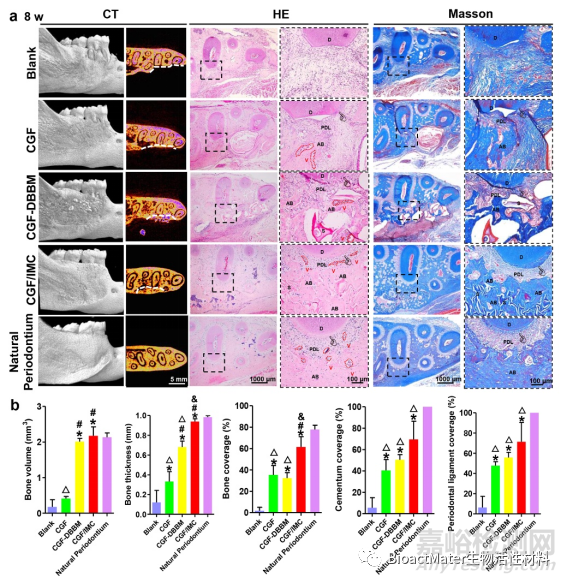
图 4.在体内完全恢复牙周组织。a)微CT,HE和Mason的牙周组织再生区域的三色染色。白线显示缺陷边界。D:牙本质,PDL:牙周韧带,AB:肺泡骨,S:支架,V:血管,指针:骨水泥。b) 在显微CT和HE图像中对新形成的肺泡骨,骨水泥和牙周韧带百分比进行半定量分析。*: P < 0.05 vs Blank, #: P < 0.05 vs CGF, &: P < 0.05 vs CGF–DBBM, △: P < 0.05 vs. Natural periodontium。

图 5.通过宿主干细胞募集和Smad3活化,通过CGF / IMC双层结构促进牙周组织再生。a) TGF-β1和CD105以及TGF-β1和CD90植入4周后的免疫荧光共染色。b)每片(a)的阳性细胞数的半定量分析。c)植入8周后,在新形成的肺泡骨(AB)区域和牙周韧带(PDL)区域对BMP2,OCN,COL-1,VEGFR-1,TGF-β1和Smad3进行免疫组织化学染色。d)每片(c)的阳性细胞数的半定量分析。*: P < 0.05 对空白,#: P < 0.05 对 CGF, &: P < 0.05 对 CGF–DBBM。
将该仿生支架材料植入裸鼠皮下8周后,CGF/IMC可形成牙周膜和牙槽骨样结构,BMP2、COL-1、VEGFR-1及干细胞标记物CD146和STRO-1高表达(Fig.6)。
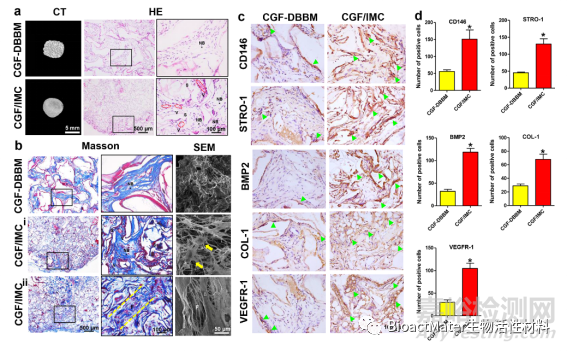
图 6.异位再生模型中CGF/IMC双层结构的宿主MSC募集和多谱系分化。a)新组织的代表性显微CT图像和HE染色图像。注意:新骨,S:支架,V:血管。b)代表Masson的三色染色和新组织的SEM图像。i) 骨样组织区域;ii)PDL样组织区域。F: 纤维;黄色箭头:具有延伸的假足的细胞。c) CD146、STRO-1、BMP2、COL-1 和 VEGFR-1 的免疫组化染色。开放箭头:阳性细胞。d)每片(c)的阳性细胞数的半定量分析。*: P < 0.05。
综上所述,仿生有序双层CGF/IMC材料从微纳结构、机械性能、因子微环境等多方面模拟了天然牙周组织,可募集并调控自体干细胞多向分化,最终实现牙周软硬组织协同再生(Scheme 1)。
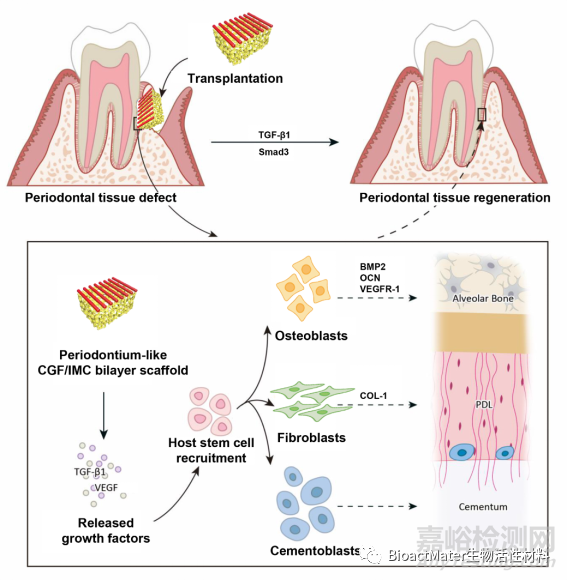
方案1.通过分层CGF / IMC双层结构的牙周硬/软组织再生的潜在机制。

来源:BioactMater生物活性材料


