您当前的位置:检测资讯 > 热点事件
嘉峪检测网 2022-07-26 23:15
7月25日,AcuFocus, Inc.宣布其用于治疗白内障的突破性IC-8® Apthera™人工晶状体获得FDA的批准。Apthera是第一款也是唯一一款获准用于角膜散光1.5D的白内障患者的人工晶状体。
"我们很高兴我们的第一款Apthera人工晶体获得FDA批准。"AcuFocus总裁兼首席执行官Al Waterhous称。"Apthera人工晶体对外科医生和患者来说代表了几个第一:第一个获得FDA批准的小孔径人工晶状体,第一个适用于单眼视觉的扩展焦深晶状体,以及第一个适用于角膜散光程度较低的白内障患者的非散光人工晶状体。"
白内障是一种常见的疾病,在美国估计有2400万人受到影响。白内障只能通过移除浑浊的天然晶状体并植入人工晶状体的手术来治疗。大多数患者在白内障手术时接受单焦点人工晶状体,虽然单焦点人工晶状体提供了良好的远距离视力,但近距离的物体仍然模糊不清。其他现有的老花眼矫正镜片设计具有复杂的光学原理,可以分割、转移或拉伸光线,以在多个离散焦点处提供清晰的视觉。相比之下,Apthera人工晶体凭借其专有的小孔技术,无缝提供出色的远视力以及清晰的中近视力,有效地减轻老花眼的影响。
"Apthera人工晶体是第一款具有嵌入式FilterRing™组件的晶状体,通过简单地过滤掉会降低图像质量的外围失焦和畸变光,使得中央聚焦的光线能够被输送到视网膜,来减轻老花眼的影响。"Vance Thompson Vision公司的医学博士Vance Thompson说:"这种新颖的作用机制为患者提供了从远到中、近的连续视力范围,即使他们有高达1.5D的角膜散光。"
FDA批准Apthera人工晶体是基于美国IDE研究数据,该研究评估了一只眼睛植入Apthera人工晶体、另一只眼睛植入单焦点或单焦点散光人工晶体的安全性和有效性。共有453名受试者参加,并随访了12个月。Apthera人工晶体组(n=343)的结果与双眼接受单焦点或单焦点散光人工晶体的对照组(n=110)进行了比较。Apthera人工晶体治疗的眼睛保持了2D的扩展焦点深度,并且在0.2 logMAR阈值下,比单焦点人工晶体的眼睛多出0.91D的视觉范围,超过了0.50D的ANSI扩展焦点深度人工晶体的标准。与对照组相比,Apthera人工晶体受试者取得了相当的未矫正远视力,并在统计学上取得了较好的中近视力。Apthera人工晶体受试者还在明视觉和中间视觉的条件下取得了与对照组受试者相当的双眼对比敏感度,这是扩展焦距深度晶体的首次报告。
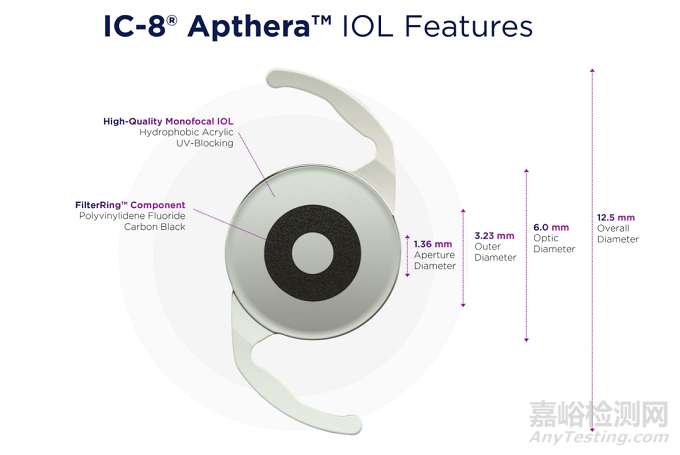
"作为Apthera人工晶体的临床研究者之一,我亲眼目睹了其独特的光学效果,迫不及待地想把它加入我的实践中,"Virginia Eye Consultants公司的Elizabeth Yeu医生称。"Apthera人工晶体与我们以前的任何晶体都不同。我相信它将填补我们人工晶体武器库中的一个重要空白,使每一位白内障外科医生能够有意义地扩大他们对病人的治疗选择"。
该公司计划于2022年秋季在美国开始Apthera人工晶状体的限量发行。

来源:医疗器械创新网


