您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2022-07-29 14:25

FDA消息,Covidien, LLC (Medtronic) 回收因导管毂缺陷而导致的 Palindrome 和 Mahurkar 血液透析导管。FDA 已将此确定为 I 类召回,这是最严重的召回类型。使用这些设备可能会导致严重伤害或死亡。
召回产品
产品名称:Palindrome 和 Mahurkar 血液透析导管
产品代码:MSD
型号:参见召回数据库条目
生产日期:2017 年 6 月 1 日至 2022 年 4 月 1 日
分发日期:2017 年 6 月 28 日至 2022 年 5 月 11 日
在美国召回的设备:1,032,377
公司发起日期:2022 年 6 月 8 日
设备使用
Palindrome 和 Mahurkar 血液透析导管
Palindrome 和 Mahurkar 导管被植入并用于血液透析(从血液中过滤废物和水的治疗)、单采术(一种分离捐赠的血液成分以治疗某些疾病的技术)和输液(一种将液体注入血液的方法) .
召回原因
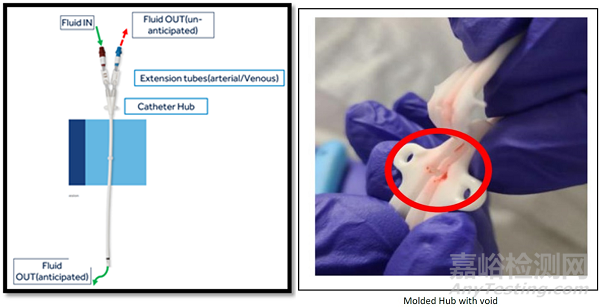
Covidien, LLC (Medtronic) 正在召回 Palindrome 和 Mahurkar 导管,原因是连接两个延长导管的导管毂缺陷。在特定慢性透析导管的中心内存在潜在的泄漏情况。当冲洗一根延长管时,可能会注意到这一点,并且通过导管尖端的流体流会通过相邻的延长管返回意料之外的流体。在治疗期间,这种渗漏可能导致动脉和静脉血的混合,导致再循环增加和透析不良,以及血栓和栓子的形成。
使用有缺陷的导管可能会导致严重的不良健康后果,包括出血、手术切除和更换受影响的导管。
有一个投诉。没有死亡或受伤的报告。

来源:嘉峪检测网


