您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-10 07:23
摘要
目的 了解我国病原菌多重核酸检测试剂盒的分析性能的现状,特别是检出限性能的基本情况,为相关研发企业和医疗机构使用者提供参考。
方法 根据体外诊断试剂行业标准《细菌和真菌感染多重核酸检测试剂盒(标准号YY∕T 1725-2020)》,使用“34种细菌和真菌感染多重核酸检测试剂国家参考品(批号370026-201801)”对10种不同检测技术原理的病原菌多重核酸检测试剂盒的分析性能做了评估,包括阳性符合率、阴性符合率、重复性及检出限等进行质量评价,并按照国家参考品的质量标准对评价结果进行统计分析。
结果 10款试剂盒中包括4款呼吸道感染、3款中枢神经感染及3款血流感染试剂盒,检测范围或病原谱覆盖8种革兰阳性细菌、14种革兰阴性细菌及10种真菌和非典型病原体。各试剂盒的阳性符合率、阴性符合率、重复性及检出限等分析性能均符合国家参考品的质量标准。呼吸道、中枢神经及血流感染类试剂盒病原菌谱及检出限性能差异较大,检出限的中位值分别为5×103 CFU/ml、1×103 CFU/ml及1×106 CFU/ml;各试剂盒病原菌谱中分布和出现频率较高的6种病原菌分别为肺炎链球菌(检出限的中位值为5×102 CFU/ml)、金黄色葡萄球菌(3×103 CFU/ml)、流感嗜血杆菌(1×103 CFU/ml)、铜绿假单胞菌(5×104 CFU/ml)、鲍曼不动杆菌(3×106 CFU/ml)及大肠埃希氏菌(5×104 CFU/ml)。结论 我国已经进入体外诊断试剂注册阶段的病原菌多重核酸检测试剂盒均具有较好的准确性、特异性及重复性;同时,研发企业应注意结合临床具体的需求,设计合理的试剂盒病原菌谱,并持续优化检出限性能。
[关键词] 病原菌;多重核酸检测;参考品;检出限
病原菌引起的呼吸道、中枢神经系统、血流、胃肠道及生殖道等感染性疾病具有发病急、进展快等特点,且临床发病率和病死率较高,对人类健康构成严重威胁。近年新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)疫情发生以来,临床继发性病原菌合并感染更是会严重威胁COVID-19患者的生命[1-2]。迅速地确定感染病原体对于患者的治疗及预后十分关键。尽管目前临床传统的病原菌检测方法仍以培养及表型鉴定为主,分离培养虽然是病原学诊断的“金标准”,但检测周期长、操作繁琐、敏感性低等已无法满足临床诊治的需求。与之相比,分子诊断技术的速度发展,在突发性感染的评估、感染早期的发现、监测及病原菌耐药基因分析等领域发挥了越来越重要的作用[3-7]。
近年来逐渐发展的病原菌多重核酸检测技术,即在一个核酸反应体系中同时对多个靶标病原菌进行检测,更具有操作简便、覆盖病原菌谱广、能够分辨混合感染等优势,正受到越来越多的关注和应用。目前,美国FDA已经批准了10余款病原菌多重核酸检测试剂盒,覆盖PCR、熔解曲线、恒温扩增及微阵列核酸芯片等技术原理;我国药监部门批准了3款试剂盒[8-9]。然而,多重核酸检测技术仍存在一些局限和挑战。例如,多重反应体系研发难度较大、试剂盒特异性和灵敏度可能会低于单一靶向反应体系、试验操作较为繁琐及检测成本较高等;另外,相关试剂盒在检测技术的选择、检测范围或病原谱的设计及检出限性能的优化等方面也面临诸多挑战。因此,为保证病原菌多重核酸检测试剂盒的质量,应特别重视相关产品的质量控制及评价研究[10]。
2018年至今,仅在中国食品药品检定研究院完成注册检验的病原菌多重核酸检测试剂盒就有将近20款,行业爆发式发展的态势已然初现。为全面了解我国相关产品分析性能的基本现状,针对10款进入体外诊断试剂注册阶段的病原菌多重核酸检测试剂盒的部分分析性能,包括阳性符合率、阴性符合率、重复性及检出限性能进行了质量评价研究。
01、材料与方法
1.1 评价方案 评价用体外诊断试剂行业标准《细菌和真菌感染多重核酸检测试剂盒(标准号YY∕T 1725-2020)》由项目组牵头制定并发布,标准基于“34种细菌和真菌感染多重核酸检测试剂国家参考品(批号370026-201801)”,对相关试剂盒的要求、试验方法及标签和使用说明书等内容进行了规定[10-12]。
上述评价用国家参考品由项目组研制并提供,参考品由34种具有特定浓度(CFU/ml)的病原菌组成,包括12株革兰阳性细菌(肺炎链球菌、金黄色葡萄球菌、无乳链球菌、单核细胞增多性李斯特菌、屎肠球菌、粪肠球菌、表皮葡萄球菌、化脓链球菌、滕黄微球菌、马红球菌、格氏李斯特菌、缓症链球菌)、16株革兰阴性细菌(脑膜炎奈瑟菌、感嗜血杆菌、嗜肺军团菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、大肠埃希氏菌、产酸克雷伯菌、阴沟肠杆菌、奇异变形杆菌、粘质沙雷氏菌、干燥奈瑟氏菌、荧光假单胞菌、嗜水气单胞菌、琼氏不动杆菌、副流感嗜血杆菌)及6株念珠菌(热带念珠菌、光滑念珠菌、白色念珠菌、近平滑念珠菌、克柔念珠菌、葡萄牙念珠菌)[10]。
1.2 病原菌多重核酸检测试剂盒 进行分析性能质量评价研究的10款病原菌多重核酸检测试剂盒由7家企业(广州万孚生物技术股份有限公司、苏州创澜生物科技有限公司、华大生物科技(武汉)有限公司、梅里埃诊断产品(上海)有限公司、湖南圣湘生物科技有限公司、百康芯(天津)生物科技有限公司、上海捷诺生物科技有限公司)提供,见表1。
表1 病原菌多重核酸检测试剂盒▾

注:*. 试剂盒A、E、F和G同时检测病原菌和病毒;POCT. 即时检验。
1.3 分析性能质量评价 根据《细菌和真菌感染多重核酸检测试剂盒》行业标准和“34种细菌和真菌感染多重核酸检测试剂国家参考品”,按照试剂盒A~J说明书进行实验操作:稀释参考品至病原菌浓度≥1×105 CFU/ml后,对稀释样本检测1次,评价试剂盒的阳性和阴性符合率进行评价;稀释参考品至病原菌浓度≤检出限浓度的5倍后,对稀释样本重复检测10次,评价试剂盒的重复性;按10倍梯度稀释参考品至病原菌浓度<企业宣称的检出限浓度,对各梯度稀释样本检测1次,评价试剂盒的检出限。
1.4 评价标准及结果分析的评价标准 对于阳性和阴性符合率,试剂盒检测范围内的病原菌均应检出且与已知种属相符,不在检测范围内的均不应检出;对于重复性,10次重复检测结果,试剂盒检测范围内的病原菌均应检出且与已知种属相符;检出限,检测经10倍梯度稀释的参考品,试剂盒检测范围内的病原菌,在检出限浓度以上时均应检出且与已知种属相符。对检出限评价结果进行统计及分类分析。
1.5 病原菌多重核酸检测试剂盒基本情况 进行质量评价的10款试剂盒A~J,包括4款呼吸道感染试剂盒、3款中枢神经感染试剂盒及3款血流感染试剂盒。其中,6款试剂盒仅检测病原菌,4款(1款呼吸道感染、3款中枢神经感染)试剂盒同时检测病原菌和病毒;4款为全自动核酸即时检验(point-of-care testing, POCT),2款为半自动核酸POCT。上述试剂盒的技术原理,覆盖目前常见的8种核酸检测原理,包括荧光定量PCR、巢式PCR、扩增子拯救多重PCR、熔解曲线、恒温扩增、微流控芯片、微阵列芯片及宏基因组高通量测序技术。各试剂盒具体信息见表1。
对于文中分析的10款试剂盒,其检测范围或病原菌谱既有重叠又各不相同。例如,呼吸道试剂盒、中枢神经试剂盒及血流试剂盒的病原谱均包含肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌、铜绿假单胞菌、鲍曼不动杆菌及大肠埃希氏菌等6种细菌;百日咳杆菌、嗜肺军团菌、嗜麦芽窄食单胞菌、卡他莫拉菌、肺炎支原体、肺炎衣原体及烟曲霉等7种细菌和真菌仅出现在呼吸道感染试剂盒病原谱中;新生和格特隐球菌仅出现在中枢神经感染试剂盒病原谱中;化脓链球菌、近平滑念珠菌及克柔念珠菌等3种细菌和真菌仅出现在血流感染试剂盒病原谱中。各试剂盒具体病原菌谱见表2。
表2 多重核酸检测试剂盒的病原菌谱▾
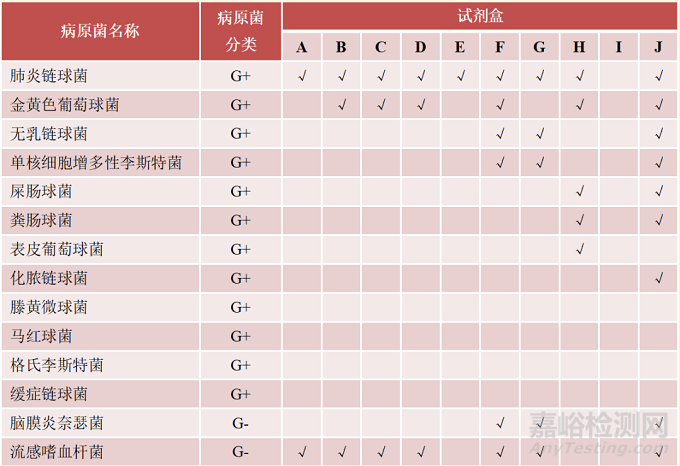
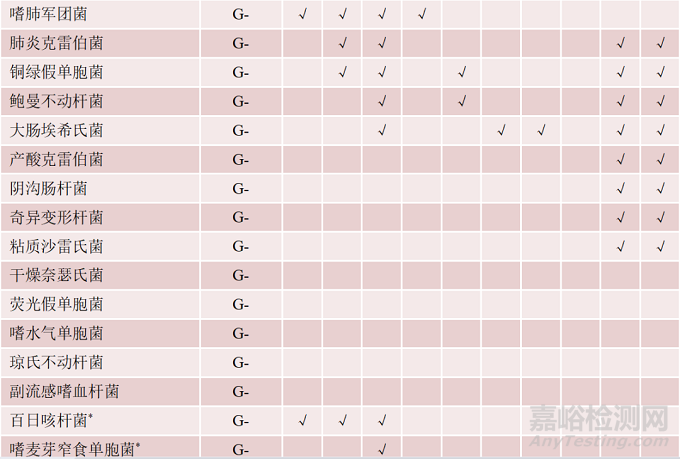
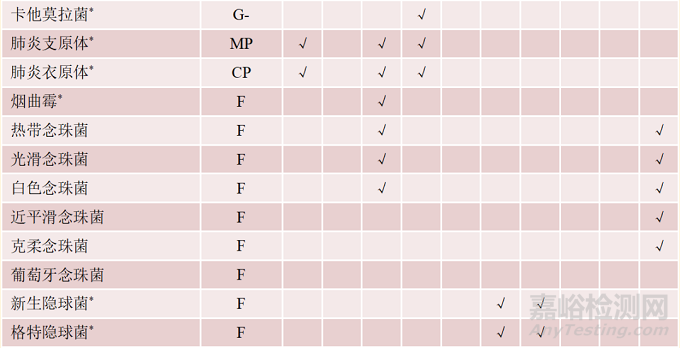
注:*. 国家参考品中未覆盖的病原菌;G+. 革兰阳性细菌;G-. 革兰阴性细菌;F. 真菌;MP. 肺炎支原体;CP. 肺炎衣原体;√. 该菌在病原菌谱中
02、结 果
使用参考品评价阳性和阴性符合率即重复性,结果表明病原菌浓度≥1×105 CFU/ml时,在试剂盒检测范围内的病原菌均能检出并鉴定为正确的种属,检测范围外病原菌均未检出,表明试剂盒A~J具有较好的准确性和特异性;病原菌浓度≤检出限浓度的5倍时,在试剂盒检测范围内的病原菌10次重复检测均能检出并鉴定为正确的种属,表明试剂盒A~J具有较好的重复性。
使用参考品评价检出限,试剂盒A~J检测范围内的病原菌的检出限性能差异较大,从1 CFU/ml~8.5×105 CFU/ml,以下按照4种不同因素进行分类分析。
① 按呼吸道、中枢神经及血流3种感染类型分析试剂盒的病原菌谱检出限性能,中位值(最小值,最大值)分别为5×103 CFU/ml(15 CFU/ml,5×104 CFU/ml)、1×103 CFU/ml(1 CFU/ml,6×103 CFU/ml)及1×106 CFU/ml(2×103 CFU/ml,8.5×107 CFU/ml)。
② 按革兰阳性和阴性细菌及真菌3种病原菌种类分析,检出限的中位值均为5×104 CFU/ml。
③ 分析病原菌谱中分布和出现频率较高的6种菌的检出限,肺炎链球菌为5×102 CFU/ml(15 CFU/ml,5×105 CFU/ml)、金黄色葡萄球菌为3×103 CFU/ml(5×102 CFU/ml,2.5×106 CFU/ml)、流感嗜血杆菌为1×103 CFU/ml(6×102 CFU/ml,1×106 CFU/ml)、铜绿假单胞菌为5×104 CFU/ml(1×102 CFU/ml,1×106 CFU/ml)、鲍曼不动杆菌为3×106 CFU/ml(5×102 CFU/ml,1×107 CFU/ml)及大肠埃希氏菌为5×104 CFU/ml(1 CFU/ml,3×107 CFU/ml)。
④按不同检测原理分析,荧光定量PCR为1×103 CFU/ml(1 CFU/ml,6×103 CFU/ml)、巢式PCR为1×105 CFU/ml(1×102 CFU/ml,8.5×107 CFU/ml)、扩增子拯救多重PCR为2×106 CFU/ml(5×105 CFU/ml,5×106 CFU/ml)、恒温扩增为5×104 CFU/ml(5×102 CFU/ml,5×104 CFU/ml)、高通量测序为5×102 CFU/ml(1×102 CFU/ml,5×102 CFU/ml)。试剂盒检出限性能分析情况见图1。
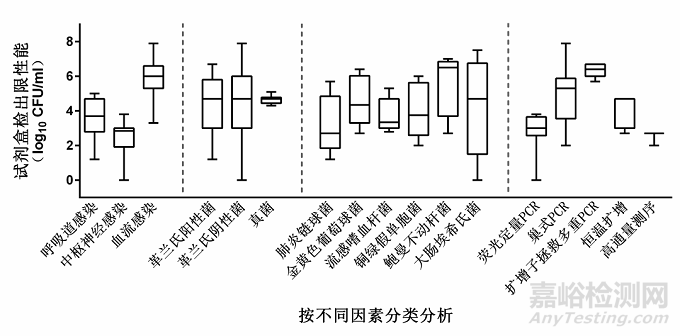
图1 病原菌多重核酸检测试剂盒检出限性能的分析▴
注:柱状图中间的短横线表示检出限的中位值,柱状图两端分别表示检出限的最大值和最小值。各试剂盒病的检出限性能取log10值进行统计分析
03、讨 论
自COVID-19疫情以来,分子诊断技术在临床感染的诊断、疗效及预后评估等领域得到越来越多的重视。病原菌引起的感染性疾病,特别是不明原因感染,给人类生命健康带来严重威胁[17]。随着分子诊断技术的发展及检测成本的下降,特别是多重核酸检测技术的应用日益广泛,相比传统病原菌检测技术具有更好的时效性、准确性以及灵敏度,使得病原菌的快速精准诊断不断的创新和发展。近年来,美国食品药品监督管理局不仅批准了10余个病原菌多重核酸检测试剂盒,更是先后制定并公布了4个相关指导原则用于规范此类试剂盒的质量[13-16]。本项目组于2018年,先后研制了“34种细菌和真菌感染多重核酸检测试剂国家参考品(批号370026-201801)”,并牵头起草了《细菌和真菌感染多重核酸检测试剂盒(标准号YY∕T 1725-2020)》体外诊断试剂行业标准,从实物标准和文字标准两方面建立了较为全面的质量控制与评价体系,有助于促进我国相关行业的健康快速发展,以及保证相关试剂盒的质量[10-12]。
病原菌多重核酸检测试剂盒的检测原理及技术组合繁多。本研究中的10款试剂盒涵盖了8种核酸检测原理及7种技术组合(见表1),因此在产品设计开发、性能验证及确认过程中需要严格的优化及测试,才能使各种技术的组合达到性能最优配置。一般而言,核酸扩增反应体系中引物和探针的数量越多,即检测的病原菌数量越多,以及使用的技术组合越复杂,产品研发的难度越高[18]。例如,试剂盒F、G和J分别为单管检测12种、14种和22种病原体,其产品研发的难度远高于单管检测10种以下病原体;试剂盒B为单管检测7种病原体,但在一个荧光通道中分别使用荧光定量PCR和熔解曲线2种技术分别检测2种病原体,因此其产品研发的难度也高于普通荧光定量PCR试剂盒;试剂盒C和D应用微流控技术,将多个单重反应体系叠加从而实现多重核酸检测,但其使用的环介导恒温扩增技术仍需注意检出限和稳定性的优化,同时微流控芯片的大规模制造也需注意严格控制不良品率[19]。
病原菌多重核酸检测试剂盒的操作复杂程度、检测时间及成本控制各有不同,检测的操作步骤一般分为样本前处理、核酸提取纯化或裂解、靶标基因核酸序列扩增、扩增子检测及结果报告,不同试剂盒检测流程的自动化、时间及成本也各不相同,是影响其临床普及应用的重要因素。例如,为提高灵敏度和特异性所选择的巢式PCR技术,不仅需要2轮PCR操作,更容易因其扩增子浓度极高而造成实验室气溶胶污染及假阳性结果;而基于微流控技术“样本进、结果出”的全自动POCT试剂盒(试剂盒G~J),则能很好地避免污染(见表1),还具有操作容易、检测时间较短等优势,但其检测成本要高于手工操作的PCR试剂盒。核酸提取过程较易实现自动化,但由于不同种类病原体(病毒和病原菌)的核酸提取难易程度不同,仍需进行优化及验证,本研究中同时检测病毒和病原菌的4款试剂盒(试剂盒A、E、F及G)中有2款未选择自动化核酸提取流程(见表1)。试剂盒F的结果判读过程为非自动化,需要检测人员将阳性结果的Tm值与18个病原体的熔解曲线Tm值范围逐一比对后进行判读,不仅影响检测时间,还容易导致检测效率较低且易出错。基于宏基因组高通量测序技术原理的试剂盒E,操作步骤繁琐、所需测序时间较长且自动化程度低,相比PCR和恒温扩增等试剂盒不仅有较长的检测时间和较高的检测成本,还可能由于复杂的手工操作导致检测系统整体的稳定性受影响。
病原菌多重核酸检测试剂盒的病原谱及检出限性能与应用场景密切相关。呼吸道感染检测试剂盒的病原菌谱,革兰阴性菌占大多数,而中枢神经感染和血流感染检测试剂盒的病原菌谱中,革兰阴性和革兰阳性菌的占比则差别不大(见表2)。由于病原菌在不同临床感染样本中的浓度不同,相应试剂盒的检出限性能也不同。例如,脑脊液样本一般比较干净,因此中枢神经感染检测试剂盒(试剂盒E~G)的检出限较低,有助于更灵敏地检测到病原菌;血培养阳性样本中病原菌的浓度一般均较高,对试剂盒(试剂盒H~J)的检出限要求不高,因此试剂盒在优化时可能会更侧重提高特异性,即在反应体系中存在极高浓度核酸的情况下应避免发生非特异性扩增;呼吸道样本中杂质较多且存在定植菌,因此相应试剂盒(试剂盒A~D)的检出限处于前两类试剂盒之间,通过设计较为均衡的检出限,既能实现较好的检测灵敏度,又有助于区分致病菌和定植菌。
本研究使用国家参考品在实验室内对10款适用于呼吸道感染、中枢神经感染及血流感染临床诊断且已经进入体外诊断试剂注册阶段的病原菌多重核酸检测试剂盒的分析性能进行评价,并重点按照不同影响因素对其检出限性能进行了深入分析。后续,相关试剂盒还将通过开展严格的临床试验来评价其临床性能,从而最终验证其性能能否满足临床使用需求。本研究提示,不同病原菌多重核酸检测试剂盒的技术原理、靶标病原菌数量、自动化程度及操作复杂程度等各不相同;此外,适用于不同临床应用场景的试剂盒,其病原菌谱的设计和检出限性能的优化也各不相同。上述质量评价结果及分析有助于相关研发企业和医疗机构使用者深入了解我国病原菌多重核酸检测试剂盒分析性能的现状。
参考文献:
[1] 胡明,李绪言,邱海波,等. 新型冠状病毒肺炎患者继发细菌感染防治的体会与建议[J]. 中华重症医学电子杂志,2020,6(2):230-232. DOI: 10.3877/cma.j.issn.2096-1537.2020.02.026.
[2] 刘伟,李若瑜. 对新型冠状病毒肺炎继发真菌感染的思考[J]. 微生物与感染,2020,67(1):58-61. DOI: 10.3969/j.issn.1673-6184.2020.01.011.
[3] 曹清. 分子诊断检测在儿童感染性疾病的临床应用价值及卫生经济学分析[J]. 中华医学信息导报,2021,36(1):21-21. DOI: 10.3760/cma.j.issn.1000-8039.2021.01.134.
[4] 吕晶南,余方友. 分子生物学技术在感染性疾病诊断中的应用进展[J]. 临床检验杂志,2021,39(2):81-85. DOI: 10.13602/j.cnki.jcls.2021.02.01.
[5] 干驰,莫茜,陶悦. PCR技术在病原菌诊断中的研究进展[J]. 中国实验诊断学,2020,24(4):149-153. DOI: 10.3969/j.issn.1007-4287.2020.04.047.
[6] 金君,孙仁华,呼邦传. 血流感染的分子诊断研究进展[J]. 中国现代医生,2020,58(36):182-187.
[7] 张培金,唐丽玲,钱丽华,等. 碳青酶烯类耐药肺炎克雷伯菌临床分布及其耐药特征[J]. 传染病信息,2021,34(2):165-168. DOI: 10.3969/j.issn.1007-8134.2021.02.017.
[8] Food and Drug Administration. Nucleic Acid Based Tests-Multiplex Panel[EB/OL]. [2021-08-20]. https://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm330711.htm.
[9] 国家药品监督管理局. 医疗器械查询[EB/OL]. [2021-08-20]. https://www.nmpa.gov.cn/ylqx/index.html.
[10] 刘东来,周海卫,石大伟,等. 细菌感染多重核酸检测试剂参考品的建立[J]. 传染病信息,2018,31(3):23-28. DOI: 10.3969/j.issn.1007-8134.2021.02.017.
[11] YY/T 1725-2020,细菌和真菌感染多重核酸检测试剂盒[S].
[12] 中国食品药品检定研究院. 注册检验用体外诊断试剂国家标准品和参考品目录(第五期)[EB/OL]. [2019-04-10]. https://www.nifdc.org.cn//nifdc/bshff/bzhwzh/bzwztzgg/20190410150800480.html.
[13] Food and Drug Administration. Class II Special Controls Guidance Document Respiratory Viral Panel Multiplex Nucleic Acid Assay[EB/OL]. [2009-10-09]. https://www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm180324.pdf.
[14] Food and Drug Administration. Highly Multiplexed Microbiological Medical Countermeasure In Vitro Nucleic Acid Based Diagnostic Devices[EB/OL]. [2014-08-27]. https://www.fda.gov/downloads/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/UCM327294.pdf.
[15] Food and Drug Administration. Class II Special Controls Guideline: Gastrointestinal Microorganism Multiplex Nucleic Acid-Based Assays for Detection and Identification of Microorganisms and Toxin Genes from Human Stool Specimens[EB/OL]. [2015-11-02]. https://www.fda.gov/downloads/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/UCM470559.pdf.
[16] Food and Drug Administration. Class II Special Controls Guideline: Multiplex Nucleic Acid Assay for Identification of Microorganisms and Resistance Markers from Positive Blood Cultures[EB/OL]. [2015-05-27]. https://www.fda.gov/ucm/groups/fdagov-public/@fdagov-meddev-gen/documents/document/ucm448520.pdf.
[17] 焦艳梅, 揣征然, 赵雅琳,等. 2020年全球传染病重要疫情事件回顾[J]. 传染病信息, 2021, 34(1):14. DOI: 10.3969/j.issn.1007-8134.2021.01.002.
[18] 刘东来,周海卫,王佑春,等. 新型冠状病毒核酸检测试剂的发展现状[J]. 中华实验和临床病毒学杂志,2020,34(6):582-587. DOI: 10.3760/cma.j.cn112866-20200630-00202.
[19] Reyes DR, Heeren HV, Guha S, et al. Accelerating innovation and commercialization through standardization of microfluidic-based medical devices[J]. Lab on a Chip, 2021, 21(1):9-21. DOI: 10.1039/D0LC00963F.

来源:《传染病信息》


