您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-08-11 18:00
医疗器械行业的FMEA
- 风险评估的一般要求
医疗器械安全和风险管理是欧洲医疗器械制造商法律要求的两项核心要求。
新欧盟医疗器械法规(2017/745)取代之前的欧盟医疗器械指令(93/42/EEC),对风险管理的要求进行了明确,并有进一步加严。
除了法律要求之外,还有一些规范性要求,在医疗器械的整个生命周期中采用了基于风险的方法。这些标准包括:
ISO13485: 2017
ISO14971: 2019
ISO24971: 2020
在这些标准中,对风险管理的要求也得到了加强和明确。标准的要求在很大程度上与新的法规要求—致。当然,由于标准尚未统一,仍然有部分细节方面的差异尚待讨论。
医疗器械制造商风险管理之FMEA
许多医疗设备制造商已使用FMEA 作为满足风险管理要求的工具;
然而,仔细看,就会发现FMEA 不能单独满足这些要求。
对比FMEA 中的术语“风险”和ISO 14971:2019标准中的定义的“风险”,你可以看到一些差别:

14971与FMEA关于风险定义的对比
从ISO 14971:2019标准的角度来看,其风险是关注失效/故障对医疗造成的影响,即通过估计损害的严重程度和损害的发生率来评估 (S*O)。
而从FMEA的评估方法来看,其风险更多的是关注失效本身,也即对医疗器械本身的影响;当然也通过估计失效原因的发生率和对其发生(原因或影响)的探测度,还有一个医疗器械影响的严重度(总起来就是S*O*D),参见相应的FMEA评估表。
(编者:这里对FMEA风险的认识仅仅是作者的观点;我们知道风险是评价的是对后续客户的影响,客户范围很广,包括后续相关的所有人,甚至环境)
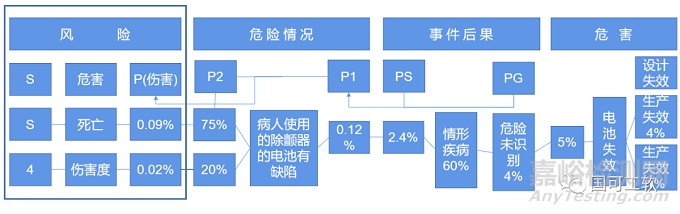
除颤器示例(注意:图表中显示的数字和矩阵中的风险接受限度是虚构的,与现实不符。
(如果 5% 内的除颤器存在这种危害,是可以接受;如果风险已尽可能降低了 = 可以不采取进一步行动)
在新的AIAG/VDA FMEA手册(2019年)中,FMEA RPN不再被视为“风险”大小的决定值,RPN(风险优先级顺序数)已被“行动优先级AP”取代。因此,未来汽车行业FMEA中风险分析决定的是行动的优先级,而不是风险。这是否意味着“FMEA”方法不能应用于风险管理?
当然不是!!!
在风险管理中结合风险分析和FMEA
风险管理流程的目标是确保医疗器械是安全的。
为了在经济上实现这一目标,公司的资源必须集中在产品中产生社会不可接受风险的那些方面。为此,必须将风险分析和FMEA联系起来。
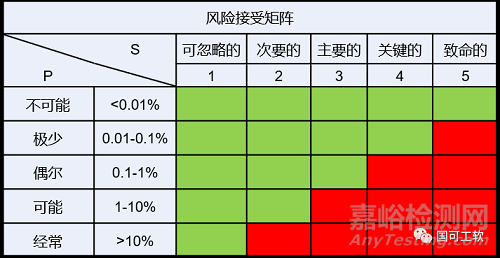
在风险分析中,基于风险接受度,可以确定哪些危害(产品中的缺陷)会导致不可接受的风险,以及这些危害可能发生到何种程度才能被接受。
我们可以使用此信息,在FMEA中确定适当的措施,以确保危害仅仅发生到一定程度,其导致的风险也在可以接受的范围内。
产品中潜在缺陷的危害必须识别,并确定可能发生的危险情况和损害情况,必须评估损害发生的频率以及其严重程度。我们已经知道,损害的发生度和严重程度的组合即风险。如果风险在可接受的范围内,并且已经“尽可能”降低了风险,则无需采取任何措施。如果有风险不在可接受的范围内,则必须确定缺陷原因?缺陷的影响?以及在医疗器械的生命周期(设计、制造和使用)中的哪个阶段?
通过对客户操作进行FMEA分析,找出缺陷的原因,基于当前措施,采取减少缺陷发生的必要措施,使由此产生的风险在可接受的范围内。
通过综合风险管理和FMEA,可以让我们特别关注于那些对医疗器械安全至关重要的措施。

来源:国可工软


