您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-08-19 23:30
摘 要 / Abstract
德国属于欧盟成员国之一,在药品监管方面具有其特殊性及先进性。本文通过检索德国的法规文件和相关数据库,概述了德国药品监管的法规体系、组织机构和职责范围。我国与德国的行政区域划分方式和药品监管模式方面有许多相似点,2018年以来国家和地方药品监督管理部门进行了新一轮的机构改革和调整。本文期望通过对德国药品监管机构及职能的介绍,为我国药品监管科学研究和监管体系改革创新提供参考。
Germany is one of the member states of the European Union and has certain particularity and advantages in drug supervision.This paper summarizes the regulatory system,organization and scope of responsibility of drug supervision in Germany by searching German regulatory documents and related databases.Since 2018,the Chinese national and provincial drug regulatory authorities have undergone a new round of institutional reform and adjustment.Because China and Germany have many similarities in terms of administrative division and drug supervision model,through introduction to the German drug regulatory authorities and functions,this paper hopes to provide insight for drug regulatory science research and the reform and innovation of the regulatory system in China.
关 键 词 / Key words
德国;药品监管;法规;机构;职能
Germany; drug supervision; regulation; organization; function
德国是联邦制国家,整个国家分为联邦、州、地区三级,共有16个州、13175个市镇,总人口数为8319万[1]。中国共包括34个行政区,省级行政区划为23个省、5个自治区、4个直辖市、2个特别行政区。中国和德国在行政区域划分和药品监管方面有很多相似点。2018年以来,国家药品监督管理局及地方药品监督管理部门在新一轮的机构改革和调整后,监管机构设置上较以往发生了较大变化。对德国药品监管系统,特别是德国药品监管机构进行研究,有助于了解中国和德国在药品监管方面的异同,从而增加对不同国家药品监管的理解,以期为我国药品监管体系研究提供参考。
01、德国药品监管的法律法规
德国药品监管的法律依据主要是欧盟药品指令、条例以及《德国药品法》(AMG)。作为欧盟成员国,德国药品监管的法律法规必须在欧盟药品监管的法律法规框架下执行,所以德国的药品监管以欧盟药品监管的法规和《欧洲药典》为主,欧盟立法高于各成员国本国药品相关法规和命令。现行版本的《德国药品法》主要是遵照欧洲议会和理事会就共同体法典中人用药品的2001/83/EC指令要求于2005年12月12日颁布的,该法共有20章,分别对药品生产、上市许可要求、注册、临床试验、药品销售、药品安全性和质量控制、兽药监管、药物警戒、监督、药品进出口、药品损害的法律责任、诉讼时效、违法惩处措施等方面进行了详细规定。《德国药品法》自颁布后先后经过了47次修订,最近一次修订日期为2019年5月6日[2]。
02、德国联邦与各州药品监管机构的职责分工
2.1 联邦药品监管机构
德国联邦一级的药品和医疗器械监管部门主要由联邦药品与医疗器械管理局(Federal Institute for Drugs and Medical Devices,BfArM)和联邦疫苗与生物医药研究所(Paul Ehrlich Institute,PEI)组成。两个部门都隶属于德国联邦卫生部(Federal Ministry of Health),但具有相对独立的地位。
联邦药品与医疗器械管理局(BfArM)的具体职责包括受理人用药品注册申请、颁发药品上市许可、开展医疗产品的安全性监测(药物警戒)、医疗器械风险评估,以及麻醉药品及其前体的监管[3]。
联邦疫苗与生物医药研究所(PEI)主要负责监管疫苗、血清、抗体、造血干细胞的制备及其他血液制品、过敏原、组织制备及用于新型疗法(基因治疗、体细胞治疗等)的产品,包括其上市许可审批、为药品研发提供科学建议、批准临床试验、实验药品检验、批签发以及药品不良反应评估[4]。
2.2 州药品监管机构
德国联邦政府和各州政府的药品监管部门对药品、医疗器械的生产和流通实行联合监管,但联邦与各州药品管理部门分工明确,各司其职。德国16个州的药品监管部门是具体执行药品监督管理活动的部门,设在各州卫生主管部门下面,不受联邦政府的直接领导,但要遵守联邦政府制定的有关法规,主要工作职责是对药品的生产和经营(包括药厂、药店等)、实验室和临床试验进行监督管理;当涉及专业性很强的技术内容时,也会聘请专家参加。有关抽查的样品则委托联邦研究所或州相关机构进行检验[5]。
03、联邦药品与医疗器械管理局的职责及组织架构
3.1 联邦药品与医疗器械管理局的
职责范围
联邦药品与医疗器械管理局是联邦卫生部下设的独立监管机构,办公地点位于波恩和科隆,约有员工1350人,包括医师、药剂师、化学家、生物学家、律师及相关行政人员等。2020年5月,德国医学文献与信息研究所(DIMDI)的关键职能部门并入联邦药品与医疗器械管理局。该机构主要关注药品和医疗器械的质量、功效和安全性,以及监管麻醉药品及其前体的合法交易[6],其具体开展的活动包括[7]以下几方面。
3.1.1 药品注册审评及许可
联邦药品与医疗器械管理局的主要任务之一是颁发药品上市许可。在许可过程中,联邦药品与医疗器械管理局审查相关材料,对申请上市药品的有效性、安全性和药品质量进行审评,以决定其是否能够上市销售。此外,还负责顺势疗法药品的审评和注册。药品上市许可证书有效期为5年,到期后需要重新申请和评价。上市后药品的任何变动都必须上报给联邦药品与医疗器械管理局,重大变更必须经批准后才能进行。
3.1.2 药品安全性监测(药物警戒)
联邦药品与医疗器械管理局对药品上市评价时未能发现的风险进行上市后监测。药物警戒部门负责收集和评估药品不良反应报告,在此基础上采取必要措施,保护患者用药安全。
3.1.3 医疗器械风险评估
针对医疗器械,联邦药品与医疗器械管理局的主要任务包括收集、分析和评估医疗器械使用中出现的风险,并基于上报的不良事件报告,协调采取必要的措施。
3.1.4 监管麻醉药品及其前体
联邦药品与医疗器械管理局下设的联邦鸦片局(Federal Opium Agency)负责向合法交易的麻醉药品及其前体发放许可,监督麻醉药品及其前体的生产、种植、销售和进出口,并与国际机构开展合作,监督麻醉品贸易。
3.2 联邦药品与医疗器械管理局的
组织架构
联邦药品与医疗器械管理局下设4个药品注册部,分别负责不同药品的上市许可审评,另外还设有研究部、科学服务部、药物警戒部、联邦鸦片局、医疗器械部、信息技术与临床试验部等业务部门。此外,还设有行政管理部、欧盟与国际事务处、研究数据中心、媒体与公共关系处、创新办公室、监察管理处、质量控制处等,负责行政管理等相关事务(图1)。
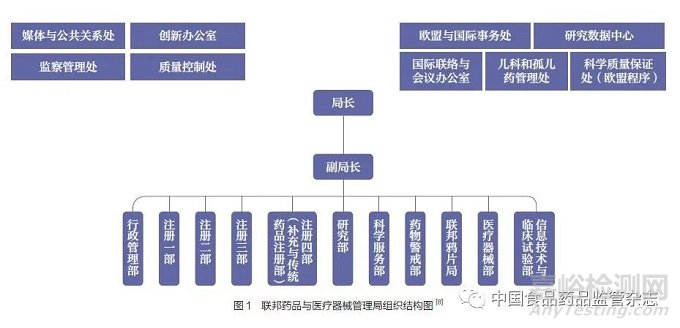
3.2.1 行政管理部
行政管理部(Administration)主要负责管理人力资源、预算管理与注册费、电子政务与文件管理、社会法律事务,以及内部服务等。
3.2.2 药品注册部
联邦药品与医疗器械管理局共有4个注册部门(Licensing),职责分工见表1。

3.2.3 研究部
研究部(Research)专注于当前重要的研究焦点,包括药物基因组学、药物流行病学、药物过敏、医疗器械安全、神经心理药理学、特殊适应症、生物统计学,涉及到药品上市许可、提高药品安全性以及医疗器械相关风险的记录和评估等各个方面。研究由不同的跨学科研究小组开展,并与德国国内、欧洲和国际领先的大学和研究机构密切合作。作为欧洲主要的药品许可机构,联邦药品与医疗器械管理局的研究致力于不断提高其科研人员的监管专业知识[9]。
3.2.4 科学服务部
科学服务部(Scientific Services)主要负责管理临床试验、科学建议、专家小组、法律事务、药典标准注册,以及支持信息技术等事务。
3.2.5 药物警戒部
药物警戒部(Pharmacovigilance)主要负责收集药品不良反应数据并建立数据库;进行风险评估,如开展药物流行病学以及进行有关药品风险方面的交流;实施药品风险管理程序,如进行上市后药品监测等。
《德国药品法》规定,对于已获上市许可并投入市场的药品,必须持续、系统地收集和评估其在使用过程中获得的信息,通过不断通报药物不良反应和相互作用,确保患者、医生和其他相关方了解并降低药物使用中存在的风险,这是药物警戒部最重要的职责。由于在药品的风险评估过程中,上市许可状态需要随科学知识的更新动态随时调整,因此,药物警戒部需协调采取必要的风险防范措施,并通知病人、医生和其他各相关方[10]。
3.2.6 联邦鸦片局
联邦鸦片局成立于1952年,替代了1912年根据《国际鸦片公约》而设立的鸦片局,其下设4个部门,由约60名科学家和公务员负责管理,主要负责颁发特殊药品的交易许可(如麻醉药品及其前体物质、精神药品等);对特殊药品的许可持有者所从事的与特殊药品有关的生产、交易、种植等过程进行监督和检查;颁发麻醉药品、精神药物及药物类易制毒化学品的进出口许可;规定特殊药品的特殊处方形式;维护特殊药品数据库;定期向国际麻醉品管理局、欧洲委员会就麻醉药品、精神药物及药物前体的使用和贸易情况进行报告并开展合作[11]。
3.2.7 医疗器械部
医疗器械部(Medical Devices)负责管理各类医疗器械的上市,收集、分析和评估医疗器械应用中的风险,并基于上报的不良事件报告,协调采取必要的措施。其下设无源医疗器械处、有源医疗器械与体外诊断处、临床试验处、数字健康应用快速通道处,以及研究、数据管理与分析处等业务处室。
04、联邦疫苗与生物医药研究所的职能及组织架构
4.1 联邦疫苗与生物医药研究所的
职责范围
联邦疫苗与生物医药研究所(PEI)是德国联邦卫生部下设的机构,办公地点位于兰根,约有900名工作人员,主要负责人用生物制品和免疫兽药产品的研究、评估和上市许可,还负责临床试验和药物警戒监管,以及开展批签发检验和检查。此外,还承担着提供国内(德国联邦和各州)和国际(世界卫生组织、欧洲药品管理局、欧洲委员会、欧洲理事会等)科学咨询等职能[12]。其监管的产品主要包括:①人用药品:血清、疫苗、血液制品、生物组织提取的制品、过敏原、先进疗法药品(基因疗法、体细胞疗法和生物技术组织产品)、异种细胞治疗药品和含有血液成份的基因制品,其他人用药品由联邦药品与医疗器械管理局负责;②兽用免疫产品,如血清、疫苗、免疫调节剂、结核菌素等[13]。
联邦疫苗与生物医药研究所的职责主要包括:①授权人用、兽用药品的临床试验;②处理根据本国及欧盟程序递交的人用、兽用药品的上市许可申请和变更申请等;③药品的官方检测和批签发;④药品安全性监测;⑤开展药品检查;⑥开展变态反应学、细菌学、生物技术、免疫学、血液学、输血医学、兽医学和病毒学领域的研究;⑦发布血液及其制品的报告;⑧为本国、欧盟和国际范围内的目标群体提供风险评估和指南开发方面的建议;⑨为上市许可和临床试验申请人提供科学和程序方面的建议;⑩为患者和消费者提供信息。
4.2 联邦疫苗与生物医药研究所的组织架构
联邦疫苗与生物医药研究所下设管理支持与语言服务处、控制与质量管理处、新闻与信息办公室、行政管理部、主要政策问题与协调部等职能部门。此外,还设有药品与医疗器械安全部、微生物学部、病毒学部、免疫学部、兽药部、变态反应部、医学生物技术部、血液学与输血制品部等业务部门负责处理具体专门事务。同时,联邦疫苗与生物医药研究所还设有体外诊断试剂(IVD)检验实验室、临时研究组等(图2)。下面主要就相关业务部门职能进行简要介绍。
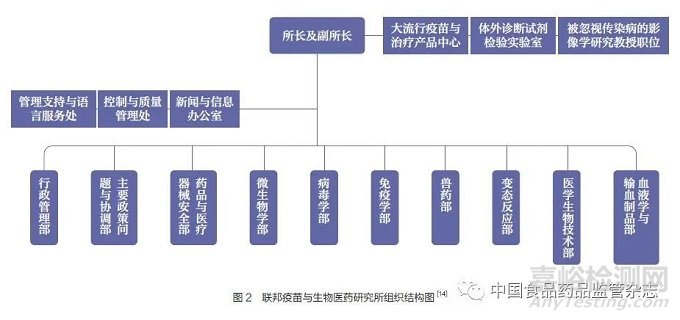
4.2.1 药品与医疗器械安全部
药品与医疗器械安全部(Safety of Medicinal Products and Medical Devices)负责联邦疫苗与生物医药研究所权限内的人用和兽用药品的药物警戒,包括药品风险识别、调查和评估,以及对生物医药产品的风险与获益进行评估,其目的是在早期阶段识别风险,以便在国家和欧盟范围内采取适当措施以减少风险。除安全性监测(药物警戒)外,该部还负责协调审批临床试验、提供法律咨询。该部门专家代表联邦疫苗与生物医药研究所参与欧洲药品管理局(EMA)、药品机构负责人联盟(Heads of Medicines Agencies,HMA)和欧盟委员会(EC)的相关委员会与工作组工作。该部门下设4个处,分别为药物警戒一处、药物警戒二处、法律事务处和临床试验处[15]。
4.2.2 微生物部
微生物部(Microbiology)主要负责微生物学、寄生虫学相关的人用疫苗及联合疫苗中的相关组分的上市许可、风险与获益评估和批签发检验,此外还负责对组织制品的微生物安全性检验,以及先进疗法药品和快速诊断方法的检测。该部门在生物统计和数学建模(如测算感染风险)方面具有丰富的专业知识,其下设的现场检查组确保了生物制品的依法依规生产、临床检验,以及监督(警戒)工作的开展。其在各个领域均有专家参与欧洲药品管理局和欧洲药品质量管理局(EDQM)的专家委员会,有效确保法规的科学有效性,并向德国和欧洲层面的申请人提供科学建议。此外,微生物部还参与设在联邦疫苗与生物医药研究所的2个世界卫生组织(WHO)合作中心(即疫苗标准化与评价合作中心和血液制品与体外诊断器械质量保证中心)的相关工作。该部门下设4个处,分别为生物医药产品检查处、微生物疫苗处、微生物安全处和生物统计处[16]。
4.2.3 病毒学部
病毒学部(Virology)的职责包括研究病毒性疾病的发病机制和预防措施、授权病毒类疫苗的上市许可和临床试验申请、开展批签发检验、评估病毒的诊断方法、评估生物制品的病毒灭活方法和病毒安全性,以及鉴定新型病毒病原体的特征。此外,该部门还负责就病毒学领域的临床试验、科学监管问题向申请者提供建议,并代表联邦疫苗与生物医药研究所参加欧洲药品管理局、欧洲药品质量管理局和世界卫生组织的相关专家委员会工作。该部门下设4个处,分别为病毒类疫苗处、艾滋病及新型病原体处、病毒安全处和分子病毒学处[17]。
4.2.4 免疫学部
免疫学部(Immunology)负责监督抗体、抗血清和治疗性疫苗(肿瘤疫苗) 从药品上市许可到批签发检测的全生命周期。其下设有研究组,负责从细胞和分子免疫生物学及免疫学层面调查生物制品的安全性。该部门的专家在欧洲药品管理局、欧洲药品质量管理局和欧盟委员会的专家委员会中发挥了重要作用。该部门下设4个处,分别为免疫生物制品检验处、单克隆抗体和多克隆抗体处、形态处和治疗性疫苗处[18]。
4.2.5 兽药部
兽药部(Veterinary Medicine)负责监管用于宠物和家畜、农场动物和鱼类的免疫兽药产品、创新产品和疗法,包括评估其安全性、提供科学建议、授权上市许可、检验、审批临床试验等,并负责开发新的防治人畜共患病或相关疾病的预防和治疗方法以及试验产品检验的创新方法。此外,该部门代表联邦疫苗与生物医药研究所参与欧洲药品管理局、药品机构负责人联盟和欧洲药品质量管理局的各委员会以及国家委员会的相关工作。该部门下设4个处,分别为兽用免疫药品评估处、兽用免疫药品检验处、兽用免疫药品安全处和动物设施处[19]。
4.2.6 变态反应部
变态反应部(Allergology)负责监管所有特异性免疫治疗和体内诊断的药品,包括评估新疗法、提供科学建议、授予上市许可、产品检验,开展产品研究、升级标准等。此外,该部门专家还代表联邦疫苗与生物医药研究所参与欧洲药品管理局、药品机构负责人联盟、欧洲药品质量管理局和世界卫生组织相关委员会和国家工作组的活动。该部门下设4个处,分别是批签发与过敏原分析处、过敏原检测与治疗处、临床变态反应处和重组过敏原疗法处[20]。
4.2.7 医学生物技术部
医学生物技术部(Medical Biotechnology)负责监管先进疗法药品,如基因疗法、体细胞疗法、组织工程产品(tissue-engineered products,TEPs)等,以及溶瘤病毒和人体组织制剂,涵盖这些产品从临床试验审批到获得上市许可的全过程。此外,该部门还为公司、研究团体、组织制品生产企业、各州监管机构和政界提供科学和监管建议。其专家参与欧洲药品管理局、欧洲药品质量管理局、世界卫生组织、欧洲基因和细胞治疗协会(European Society of Gene and Cell Therapy,ESGCT)、德国基因治疗协会(German Society of Gene Therapy,DGGT)和德国干细胞网络(German Stem Cell Network,GSCN)相关委员会和工作组的工作。医学生物技术部的研究工作主要涉及先进疗法药品安全性和有效性相关的研发和检验,协助制定先进疗法药品的监管法规,起草和评价先进疗法药品的研发和检验指导原则。该部门下设5个处,分别为先进疗法药品与组织制剂处、非病毒基因转移药品处、病毒基因转移药品处、组织工程与体细胞治疗处、非重要组织制剂与异种细胞治疗处[21]。
4.2.8 血液学与输血制品部
血液学与输血制品部(Haematology/Transfusion Medicine)的核心职能是评估血液制品,包括输血用血液成份、骨髓造血干细胞、外周血、脐带血、非操纵干细胞、人体血浆及其生物工程类似物。该部门对血液制品的完整研发周期进行监管,从早期建议、临床试验的批准,到授权上市许可及其后续程序,并为以检验为基础的研究提供技术支持,其专家在欧洲药品管理局、欧洲药品质量管理局和世界卫生组织的相关委员会中发挥着重要的作用。该部门下设4个处,分别是血凝产品一处、血凝产品二处、血液制品批签发与物流处和输血药品处[22]。
05、小 结
通过对德国药品监管机构职能的梳理,可以发现德国药品监管机构职能根据药品类型及药品使用途径进行区分,针对人用或兽用药品、化学药品或生物制品设置不同的监管机构。整体而言,德国监管机构体系庞大,联邦政府和各州政府的药品监管部门对药品、医疗器械的生产和流通实行联合监管。联邦药品监管部门主要负责受理人用药品及生物药品等的注册申请和颁发药品上市许可、开展医疗产品的安全性监测(药物警戒)等;各州政府的药品监管部门主要职责是监督药品的生产和经营,包括药厂和药店,还包括实验室和临床试验。从其职能职责看,德国联邦与各州药品监管部门分工明确,各司其职。
根据《中华人民共和国药品管理法》的规定,我国目前药品监管也是采用国务院药品监督管理部门和省、自治区、直辖市人民政府药品监督管理部门分级管理的制度,这与德国的药品监管模式非常相似,可以看出中国药品监管也与国际监管逐渐趋同的发展现状。随着《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》等的颁布实施,我国药品监管体系也在不断完善。作为国际人用药品注册技术协调会(ICH)正式成员,2021年9月国家药品监督管理局向药品检查合作计划(Pharmaceutical Inspection Co-operation Scheme,PIC/S)提交了预申请,加大了药品监管国际化的步伐。本文希望通过对德国药品监管系统与模式的研究,为我国不断推动药品监管工作的科学化、标准化和规范化进程提供借鉴,进一步服务我国药品监管水平的提高。

来源:中国食品药品监管杂志


