您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-01 10:44
近年来生物药以其高效性、高安全性、高靶向性等优势得到人们越来越多的关注,很多药企也纷纷布局,使我国生物医药得到了很快的发展。但是由于生物药结构的复杂性,我们对它的分析仍处于基础阶段,一定程度上限制了生物药的发展。基于此,我们介绍了几种以蛋白为代表的生物药分析方法。
一、液相色谱法
液相是评价蛋白质的纯度与稳定性的有力工具,常用的主要有三种,分别为反向高效液相色谱(RP-HPLC)、离子交换色谱(IEC)、分子排阻色谱(SEC)[1-3]。液相色谱法基本程序见图1。
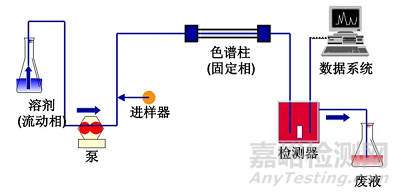
图1 液相色谱法基本程序
1.1反向高效液相(RP-HPLC)
反向高效液相是以非极性固定相与含水的极性流动相为基础的分析方法。由于有机溶剂、疏水的相互作用及分离时所用pH值较低,容易使蛋白变形。然而该方法对几种蛋白质特别有用,并广泛应用于胰岛素的质量分析。
1.2离子交换色谱(IEC)
离子交换色谱主要是用来分离离子或可离解的化合物,一般酸性物质用阴离子交换剂分离、碱性物质用阳离子交换剂分离,根据离子与交换剂结合力的强弱可将不同离子进行分离。它广泛地应用于有机和生物物质,如氨基酸、核酸、蛋白质等的分离,在生物化学领域得到了广泛的应用。
1.3分子排阻色谱(SEC)
分子排阻色谱根据分子大小对物质进行分离,常用于检测在水溶液中蛋白的聚集等物理稳定性的变化。
二、光谱法
光谱法通过对蛋白质吸收、辐射、散射光的定量分析可以提供有价值的信息,了解蛋白的含量、构象及聚集情况[3]。主要方法如下:
2.1紫外可见吸收光谱(UV)
蛋白的紫外吸收主要来源于自带有苯环共轭双键的氨基酸,如,酪氨酸(Amax=274nm)、色氨酸(Amax=280nm)、苯丙氨酸(Amax=259nm)等。常规的测定一般选取280nm这一波长,能够比较灵敏的检测蛋白浓度的相对变化。
2.2旋光色散(ORD)
旋光色散是研究光学活性材料的偏振角随波长变化的一种色散效应。它通常以氙灯光源的单色光,在200~700nm光谱区域内进行研究。常用于区分不同构象的结构。
2.3圆二色谱(CD)
圆二色光谱(简称CD)是应用最为广泛的测定蛋白质二级结构的方法[4],是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法。它可以在溶液状态下测定,较接近其生理状态。而且测定方法快速简便,对构象变化灵敏,所以它是目前研究蛋白质二级结构的主要手段之一,并已广泛应用于蛋白质的构象研究中。
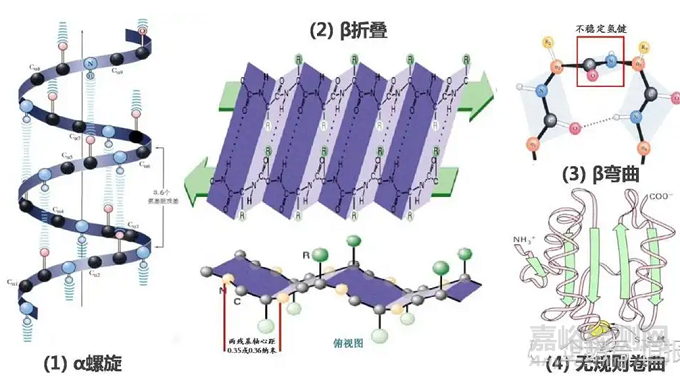
图2 蛋白4种二级结构图
例如,天然胰岛素的圆二色谱在208 nm和222 nm 处有最低椭圆率, 表示胰岛素的天然结构主要以α-螺旋存在。在胰岛素淀粉样纤维形成的过程中, 208 nm 和222 nm 处的最低椭圆率增大并逐渐消失,随后在216 nm 处出现最低椭圆率, 表明此时胰岛素的主要二级结构为β-折叠。通过该方法可以检测蛋白结构的变化,比如,金属离子在胰岛素的淀粉样纤维形成过程中, 有促进胰岛素由α-螺旋向β-折叠转化的作用。
2.4荧光光谱
荧光探针技术是研究蛋白质在水溶液中构象的一种有效方法。利用它可以测定蛋白质分子的疏水微区内两基团的距离以及酶与底物结合过程中蛋白质构象的变化等。
芳香族氨基酸,如酪氨酸、色氨酸、苯丙氨酸等具有固定的荧光特性,但是人们一般检测其中量子效率较高的色氨酸和酪氨酸的荧光信号。重要的是由于色氨酸、酪氨酸疏水,在自然蛋白结构中往往被隐匿在内核,一旦其所处的环境发生变化,接触到溶剂分子,荧光强度就会大大降低。因此,可以根据荧光光谱的变化监测到蛋白内部结构的变化。常用荧光光谱法来检测蛋白的物理稳定性,例如,硫黄素T检验、ANS荧光检验等。
2.4.1硫黄素T检测
硫黄素T (Thioflavin T) 是一种荧光染料,可以和富含β折叠的结构结合,例如α-突触核蛋白纤维原、Tau纤维原等。一旦结合,硫黄素T的发射光谱就会发生红移 ,并且荧光强度会增强,这是一个很好的用来检测纤维原形成的测试,也是将蛋白可见异物或微粒定量分析的重要手段。
原理[5]:硫黄素T能够与β折叠的结构结合,能够产生荧光,而且β折叠的结构越多,荧光强度越强,由此考察胰岛素的物理稳定性。
2.5傅里叶变换红外光谱和拉曼光谱
在制剂研究中,FTIR和拉曼光谱的谱形对蛋白结构稳定性的变化非常敏感,在蛋白变性的过程中,可以动态观察到蛋白内部α螺旋和β折叠结构的破坏以及蛋白聚集后分子间的β折叠作用等。此外,光谱分析的另一个优势是不仅可以检测蛋白分子在溶液中的结构变化,还可以用于检测固态蛋白的结构变化,对于冻干粉稳定性研究很有价值。
2.6动态和静态光散射
蛋白结构变性往往伴随着分子聚集等现象,造成分子粒径的变化,可以用光散射的方法观察分子粒径的变化监测蛋白结构的稳定性。该方法具有灵敏度高、速度快、准确、操作简单的特点。
三、电泳法
在电场的作用下,不同蛋白由于所带电荷以及分子量不同,在载体凝胶上具有特征性迁移率。在蛋白分析中最常用的是聚丙烯酰胺凝胶电泳(PAGE),包括变性电泳和不性形电泳[6]。变性电泳中蛋白需要通过十二万基硫酸钠(SDS)处理,破坏了大多数非共价键的弱相互作用,主要检测分子量及化学结构的变化等。除了常规的电泳方法,其他还有等点聚焦电泳(IEF)、毛细管电泳(CE),也常被用于蛋白和多肽样品的分析。
四、总结
以上是蛋白药物检测分析的方法,在蛋白药物的结构分析、稳定性研究中起着重要的作用。在药物研发过程中,需要研发者根据不同需求,选用合适的方法,才能达到预期效果。
参考文献:
[1] 柯林楠,宋茂谦,高敏,陆云龙,母瑞红.高效液相色谱法在贻贝黏蛋白检测中的应用[J].中国医疗器械信息,2022,28(11):21-23+33.DOI:10.15971/j.cnki.cmdi.2022.11.019.
[2] Determining Spectroscopic Quantitation Limits for Misfolded Structures[J] . Brent S. Kendrick,John P. Gabrielson,Caroline Warly Solsberg,Eugene Ma,Libo Wang.Journal of Pharmaceutical Sciences . 2020 (1).
[3] 药剂学人民卫生出版社.
[4] Co-translational assembly of protein complexes[J] . Wells Jonathan N.,Bergendahl L. Therese,Marsh Joseph A..Biochemical Society Transactions . 2015 (6).
[5] Beyond amyloid proteins: Thioflavin T in nucleic acid recognition.[J] . Verma Smita,Ravichandiran Velayutham,Ranjan Nihar.Biochimie . 2021 (prep).
[6] 赵新颖,丁晓静,陈亮.毛细管电泳技术在乳品蛋白分析中的应用[J].食品安全质量检测学报,2020,11(17):5814-5819.DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.17.003.

来源:药事纵横


