您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-13 19:16
体外诊断试剂的临床应用在于通过对患者样本的检测实现对疾病的预测、预防、诊断、治疗监测、预后观察(判断)和健康状态评价。产品检测结果的正常与否需通过其阳性判断值或参考区间进行判定,因此,阳性判断值或参考区间是产品不可或缺的属性。
阳性判断值或参考区间在临床检验活动中的作用相似,但又存在差异,阳性判断值侧重于对检查对象的某种疾病状态的判定。阳性判断值为临床上认识疾病程度及决定处理措施时的某一检验项目的分界值。它是临床医生处理患者的“阈值”,当检测结果高于或低于某个阳性判断值时,医生应结合患者临床症状做出相应的临床决策,可对疾病排除或确认,或对疾病分级,或评估预后,或提示应采取措施处理。
参考区间在我国又被称为“参考范围”“正常范围”“正常值”等,其侧重于提示检查对象是否“正常”。参考区间为某一标志物在正常(健康)人群中的测量值范围,是临床医生区别患者“正常”与“非正常”的标准,参考区间一般不同于疾病的辅助诊断。参考区间不同于阳性判断值,其建立过程依赖于参考人群,并未纳入某种特定疾病的患病人群,因此参考区间往往不针对某一种疾病。
国际上医疗器械监管机构在体外诊断试剂上市前审评过程中对产品的阳性判断值及参考区间的研究资料均有要求,国际医疗器械监管者论坛(IMDRF)发布的《医疗器械和体外诊断试剂安全和性能的基本原则》,针对体外诊断试剂明确提出了有关阳性判断值及参考区间的要求。
阳性判断值的建立
阳性判断值作为体外诊断试剂的一个重要属性,其建立过程应在完成产品前期研发且产品定型以后。任何体外诊断试剂在临床应用过程中均存在一定临床灵敏度与临床特异性,理论上不存在灵敏度与特异性均为100%的产品,因此生产企业应综合产品预期用途,在充分考虑产品临床灵敏度与临床特异性的基础上,采用合理的方法建立阳性判断值。受试者工作曲线(ROC曲线)是建立产品阳性判断值的常用方法之一。ROC曲线即以灵敏度为Y坐标,1-特异性即假阳性率为X坐标作图得到的曲线,通过ROC曲线,可观察灵敏度与特异性之间的关系。一般来说,灵敏度增高,则特异性降低,反之亦然。如研究者预期获得综合灵敏度与特异性最优的结果,则将ROC曲线上最靠近左上的一点作为产品阳性判断值,这一点对应的灵敏度与特异性即为产品的性能。
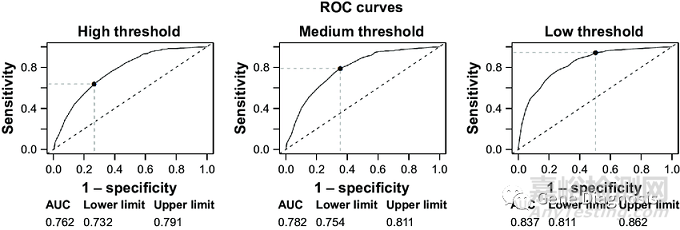
研究者通过ROC曲线进行阳性判断值研究过程中,应注意研究过程的科学严谨。
第一,研究过程中,应同时入组患病人群(疾病组)与正常人群(正常组),两组人群的病例数应满足统计学要求;
第二,在疾病组入组过程中,相应入组人群及样本类型应与产品预期用途一致,同时入组人群应考虑性别、年龄等因素;
第三,患病人群的纳入应连续,连续纳入应考虑疾病不同的进程,如:极早期、早期、中期、晚期等,保证每阶段均有一定的病例数量;
第四,研究过程中应采用疾病诊断金标准或其他公认的诊断标准
对入组的病例是否患病进行确认,必要时应对入组患者进行跟踪随访,当有些诊断标准是有创性的,如穿刺活检等,此类标准从伦理上讲不能用于正常人群未患病的确认,那么针对正常人群需进行跟踪随访以确认是否患病;
第五,某一标志物可能对应多个临床适应症,针对不同临床适应症应分别进行阳性判断值的研究;
第六,研究过程中应有相应质量控制,以保证研究结果的准确可靠。
参考区间的建立
参考区间的建立同样应在产品完成前期研发且产品定型以后。参考区间与阳性判断值不同,其为某一标志物在正常(健康)人群中的测量值范围。参考区间的建立一般需经过如下过程:参考个体的选择、参考人群的确定、参考样本组的确定、检测样本量值、统计量值分布、计算参考限值、得出参考区间。参考区间建立过程中,每一步骤的研究质量均会影响参考区间的科学性。
参考区间可能与健康或与其他生理或病理状况有关,因此,确认参考个体的健康状态非常关键。健康状态的确认可采取排除法,每一项研究均有不同的健康排除标准。一个准参考个体的健康状态需经过一系列检查才能确定,这些检查包括病历检查或现状态生理指标的临床实验检查。用于参考值研究的标准应具有详细的描述和证明,实验操作者根据此标准来判定参考样品组的健康状态。
参考群体在选择的过程中还应关注年龄、性别、种族、生理病理状态等因素,参考群体的这些特征应与产品预期使用人群的特征类似。
参考区间研究过程中应充分合理地利用统计学,应采用合理的方法明确研究过程中是否存在异常值,如存在应将异常值剔除,如剔除异常值后样本量不满足统计学要求,应补充相应样本。在统计分析过程中,研究者可根据检测结果的分布(正态分布或偏态分布)情况,选择合理的统计学方法建立参考区间。
最后,为了保证产品阳性判断值及参考区间建立的科学性,生产企业应在产品临床前研究中对建立的阳性判断值或参考区间进行验证,阳性判断值或参考区间的验证所用人群应与建立过程的人群不同。产品临床试验是产品阳性判断值及参考区间确认的重要证据。一般来说,产品的阳性判断值应在临床试验前完成建立和验证工作,在临床试验中应根据已经经过充分验证的阳性判断值进行检测结果的判读。

来源:Gene Diagnosis


