您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-08 21:06
医药行业是世界上最受管制的行业之一。从发现一种新药到注册上市和商业化,药品研发组织必须通过非常复杂和漫长的过程进行谈判。这些过程是必要的,它确保药品是安全和有效的,而且其好处远远超过其风险。今后,我们将陆续不定期推送药物从研发到上市过程的相关内容,并重点分析其中涉及到的CADD技术。
尽管人类文明对药物的试验和使用已有数百年历史,但只有在过去的一百年中,才为药物的系统研究和开发(R&D)奠定了基础。今天,来自许多领域的人员参与了药物的研发过程,包括有科学家、临床医生和医学统计学家。即使是来自看似不同职业的人,如经济学家、律师和监管人员,也发挥着至关重要的作用,在AI药物研发的浪潮兴起的今天,程序设计者也能参与到药物研发中来。此前,参与发现过程的主要科学人员一直是合成化学家。然而,随着基因组学/蛋白组学和生物技术的进步,药物的发现和开发最近取得了巨大的飞跃。这使得分子生物学家、生物化学家、微生物学家、工程师甚至计算机科学家在药物研发中的作用越来越重要。此外,实验室设备自动化和高速计算的进步也有助于分析和处理大型数据集。需要具有不同学科和专门知识的人员在细胞和分子水平上帮助特定疾病的药物研发。
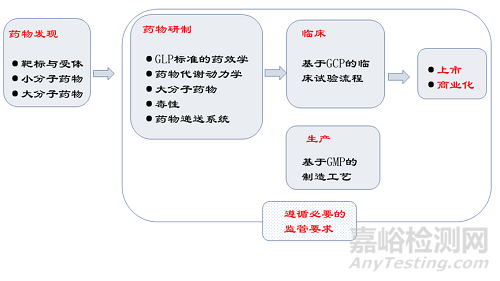
据估计,一种药物从最初研究到商业化阶段平均需要10~12年的时间。这一过程的成本在21世纪初估计超过10亿美元,而20世纪70年代为1.4亿美元。需要说明的是,这一支出并不是因为单独研发成功药物的成本;在临床试验期间,失败药物的摊销成本并没有显示出足够的风险收益。从药物的发现到上市批准,涉及以下几个阶段。
FDA对于药物的定义
官方药典或配方认可的物质
用于诊断、治疗、缓解或预防疾病的物质
用于影响身体结构或任何功能的物质(除开食物以外的)
属于药物的成分,而不是药物的载体物质
生物制品被包括在这些定义中,但其制造工艺存在差异(化学过程vs生物过程),所以被单独归类
药物发现
这个过程始于发现引起疾病的靶点,然后使用特定的检测方法筛选化学或生物化合物,并针对这些靶点进行测试,以寻找进一步开发的主要候选化合物。现在许多新的科学方法被用来确定靶标。大多数目标是受体蛋白或者酶类。当然随着研究的深入,RNA等生物大分子也被视作具有潜力的药物靶标。这些方法包括利用基因组和蛋白质组学技术、合成化学、重组DNA (rDNA)技术、实验室自动化、生物信息学、人工智能技术等。
临床前药物开发
将先导化合物在体外和体内上进行测试,以检查它们如何影响生物系统,这些试验通常被称为临床前,有时也称为非临床研究活动,包括毒理学、药效学和药代动力学,以及药物递送系统的优化。进行多次迭代,并对先导化合物进行修饰和合成,以改善其与靶点的相互作用,降低毒性或改善药代动力学性能。这一迭代过程会在优化的化合物发现结束,它成为一个潜在的药物准备在人类临床上进行试验。开发工作必须遵循良好实验室规范( GLP ),以确保建立适当的质量体系和道德考虑。
临床发展
用于销售的药物剂型的临床试验是在人类受试者身上进行的。临床试验的相关参数包括:试验方案、安全性和对受试者的尊重、研究者的责任、机构审查委员会、知情同意、试验监测和不良事件报告。这些参数构成了药物临床试验质量管理规范( GCP )。临床试验必须遵循中国国家药品监督管理局(CFDA)、美国FDA、欧盟EMA、日本PMDA或者的其他潜在国家的监管部门的法规和指南。
生产
指定用于临床试验的药物必须按照相关机构的法规或指令的现行良好生产规范(cGMP)进行生产。监管当局有权对制药工厂进行检查,以确保它们遵循cGMP准则,从而使所生产的药品安全有效。必须建立质量体系,使药品按照批准的程序生产。还必须有审计线索,即对所涉材料、工艺和人员的可追溯性,以及对原材料、中间体和成品进行适当的测试。重点是药品应该是安全、纯净、有效和质量一致的,以确保它们符合预期的功能。
上市申请和商业化
在新药的上市申请得到监管当局的审查和批准之前,不允许销售。如果需要的话,向当局提供大量的剂量和样品,以证明药物的安全性、效力、有效性和纯度。这些数据以实验室(药理学、毒理学)、临床(人体)和生产数据的形式提供,分别符合GLP、GCP和GMP要求。在药物被批准和销售后,药物的安全性和性能被持续监测,并报告和调查不良事件(副作用)。药品的广告也受到监管部门的严格审查,以确保不存在关于药品的虚假陈述或索赔。此外,药品的商业化生产必须符合GMP,生产设施定期接受监管部门的检查。对制造工艺、材料或规格的变更以及对标签的变更应向监管当局报告,在某些情况下,变更需要在实施前获得监管机构的批准。
药物研发总时间从20世纪60年代的平均8.1年增长到70年代的11.6年,80年代增长到14.2年,1990~1995年批准的药物则增长到15.3年尽管正在利用许多新方法和新技术来缩短研发时间,目前公认的药物研发时间一般是10~12年。制药公司和监管部门正在共同努力,缩短研发跨度,以控制成本,加快药品上市审批的时间框架,以满足未满足的医疗需求。通常情况下,成千上万的化合物被筛选和测试,只有少数作为药物产品进入市场。统计数字表明,在最初5000至10000种化合物中,仅5种有机会进入人类临床试验,而最终只有一个将成为批准的药物。值得一提的是,辉瑞的Paxlovid获得紧急使用授权,从分子设计到第一次临床试验仅用了12个月。

来源:药研小木子


