您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-23 22:33
多肽药物近年发展迅速,2021 年全球多肽治疗市场规模为 393 亿美元,根据Grand View Research, Inc.一项新的数据,2022到 2030 年,多肽药物(包括诊断试剂)市场将以预计6.4% 的复合年增长率增长,预计2030年将达到 687 亿美元的水准。癌症以及骨质疏松症等代谢紊乱的发病率不断上升,以及肥胖和糖尿病将都将成为推动肽疗法的因素。由于受影响的儿科患者数量不断增加,以及上述疾病在低收入国家的普遍存在,因此对高效和低成本的多肽药物的需求将会不断增加。此外,不断增长的老年人口预计也将进一步推动多肽治疗的需求。
排除成本方面的不利影响,多肽药物更为广阔的应用前景主要受到分子稳定性和递送方式的阻碍。多肽分子内在的不稳定性导致了通常通过肠胃外给药,约 75% 通过注射途径,例如皮下、静脉和肌肉给药。尽管注射剂市场强劲,但注射剂仍然对患者具有侵入性,阻碍患者依从性。此外,注射剂增加了制造和储存的复杂性,最终影响医疗成本。而以口服为代表的胃肠道给药方式,尽管有传统的cyclosproine A以及去氨加压素,以及新近的semaglutide为代表,但这个领域的应用远未形成集团规模。
一口服多肽药消化道吸收模式
多肽口服制剂的低生物利用度,主要归咎于它们在胃肠道中的酶促降解,以及很低的肠道通透性。此外,即使进入系统循环,由于它们的不稳定性也将导致被快速消除(半衰期短)。这些因素都限制了多肽在临床环境中作为治疗剂的使用。
药物从消化道上皮细胞顶端到基底面的穿越途径有多种机制。在细胞旁通路中,药物以被动方式通过细胞之间紧密连接(图 1,a),分子的尺寸与刚性都在此过程中都产生关键影响。在跨细胞途径中,药物分子可以通过被动方式穿过上皮细胞,也可以按照主动模式或者囊泡转运的方式实现(图 1,b-d)。[1]被动运输受到多肽药物分子亲脂性和刚性控制。[2]主动运输由各种类型的膜蛋白介导 的多肽内化实现,[3]在这个过程中膜转运蛋白的周转率对于多肽分子的内化至关重要。总的来说,这几个机制是通过协同作用实现多肽分子的透膜吸收的,其贡献度在很大程度上取决于多肽分子本身的化学结构,空间结构和物理性质。
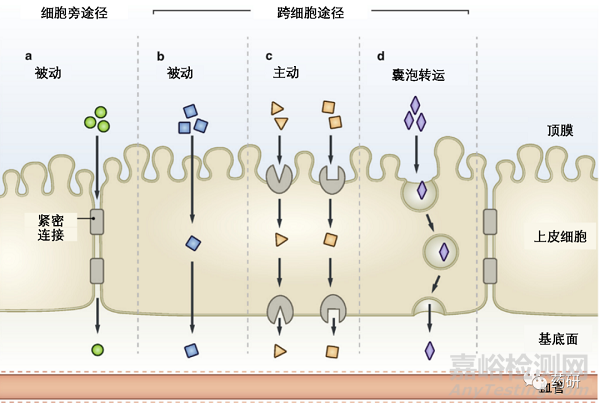
图 1. 肠道摄取化合物从上皮细胞顶膜到基底面,通过肠道刷状缘膜的方式。两个主要通路: 被动细胞旁: 在细胞之间并通过紧密连接 (a) 和通过跨细胞途径。跨细胞途径包括被动通过细胞膜扩散 (b), 主动的载体介导转运(c)和囊泡转运(d)等不同机制。(图片来源:Bioorganic & Medicinal Chemistry)
二为什么多肽N-甲基化
针对多肽分子的肽酶蛋白酶的不稳定性,以及较低的消化道膜通透率,药物分子设计人员已经开发了多种策略以应对酶促降解以及膜通透性问题,其中多肽分子的化学改性提供了一种有效的策略。 这些从化学角度(而非制剂)提高口服多肽生物利用度的方法包括多肽前药、化学修饰和结构修饰。例如聚乙二醇改性、脂化、糖基化、环化、D-氨基酸取代、非蛋白质氨基酸取代,N-甲基化。
2.1 环孢素A的启示
N-甲基化多肽在天然多肽中并不罕见,在上世纪80年代就得到FDA批准上市的第一款口服多肽药物环孢素A(CsA, cyclosporine A,商标名Neoral®)中就出现了出现了7个N-甲基化氨基酸(CsA分子11个氨基酸残基)。其中Me-Leu9 和 Me-Leu10两个相邻残基之间的酰胺键的构象在其中发挥了微妙但关键的作用(图2)。[4]这个结构特殊的肽骨架酰胺键的cis/trans构象平衡在很大程度上取决于多肽分子所处环境的极性。在极性溶剂中,或者与受体亲环蛋白(cyclophilin)结合的情况下,trans构象占主导地位。但在非极性溶剂,或者晶体形态下,采取主导的则换成了cis构象。这个N-甲基化的酰胺键对于CsA最终被开发成口服制剂起到了非常关键的作用。[5]
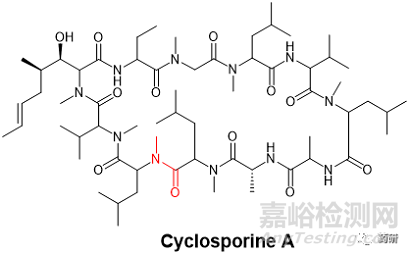
图2. CsA化学结构(红色酰胺键为N-Me-Leu9-N-Me-Leu10 主链肽键)
既然自然界给人们提供了口服多肽制剂的成功范例,研究者自然不能暴殄天物,对N-甲基化修饰多肽的潜在策略视而不见。通常来说,人们很难建立起特定的化学修饰(例如N-甲基化)与口服生物利用度之间的绝对联系,即便强行建立,这样的规律也很有可能是孤立的。作为一种二级氨基酸(secondary amino acid),N-甲基化的氨基酸对于母肽二级空间结构变化所产生的影响也是十分巨大的,这同样会带来物理化学性质以及生理活性等一系列的效应。我们都知道,Pro在多肽结构中扮演者非常重要的角色,多肽中的某个氨基酸残基如果被Pro取代,整条多肽的二级结构有可能会发生重大变化。这是因为像Pro和Sar这样的二级氨基酸会显著影响它们与其N侧氨基酸形成的肽键的cis/trans平衡,使得这个平衡偏向于不常见的cis构象。从化学热力学角度来看,trans-构象的肽键通常能量较低,因此较为稳定,绝大多数的常规肽键因此主要采取trans构象(这当然是一个统计学意义上的概念,cis-trans之间是一个不断相互转化的平衡过程)。这一点可以很容易地通过多肽在液相中的NMR谱图得以证实。当然,二级氨基酸所形成的三级酰胺键(tertiary amide)因为不再连接H原子,从而丧失了作为H-键供体的角色,这也会对多肽的结构产生重要影响。N-甲基化对于多肽空间结构的影响,它对多肽药物膜通透性的连带关系是一个非常复杂的庞大课题,以目前的技术水平尚无法取得一个服众的统一理论来建立此两者之间的模型关系,尽管N-甲基化对于多肽膜通透性可能产生作用这一结论大家都是认可的。CsA就是一个很好的例子,这种天然产物机制的复杂性是独一无二的,已成为研究多肽口服制剂生物利用度的主要模型之一。然而,微妙的构象转化很难复制在其它的合成多肽类似物中,从这个角度上看,CsA仍然像个曲高和寡的孤例,尽管令人高山仰止,但仰之弥高,钻之弥坚,瞻之在前,忽焉在后。目前人们很难复制它的高生物利用度机制。能够明确的是,CsA分子中广泛存在的N-甲基氨基酸,以及其所导致的H-键供体缺失,缺少能够溶剂化的酰胺键H,亲脂性的侧链,以及结构单元(一个βII'转角和一个βVI转角)都对CsA这个几乎违犯了所有利平斯基规则的多肽分子可观口服生物利用度(F=15-50%)做出了贡献。除了N-甲基化影响多肽结构并扰动膜通透率之外,其它的化学修饰也可能产生类似的效果,比如环化、D-氨基酸,以及Cα-甲基化等。
2.2 N-甲基化溶剂化氨基酸导致增强的被动扩散
多肽分子中溶剂化的酰胺键一旦被甲基化,它们与溶剂之间的H-键联系有可能因此而被切断,从而实现多肽分子亲脂性的增加,并促进以被动扩散的方式实现膜透过。当然这种关系也并非绝对,也存在因为溶剂化的肽键在N-甲基化之后膜透过率降低的情况,这可能与多肽的结构以及修饰部位有关。[6]这方面最好的例子来自于三 N-甲基化Veber-Hirschmann的开发。
Veber-Hirschmann 肽 c(PFwKTF),是一种环化的生长抑素,是天然多肽荷尔蒙生长抑素的类似物,对 sst2 和 sst5 生长抑素受体有选择性。为了实现其口服递送,研究者合成了30种不同位置不同程度的N-甲基化VH肽类似物(五-甲基化类似物无法通过化学合成手段实现),其中只有8个类似物有生长抑素受体活性,[7]而其中又只有一种(图3)表现出Caco-2细胞膜的通透性(相对于未甲基化的VH母肽增加了68%),这个三-N-甲基VH肽实现了F=10%的大鼠口服生物利用度,而VH母肽与其它N-甲基VH肽类似物则几乎完全没有口服生物利用度。分子结构对比发现,具有口服生物利用度的三-N-甲基VH肽与VH母肽相同,而且所有溶剂化的酰胺键都被N-甲基化。然而三-N-甲基VH肽对各种肽酶的稳定性却远高于VH母肽。研究同时发现,三-N-甲基VH肽中的L-MePhe11一旦被其对映异构体D-Me-Phe替换,不仅多肽的生物活性完全丧失,就连Caco-2细胞膜的通透性也显著降低。这个残基替换导致了D-MePhe11和Pro6之间的肽键采取cis为主的构象,并产生βII'转角,而不是原来的βVI转角二级结构。7 VH肽改性的例子强烈地透露出了这样的信息,即N-甲基化并不能确保口服生物利用度的提高,多肽的空间结构才是最终决定这项数据的关键,N-甲基化需要满足优势的空间构型,在这个基础上才可能实现生物利用度的目标。

图3. Veber-Hirschmann肽(左)和三-N-甲基Veber-Hirschmann肽(右)化学结构
三总结
在目前已经在北美,日本和西欧上市的150多种多肽药物中,含有N-甲基氨基酸的种类并不多,例如abarelix中含有N-MeTyr, Cyclosporine和Dactinomycin中含有Sar和N-MeVal。然而随着人们开发口服多肽治疗剂的热情不断高涨,以N-甲基化为代表的化学修饰可能在多肽药物分子设计中将扮演越来越重要的角色,它们在增加多肽稳定性以及膜通透性方面有着非常大的利用空间。与此同时,多肽化学与空间结构关联的不断深入研究,也能促进研究者通过化学修饰来改善并控制多肽二级结构的目标,系统性的N-甲基化scan也同样能起到关键的作用。这个领域的进步,或许能够帮助研究者从传统的试差法,逐渐转向有的放矢的的N-甲基化“工程”,推动更合理的多肽药物从头设计,结合药物递送领域的协同进步,催生口服多肽制剂浪潮的真正到来。

来源:药研


