您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-30 00:12
摘 要 Abstract
目的:通过对国内外已上市连续制造口服固体制剂药学审评内容的研究,为开展我国连续制造口服固体制剂的药学审评工作、制定连续制造相关的指导原则或标准、推进ICH《Q13 :原料药和制剂的连续制造》指导原则在我国的实施与转化提供科学理论借鉴。方法:在国家药品监督管理局、美国食品药品监督管理局、欧洲药品管理局、日本药品及医疗器械综合机构和英国药品和健康产品管理局的网站,查询以连续制造生产模式获批的口服固体制剂审评报告,从中提取与连续制造生产模式相关的药学审评内容,通过对比分析等研究方法,阐述各国药品监管机构对连续制造口服固体制剂的药学审评关注点,并形成我国药品审评机构未来对此类药品的药学审评启示。结果与结论:连续制造口服固体制剂的药学审评工作应针对原料药和辅料、制剂研发、生产工艺和工艺控制、批次描述、工艺验证、产品放行、稳定性考察、现场检查、上市后变更等方面进行重点审评。此外,在制定连续制造生产模式相关的指导原则和标准时也应将其考虑在内,以监管促发展,不断推进我国口服固体制剂的连续制造研发新局面。
Objective: Through the research on the pharmaceutical evaluation content of marketed continuous manufacturing oral solid preparations in China and abroad, this study aims to provide a scientific and theoretical reference for carrying out the pharmaceutical evaluation of continuous manufacturing oral solid preparations in China, formulating guidelines or standards related to continuous manufacturing, and promoting the implementation and transformation of ICH “Q13: continuous manufacturing for drug substances and drug products” guideline in China. Methods: On the websites of National Medical Products Administration, U.S. Food and Drug Administration, European Medicines Agency, Pharmaceuticals and Medical Devices Agency, Medicines and Healthcare products Regulatory Agency, the evaluation reports of marketed continuous manufacturing oral solid preparations were searched, and the pharmaceutical evaluation content related to the continuous manufacturing production mode were extracted. By comparative analysis and other research methods, the concerns of each national medicines regulatory agency on the pharmaceutical evaluation of continuous manufacturing oral solid preparations were elaborated, providing useful experience of pharmaceutical evaluation of such medicines for China’s regulatory agency in the future. Results and Conclusion: The pharmaceutical evaluation of continuous manufacturing oral solid preparations should focus on the aspects of active pharmaceutical ingredients and excipients, preparation research and development, production process and process control, batch description, process validation, product release, stability investigation, on-site inspection, post-approval changes, etc. In addition, it should also be taken into account when formulating the guidelines and standards related to continuous manufacturing production mode, so as to lead its development through supervision, and continuously promote the new situation of research and development of continuous manufacturing oral solid preparations in China.
关键词Key words
连续制造;口服固体制剂;药学审评;研究与启示
continuous manufacturing; oral solid preparations; pharmaceutical evaluation;research and insight
基金项目
国家重点研发计划(2021YFB3201202);山东省重点研发计划(重大科技创新工程)项目(2021CXGC010507);2021 年中国药品监督管理研究会课题:缓控释药品监管科学研究
1 前言
在全球制药技术革新和先进制造迅速发展的时代背景下, 连续制造(continuous manufacturing,CM) 作为一种先进的生产模式,可为社会、患者和医药企业带来显著的效益。原料药或辅料在工艺起点被连续地送入工艺序列中,在生产过程中发生持续转化,同时产品在终点被持续输出。连续制造生产模式具备以下几大优势:①生产步骤连续无间歇,消除了传统批量生产模式中步骤间的停顿,提高了生产效率。②实现了产品质量的实时过程监控,减少了人为判断错误的机会,改善了药品质量。③生产设备占地面积小,可使用现有的连续制造生产设备快速研发新的工艺过程,降低生产和维护成本,具备生产灵活性和敏捷性。④ 端到端的连续制造生产模式可以显著加速供应链的运行, 并降低存储和中间运输成本。⑤实现个性化制造,如3D打印技术。⑥减少了对环境的影响,体现了以绿色制造推动工业高质量发展的理念[1]。
笔者通过查询国家药品监督管理局(National Medical Products Administration ,NMPA)、欧洲药品管理局( European Medicines Agency,EMA)、美国食品药品监督管理局(Food and Drug Administration,FDA)、日本药品及医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA)、英国药品和健康产品管理局(Medicines and Healthcare products Regulatory Agency,MHRA)的网站,截至2022 年7 月,共有10 种采用连续制造生产模式的口服固体制剂在这些机构获得上市许可,其中7 种口服固体制剂得到了多个药品监管机构的上市许可[2-24]。具体信息见表1。FDA 批准的口服固体制剂数目最多(8 个),其次是EMA(7个)、PMDA(4 个)、NMPA(2个) 和MHRA(1 个)。FDA 对连续制造口服固体制剂的药学审评工作主要由药物物质、药物产品、过程、新兴技术、设备、过程分析技术(process analyticaltechnology,PAT)、生物药剂学、应用技术、环境等审评小组共同完成,为了大力推进连续制造生产模式,FDA 还创建了新兴技术计划,连续制造药品申请人可通过此计划,加快此类药品的获批上市。EMA 成立了过程分析技术团队和创新工作组,协助并参与人用药品委员会的审评工作。PMDA 成立了先进制造技术工作组,协助药品审评委员会进行审评工作。对于第一个以连续制造生产模式获批上市的口服固体制剂Orkambi®, 还被EMA 和FDA 列为质量源于设计(quality by design,QbD) 合作试点,通过审评意见征求、审评过程中质量信息和决策信息共享,共同完成了对该制剂的审评工作[25]。
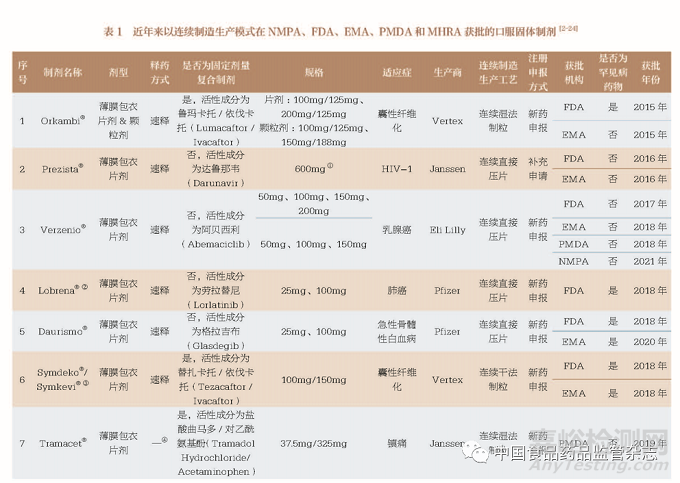
在我国,国际人用药品注册技术协调会(ICH)工作办公室也针对连续制造生产模式成立了专家工作组,在充分讨论了ICH《Q13:原料药和制剂的连续制造》(Q13: Continuous Manufacturing for Drug Substances and Drug Products) 指导原则在我国实施的可行性基础上, 已完成了众多的实施转化工作。2021 年10 月,国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)发布了《关于公开征求ICH 指导原则〈Q13:原料药和制剂的连续制造〉意见的通知》[26]。目前, 已有2 种口服固体制剂(Verzenio® 和Cibinqo®) 分别在2021 年和2022 年以连续制造生产模式在我国得到获批,但是暂无申请上市技术审评报告可循。国内已有众多医药企业着手连续制造生产模式的研发工作,相关审评工作还处于摸索阶段。因此,充分借鉴和学习国外连续制造药品的审评思路,提前明确我国连续制造药品的审评审批工作重点,制定相关法规、技术指南或标准,优化审评审批制度,对提高我国药品研发创新能力具有重要意义。
在查询各国连续制造口服固体制剂的审评报告过程中,笔者发现国外药品审评机构对连续制造生产模式存在保密机制, FDA和PMDA 审评报告中有众多覆盖信息的情况,无法获得完整的药学审评内容,这也说明了连续制造是欧美日等发达国家或地区高度重视的先进生产模式,我国更应通过监管努力,鼓励相关从业人员破解技术封锁,攻克关键技术难题,做好连续制造药品的研发,使中国的制药工业不受国外技术限制。
2 国内外已上市的连续制造口服固体制剂的概况
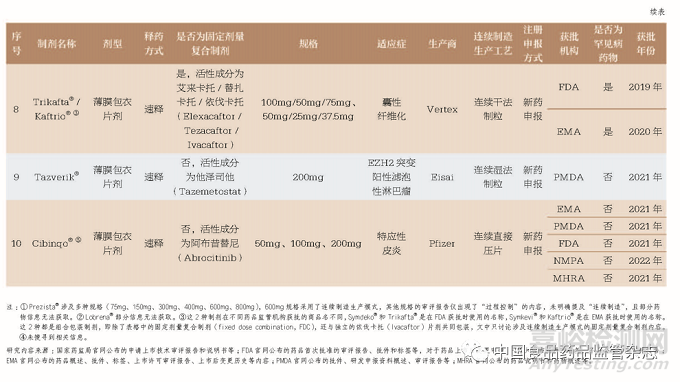
国内外已上市的连续制造口服固体制剂的生产商和生产工艺等情况见图1。10 种口服固体制剂的剂型均为薄膜包衣片剂,Orkambi®还有颗粒剂型被FDA和EMA 获批上市。Janssen 公司表示Prezista®连续制造生产线可减少制造和检验周期,生产空间明显减小,在降低生产过程风险的同时还能保证现有产品的质量[27]。表1 涉及的所有药品批件中有36.4% 以罕见病药物获批,研发成本远高于其他普通口服固体制剂,也采用连续制造生产模式,更加说明连续制造生产模式存在巨大优势,即采用连续制造生产模式的累积效应可以减少或缓解药品短缺,增加患者的药品可及性,提高医药企业生产效率和经济效益。
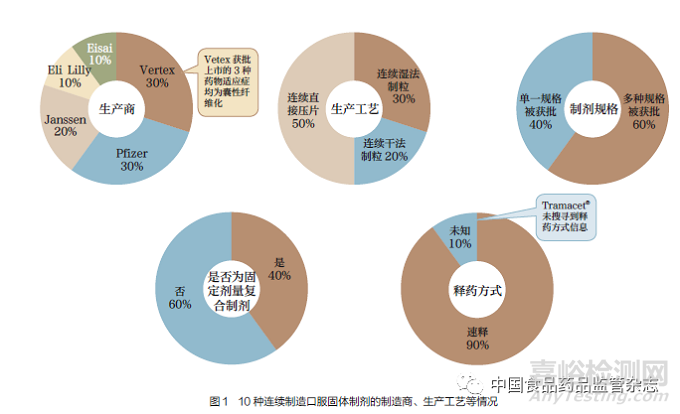
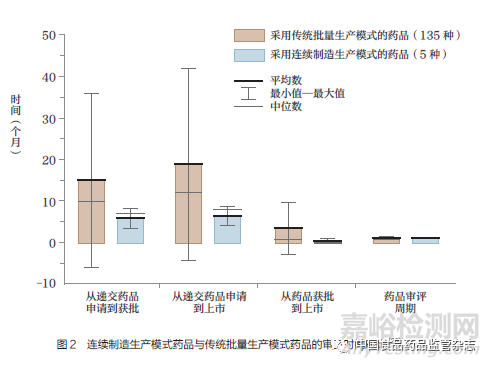
此外,FDA 近期也回顾了连续制造药品的申报情况,相比传统批量生产模式的药品,连续制造生产模式能获得更快的批准(图2)和更高的收入(图3)。从产品申请到获批平均快9 个月(中位数为3 个月),从产品提交监管机构到进入市场平均快12 个月( 中位数为4 个月),从产品获批到进入市场平均快3 个月(中位数为1 个月)。2020 年,连续制造药品的平均月收入为4290 万美元,销售连续制造药品的公司预计实现了1.71 亿~5.37 亿美元的早期收入收益。与传统批量生产模式的药品申请相比,回顾结果并未表明连续制造药品申请的监管提交或结果的风险更高,而对于与生产工艺变更或批准前检查相关的申请内容,也没有发现实质性的监管障碍[28]。Schaber等[29] 对比了连续制造生产模式与传统批量生产模式的经济性问题,发现连续制造生产模式的资本支出会降低20%~76%。

具备如此众多优势的连续制造生产模式,是推动我国医药产业技术变革和优化升级的重要着力点,我国药品监管机构可从以下4 个方面重点推进其研发和应用,加快我国由制药大国向制药强国的转变:①鼓励新药研发企业基于口服固体制剂品种特点,对于速释型薄膜包衣片剂或颗粒剂,可优先考虑采用连续制造生产模式,且同一药品不同规格可采用相近的连续制造研发策略,进而降低生产成本,提高临床新药的可及性。②鼓励国内仿制药企业,针对临床应用较广、产量需求较大的仿制药品种,进行连续制造生产模式研发,通过上市后变更提高生产效率,满足临床的用药需求。③对于连续制造药品的审评工作,除了制定相关的法规、技术指南和标准,还应鼓励医药企业就连续制造生产模式研发的合规性,尽早地多次与监管机构沟通交流,使其满足我国《药品生产质量管理规范》(Good Manufacturing Practice,GMP)的要求。④在对ICH Q13 指导原则转化实施的过程中,鼓励国外以连续制造获批的药品在我国注册上市,以“引进”促“自研”,形成内外循环合力,这些“引进”的连续制造药品也可通过ICH 与其他国家或地区的监管机构建立共同审评机制。
3 国内外连续制造口服固体制剂的药学审评内容分析与启示
10 种连续制造口服固体制剂中9 种是以新药申报上市,剩下的Prezista®是以补充申请由传统批量生产模式变更为连续制造生产模式。对于我国连续制造口服固体制剂上市申请来说,主要可分为2 种情况:① 已上市口服固体制剂由传统批量生产模式变更为连续制造生产模式。②未上市口服固体制剂采用连续制造生产模式申报上市。因此,笔者通过对国内外连续制造口服固体制剂药学审评内容的研究, 针对上述2 种情况形成药学审评启示。
3.1 原料药和辅料
10 种连续制造口服固体制剂所用原料药和辅料见表2。通过分析可发现67% 的原料药具有非吸湿性的特点, 而微吸湿性和吸湿性原料药仅占其中的25% 和8%。推测连续制造口服固体制剂多采用非吸湿性原料药的原因, 应是微吸湿性和吸湿性原料药在储存和生产过程中会吸收水分子导致自身水解,且加工前还需进行复杂的干燥步骤,非吸湿性原料药则能避免这些缺点, 具有较强的稳定性。在Symdeko®、Symkevi®、Orkambi®、Trikafta®、Kaftrio®原料药的生产过程中,还基于研发研究建立了生产过程控制策略,同时,由于这些药品的原料药在水中溶解度较差,生产商通过研发喷雾干燥分散体(spray dried dispersion,SDD), 即将溶解度较差的原料药完全溶解在喷雾干燥溶剂系统中,在与其他原料药或辅料化学与物理兼容性良好的前提下,以其无定形的中间体用于口服固体制剂的生产,以达到减小颗粒尺寸提高制剂生物利用度的目的。此外, 因替扎卡托和依伐卡托被Vertex 公司在多个规格多个口服固体制剂中使用, 因此在后续制剂的审评中,FDA 提到无需对其进行详细审查,可依靠已建立和批准的化学成分生产和控制(chemistry manufacturing and controls,CMC)信息来支持后续制剂的原料药药学审评。
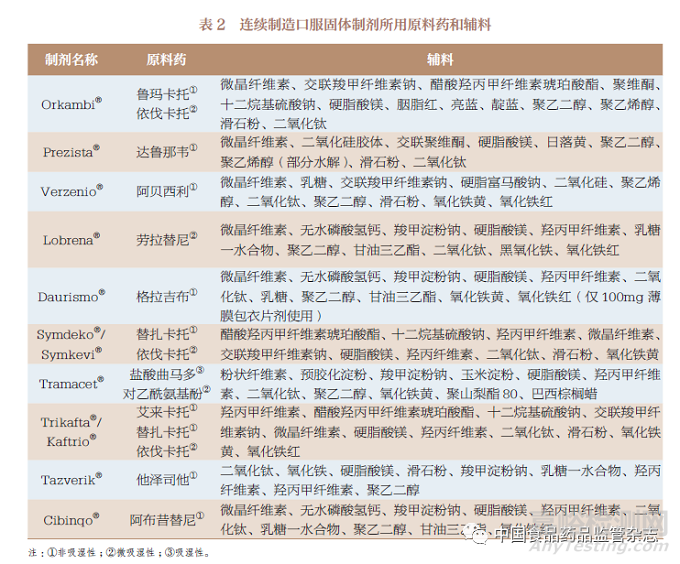
表2 中的辅料主要包括片芯和薄膜包衣辅料,其中大部分为各国药典中常用辅料,仅有不到5% 为新型辅料。对各个辅料在10 种连续制造口服固体制剂的使用次数进行排序(图4),次数靠前的分别为:二氧化钛、硬脂酸镁、微晶纤维素、聚乙二醇、羟丙甲纤维素、滑石粉、乳糖、氧化铁黄、氧化铁红和羧甲淀粉钠等。

原料药和辅料是决定药品质量的关键因素,也是连续制造发展的先决条件。目前,我国口服固体制剂的药学审评工作多关注原料药和辅料的来源、相关证明文件、执行标准及检验报告。对于我国2 种连续制造口服固体制剂上市申请,笔者认为原料药除了关注非吸湿性特点、水中溶解度较差的原料药可研发喷雾干燥分散体、推荐《中国药典》常用辅料,还应基于原料药和辅料的性质,对其进行除《中国药典》要求以外的物理属性评价,如原料药和辅料的分散性,因为口服固体制剂颗粒粒径分布、形状、密度、内聚力等可能会影响连续制造生产时的流动性并形成物料分层。而对于原料药和辅料本身,可鼓励使用连续制造生产模式中必备的快速分析工具(过程分析技术),对其进行输入物料属性控制和过程控制,从生产源头和生产过程保证最终制剂的安全性和有效性。此外,在10 种连续制造口服固体制剂的研发过程中,国外制药企业已基于连续制造生产模式对原料药和辅料展开研究,间接地也为我国连续制造口服固体制剂的原料药和辅料的使用提供了参考。CDE 可基于相关课题研究,在评估物料属性对物料流动、工艺动态和最终产品质量的潜在影响基础上,制定《连续制造口服固体制剂研发优先使用的原料药和辅料推荐名单》,表2 中的原料药和图4 排序前10 位的辅料可被纳入名单考虑范围内。
3.2 制剂研发
10 种连续制造口服固体制剂的研发都是按照ICH《Q8(R2):药品研发》[Q8(R2):Pharmaceutical Development] 指导原则的QbD 理念进行的,即质量不是通过检验注入产品中,而是通过设计赋予的。与传统批量生产模式口服固体制剂不同的是,连续制造口服固体制剂的研发必须增加对产品、工艺和过程的理解,并对生产进行全过程的控制和持续改进,具体内容如下。
3.2.1 定义目标产品质量概况(quality target product profile,QTPP)
确定目标产品的用途和预定义产品质量,连续制造口服固体制剂QTPP 普遍包括性状、鉴别、含量均匀性、有关物质、溶出度等。
3.2.2 概括连续制造生产工艺
主要涉及进料、混合、制粒、干燥、研磨、压片、包衣等。
3.2.3 理解连续制造工艺知识
基于原料药和辅料属性、操作单元、设备能力、规模放大等信息, 通过初始风险评估确定连续制造产品的关键质量属性(critical quality attributes,CQAs)、关键工艺参数(critical process parameters,CPPs)或理想生产范围等。
3.2.4 开展连续制造工艺研发
可借助多变量实验设计(design of experiments,DOE)、风险分析、生产和控制经验知识等, 对关键工艺参数的正常操作范围进行深入研究,开展连续制造工艺研发。此外,需要关注到, 在EMA 获批的Daurismo®借助风险评估指导了停留时间分布(residence time distribution,RTD)的研究;在EMA 获批的Kaftrio®进行了连续制造生产系统的设计空间范围研究,可以在批准后进行某些工艺更改(如运行时间、过程参数)以调整输出,而无需在批准后进行补充申请的材料递交。
3.2.5 确定连续制造生产过程
基于QbD 或商业规模批次的研究数据,总结原料药和辅料属性、连续制造生产工艺的研究结果、保证制剂质量的多维空间等内容,并确定影响制剂关键质量属性的因素,确保所有关键质量属性都在可接受范围内。
3.2.6 确定连续制造生产控制策略
保证中间控制(in processcontrol,IPC)参数、关键关键工艺参数、关键质量属性等都在一个可接受的范围内上下波动。此外,对于生产期间发生的瞬态事件,如计划内的工艺启动、关闭和暂停或计划外的扰动,也都应有相应的过程分析技术对其进行实时检测,且过程分析技术的测量频率足以检测扰动,能通知工艺调整并确保根据预定标准及时分流物料。例如,在EMA 获批的Symkevi® 和Orkambi®通过过程分析技术监测连续制造口服固体制剂的生产过程,减轻了扰动对最终制剂质量的影响。
3.2.7 持续改进连续制造产品质量
基于对产品和工艺知识的理解、质量风险管理(如原辅料属性、因清洁不当造成的交叉污染)等,对生命周期管理提出意见并改进,保证产品质量持续稳定和均一。例如,在EMA 获批的Verzenio®和Kaftrio®则运用ICH《Q12 :药品生命周期管理的技术和监管考虑》(Q12 :Techinical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management) 指导原则中的批准后变更管理方案(post-approval change management protocol,PACMP),完成了生产场所等的变更和技术转移,同时基于临床数据获得更高水平的工艺理解和验证。
对于我国连续制造口服固体制剂研发的药学审评,应重点关注对制剂的产品理解、工艺与过程理解和过程控制策略制定,因此与其相关的工艺研发、产品设计、装备改造、过程控制内容应在申报资料中被充分阐述。对于未上市口服固体制剂采用连续制造生产模式申报上市的情况,可基于上文总结的7 部分进行相应的审查,确保申请人已经完成了充分的研究。对于已上市口服固体制剂由传统批量生产模式变更为连续制造生产模式的情况,因过去已有相关的研发经验,因此可以在对过往注册申报材料审查的基础上,重点关注生产工艺的改进和优化工作,如描述工艺研究的主要变更(批量定义、连续制造设备、过程分析技术监测点和分析模型、关键工艺参数等),建立覆盖整个制剂生命周期的质量管理体系。
3.3 生产工艺与工艺控制
在EMA 获批制剂的审评报告中,出现了“全部生产环节连续的生产模式”和“部分生产环节连续的生产模式”的概念,具体生产工艺见图5。采用全部生产环节连续的生产模式的制剂有Orkambi®、Tramacet®、Symkevi ®、Prezista®,其中Orkambi®既有全部生产环节连续的生产模式,又有部分生产环节连续的生产模式。对于部分生产环节连续的生产模式,连续制造生产环节情况如下:①从预混到压片环节。②从进料到压片环节。③从进料到包衣环节。④从制粒到研磨环节。⑤从制粒到干燥环节。⑥从制粒到压片环节。⑦从进料到包装环节。此外, 在EMA 获批的Daurismo®和Cibinqo®均采用了辉瑞公司研发的便携式、连续式、微型和模块化连续制造系统,该系统主要执行成品制造、质量控制测试、初级和次级包装以及批次放行等功能。
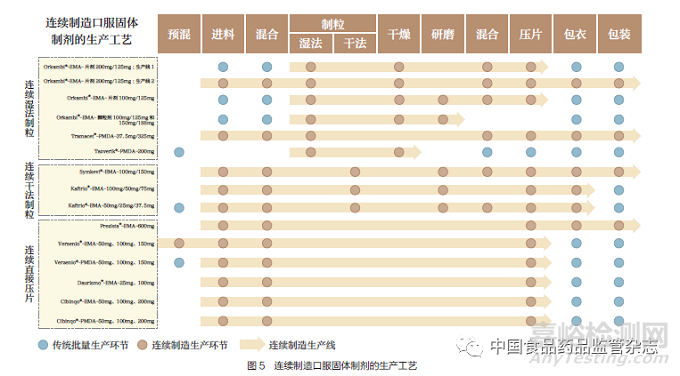
10 种连续制造口服固体制剂工艺控制策略主要包括对原辅料的属性判断与控制、单元操作控制和集成操作控制、工艺设计空间参数监控、以过程分析技术为主要方法的过程控制。这些控制策略涉及每种物料、工艺步骤和连续制造设备,能够实时处理扰动或发出异常警报。其中以过程分析技术为主要方法的过程控制是连续制造生产模式区别于传统批量生产模式的地方,过程分析技术是指对制剂生产过程中关键质量属性或影响关键质量属性的物料参数进行检测,该技术既可以分析出因生产工艺引起的质量波动,随时保证工艺性能和产品质量,又可以利用其变异性分析生产工艺在设计空间运行的能力,为检测抽样计划和频率提供依据,因此被大多连续制造口服固体制剂采用。
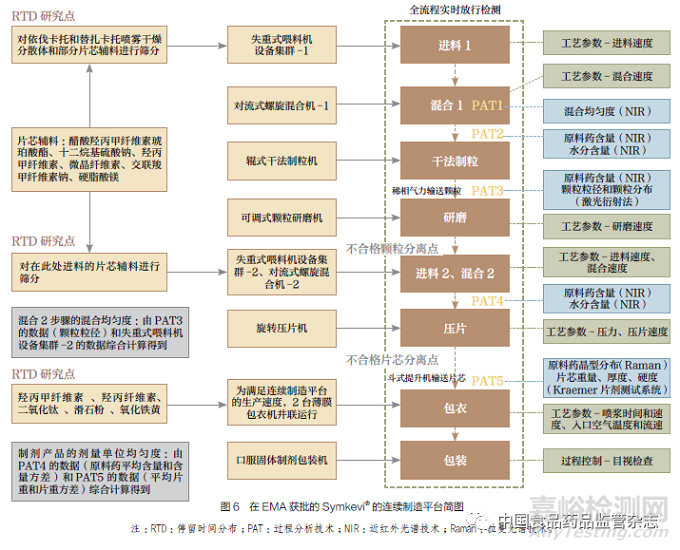
以在EMA 获批的Symkevi®为例,绘制了该制剂的连续制造平台简图(图6),主要包括原辅料、工艺设备、工艺流程、5 个过程分析技术监测点、工艺参数、2个不合格颗粒/ 片芯分离点、3 个停留时间分布研究点、全流程实时放行检测(real time release testing,RTRT)等。连续制造平台控制系统可显示正在运行的单元操作、过程控制和关键工艺参数的信息,实时监控工艺参数和设计空间范围,并在出现偏差时发出警报。针对整个连续制造控制平台,还考察了启动、关闭、过程暂停前后对产品质量的影响,并获得了目标产品质量的波动范围。其停留时间分布研究是通过产品关键要素(product key,PK)对喷雾干燥分散体、辅料、包衣悬浮液进行跟踪研究,产品关键要素是可以被分离剔除的颗粒或片芯的最小不合格单位,随后基于停留时间分布研究结果和工艺设备进行综合考虑来设计分离点和分离方法。该制剂也基于全流程RTRT 制定了应急策略,用以规定RTRT 设备发生故障时临时使用的替代测试或监测方法。
此外,对于工艺控制相关的模型审评,主要重点关注以下3类:①过程分析技术模型。②停留时间分布研究模型。③综合控制模型,如传感器控制模型等。以过程分析技术的模型审评为例,表3 整理了3 种类型的过程分析技术,其中光谱技术模型在连续制造生产模式中的研究和应用最为广泛。基于图5 的梳理,10 种连续制造口服固体制剂存在部分相同的工艺环节,故图7 对关键生产环节的生产设备和过程分析技术监测点进行总结,可见原料药含量是过程分析技术监测的重点,而近红外光谱技术多次被应用于原料药含量、混合均匀度等的分析。FDA 和EMA 要求近红外光谱模型的研发应当遵循基于科学和风险的原则,包括风险评估和实验设计研究,以确定哪些变量可能会影响近红外光谱模型的建立。注册申报时需提供近红外光谱仪、软件、光纤探头等信息;近红外光谱化学计量学模型的研发需根据FDA 的《化学药品与生物制品的分析程序与方法验证》(Analytical Procedures and Methods Validation for Drugs and Biologics)或EMA 的《制药工业近红外光谱技术应用、申报和变更资料要求指南》(Guideline on the Use of Near Infrared Spectroscopy by the Pharmaceutical Industry and the Data Requirements for New Submissions and Variations),充分描述分析流程和验收标准等,确保该模型的专属性和稳健性。此外,还需参考ICH Q12 指导原则提出生命周期管理的模型维护程序。

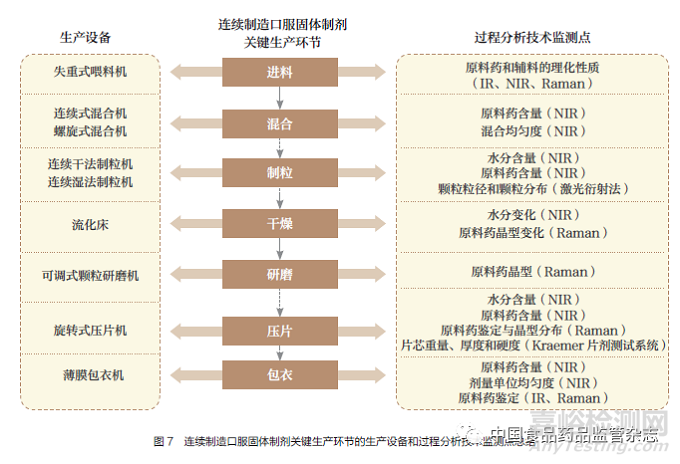
对于我国的2 种连续制造口服固体制剂上市申请,图5 的连续湿法制粒、连续干法制粒、连续直接压片都是可以接受的连续制造生产模式,其中,连续直接压片更值得推荐,这与其工艺流程短、易控制的特点密不可分。图5 中出现的全部生产环节连续的生产模式和部分生产环节连续的生产模式,更是说明不包含制剂全部生产环节的连续制造生产线也是可以被审评机构所接受的。因此,我国药品监管机构在连续制造相关指导原则或标准的制定上,可鼓励医药企业基于现有的生产设备和生产条件,确定是否研发全部生产环节连续的生产模式,无条件研发的企业,可从部分生产环节连续的生产模式入手,先实现涵盖2~5 个生产环节的连续制造生产线的研发或改造,阶段性地向全部生产环节连续的生产模式靠拢。工艺控制方面,除了与连续制造相关的工艺流程图、工艺描述、主要生产设备、商业生产规模与依据,审评方面还应当重点审评连续制造生产模式所特有的控制策略,如以过程分析技术为主要方法的过程控制,审查申请人是否针对制剂生产形成了“物质基础正确、过程控制准确、体系设计科学”的连续制造控制策略,图6 的连续制造平台和图7 总结的过程分析技术监测点都是药学审评过程中可借鉴的工艺控制案例。而对于过程分析技术本身,如近红外光谱技术,应重点评估是否对分析程序和方法验证等进行了充分的研究和描述,并形成相关的验收标准。
3.4 批次描述
在10 种连续制造口服固体制剂的药学审评报告中,均定义了预期的商业规模批量大小。但对批次的具体描述内容较少,只有在EMA 获批的Daurismo®和Cibinqo®、在PMDA 获批的Tazverik® 提到批量大小取决于生产预定数量片芯所需的原料药质量,在FDA 获批的Verzenio®定义“批量”概念时考虑了所采用的原料药的质量和连续制造质量流量,如其他参数不变,可通过延长生产时间增加批量。在EMA 获批的Kaftrio® 还提到批量大小的具体数值(60kg)。
生产批次的正确划分是确保制剂受控、可追溯的必要条件,也是申请人能够开展质量管理和生产管理的前提要求。我国《药品生产质量管理规范》(2010 年版) 在借鉴EMA 的GMP 时,也在术语中保留了EMA 对连续制造药品的一些特殊考虑,如第三百一十二条:“在连续生产情况下,批必须与生产中具有预期均一特性的确定数量的产品相对应,批量可以是固定数量或固定时间段内生产的产品量。”因此,对于我国的2 种连续制造口服固体制剂上市申请,均应考虑连续制造系统的开机、受控状态、调整、停机等生产状态的生产能力和系统产生的废料,给出定义批量的方法,并能充分证明连续制造生产系统生产一致批量大小产品的稳健性。由于制剂批次还具体涉及QbD 研发批次、临床批次、注册批次和商业规模生产批次,因此需要确定好各自的批量数值或范围,合理并清楚地描述出每种批次的情况。
3.5 工艺验证
工艺验证内容多出现在EMA公布的审评报告中,此外EMA曾发布过《成品工艺验证指南——监管提交文件的信息和数据要求》(Guideline on Process Validationfor Finished Products—Information and Data to be Provided in Regulatory Submissions),基于这份指南,Symkevi®、Kaftrio® 采用了持续工艺确认(continuous process verification,CPV)方案对工艺进行验证。而其他制剂则采用传统工艺验证方法,除了其中的Kaftrio®和Verzenio®分别采用2 个和12 个商业规模批次进行工艺验证,剩余的则采用了连续3 个商业规模批次进行工艺验证。对比连续制造生产模式和传统批量生产模式,工艺验证的区别在于需要根据验证总体规划对过程控制性能进行评估。
对于我国的2 种连续制造口服固体制剂上市申请,鼓励申请人可采用持续工艺确认的方法在拟定的商业规模生产场地完成工艺验证,将工艺研发、商业生产工艺验证、商业规模生产中的持续工艺确认相结合,确定工艺始终如一的处于受控状态,实现制剂的生命周期管理,随着生产商对工艺的理解和工艺性能控制水平不断提高,还可对持续工艺确认的范围和频率进行周期性的审核和调整。工艺验证资料至少应当包括工艺验证方案、工艺验证报告、批生产记录样稿等。工艺验证内容应当包括批号、批量、连续制造设备的选择与评估、连续制造工艺条件、连续制造工艺参数和工艺参数可接受范围、过程控制分析方法、抽样方法及计划、连续制造工艺步骤评估、不合格物料的分离能力等。
3.6 产品放行
10 种连续制造口服固体制剂大部分是通过传统的成品测试进行产品放行, 其中也不乏采用RTRT 进行产品放行, 如在EMA 获批的Orkambi®、Symkevi®、在EMA 和FDA 获批的Verzenio®。对产品放行检测项目进行梳理(表4),申请人主要进行了外观、含量测定、鉴定、溶出度、剂量单位均匀度、微生物限度及降解产物等项目的检测。在PMDA 获批的Tazverik®还采用相同的取样点, 对连续制造和传统批量生产模式的产品放行检测结果进行对比,分析结果显示无明显差异。此外,在EMA 和FDA 获批的Symkevi®/Symdeko®、在EMA 获批的Orkambi®还建立了RTRT 溶出度模型,并研究证明了RTRT溶出度模型能够表征原料药溶出度的能力,具体内容见表5。RTRT 技术被医药企业视为连续制造商业化后获得高效率与经济效益的重要手段,同时EMA 和FDA 还鼓励实施部分或全部产品质量属性的RTRT,这使该技术在产品放行中得以应用和推广。例如,EMA 发布了《实时放行检测指南(先前为参数放行指南)》[Guideline on Real Time Release Testing (Formerly Guideline on Parametric Release)], 鼓励使用近红外光谱技术和拉曼光谱技术作为RTRT 工具,通过与《欧洲药典》(European Pharmacopoeia)中常规分析方法[ 如高效液相色谱法(high performance liquid chromatography,HPLC)] 的结果比较,完成RTRT 方法的研发和验证。EMA 也提出在口服固体制剂商业生产的第一年,每次生产活动至少有1 个批次,之后每年至少有1 个批次,进行产品放行的平行检测,以研究近红外光谱模型或拉曼光谱模型用于RTRT 的稳定性。当RTRT 不能使用或需要系统更新时,则以常规分析方法代替。
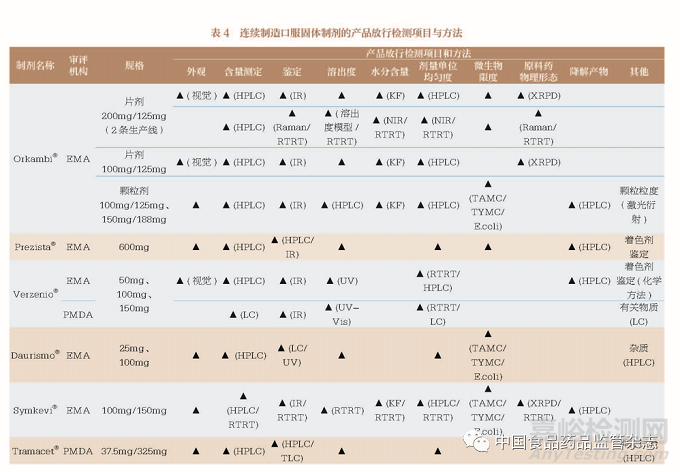
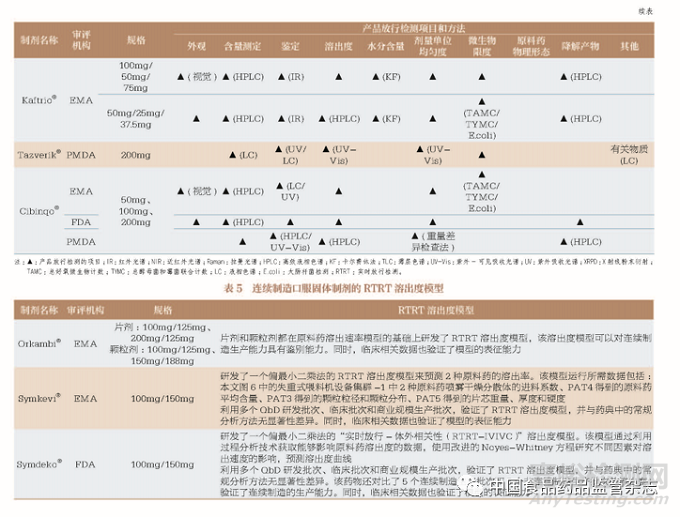
目前,我国暂无与产品放行直接相关的指导原则,医药企业多参考ICH《Q6A :质量标准:新原料药和新药制剂的检测方法和可接受标准:化学物质》(Q6A:Specifications: Test Procedures and Acceptance Criteria for New Drug Substances and New Drug Products: Chemical Substances)、《Q3B(R2):新药制剂中的杂质》[Q3B(R2): Impurities in New Drug Products] 等指导原则中的内容确定适当的抽样计划和放行标准。对于我国的2 种连续制造口服固体制剂上市申请,应提供至少3 个商业规模批次的产品放行报告。基于表4 的梳理,在制定产品放行的质量标准时应重点考虑外观、含量测定、鉴定、溶出度、剂量单位均匀度、微生物限度及降解产物。此外,还应考虑对水分和粒度分布的检测,若具有单独的放行标准和货架期标准也应分别说明。对于已上市口服固体制剂由传统批量生产模式变更为连续制造生产模式,应进行连续制造和传统批量生产模式的产品放行对比,以证实连续制造生产模式可以制造出与传统批量生产模式质量一致或更高的药品。此外,对于口服固体制剂产品放行的重要检测项目溶出度来说,我国CDE 已发布《普通口服固体制剂溶出度试验技术指导原则》。该指导原则还针对口服固体制剂的处方工艺在批准后发生变更时,如何通过溶出度试验确认口服固体制剂质量和疗效的一致性提出了建议,可用于指导连续制造口服固体制剂的药学研究工作。对于我国的2 种连续制造口服固体制剂上市申请,若按《中国药典》的溶出度方法进行溶出度表征,应建立溶出度标准的方法和溶出曲线比较的统计学方法,根据可接受的临床试验用样品、生物利用度和(或)生物等效性试验用样品的溶出度结果,制定溶出度标准并提供相关检测数据。对于已上市口服固体制剂由传统批量生产模式变更为连续制造生产模式,还应提供连续制造生产批次和过去的传统批量生产批次的溶出度对比数据,确认产品质量和性能是否保持一致。而多规格采用连续制造生产模式的口服固体制剂,溶出度比较试验可用于申请小剂量规格制剂体内生物等效性试验的豁免。在此基础上,若溶出度的表征是采用类似表5 的RTRT 溶出度模型,或是在产品放行中引入RTRT 技术,都应当提供完整的模型研发和校准的原始建模数据,包括但不限于程序文件、模型研发、校准和方法学验证的输入和输出数据;提供用于模型研发、校准和验证的各个批次或环节的配方和工艺参数信息;做好产品生命周期管理的模型更新和完善工作,确保该检测技术的稳健性;并以临床相关性数据验证该技术的应用能力。
3.7 稳定性考察
对于10 种连续制造口服固体制剂的稳定性考察,主要包括影响因素试验(表6)、加速试验和长期试验(表7)以及其他试验(表6)。影响因素试验中主要对光、湿、热、酸、碱、氧化等因素进行考察,部分制剂根据加速试验结果,增加了中间条件试验(表8)。据此为其处方、工艺、包装、贮藏条件、复验期和有效期的确定提供了支持性信息。同时,简略设计方法(括号法和矩阵法)也被用于稳定性考察。值得关注的是,在FDA 和EMA 获批的Symdeko®/Symkevi®和在PMDA 获批的Tazverik®还对传统批量生产批次和连续制造生产批次的稳定性结果进行了对比,证明了连续制造的生产能力。
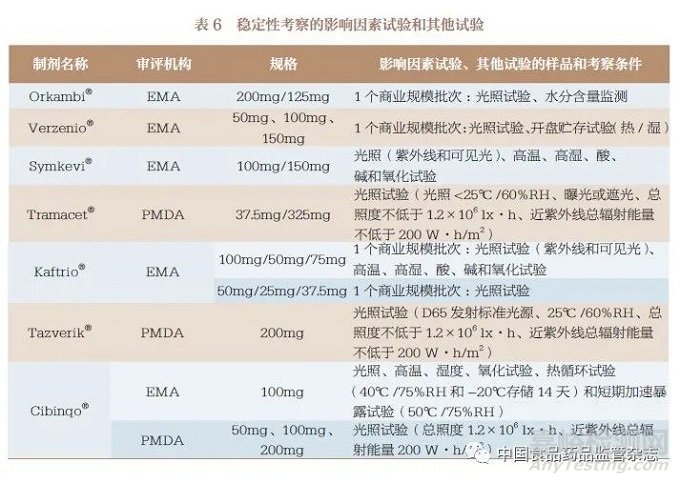
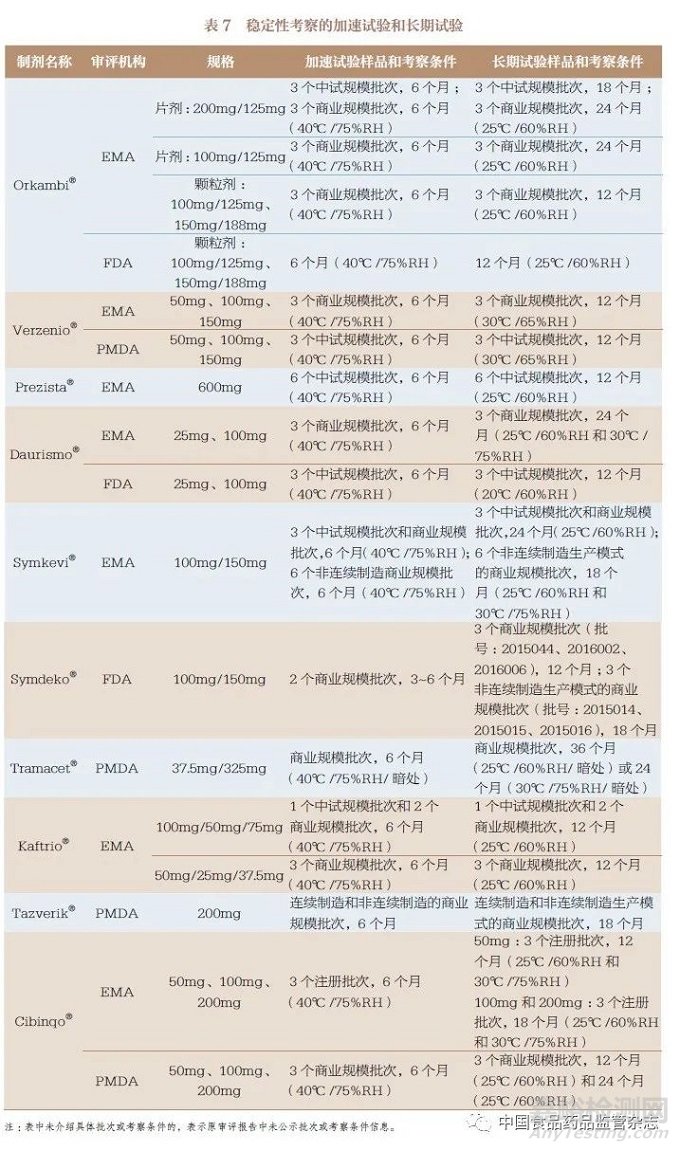
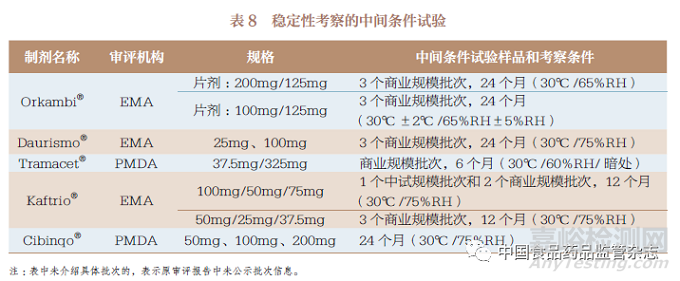
针对稳定性考察,我国CDE已经发布了《化学药物(原料药和制剂)稳定性研究技术指导原则》等,同时也有ICH《Q1 :稳定性》(Q1: Stability)指导原则可参考。对于已上市口服固体制剂由传统批量生产模式变更为连续制造生产模式的情况,应提交3个传统批量生产批次和3 个连续制造生产批次的稳定性考察对比结果。对未上市口服固体制剂采用连续制造生产模式申报上市的情况,应提交至少3 批中试规模批次或验证批次的稳定性考察结果;对于中试规模批次或验证批次,其合成路线、处方及生产工艺应与商业化规模产品一致或与商业化规模产品的关键工艺步骤一致,且各批次样品质量应能代表商业化规模产品的质量,包装容器也应与商业化规模产品相同或相似。基于表6~ 表8 的梳理,影响因素试验和其他试验可采用1 个注册批次的样品,加速试验(40℃ ±2℃ /75%RH±5%RH)和必要的中间条件试验(30℃ ±2℃ /65%RH±10%RH)应采用3 个注册批次的样品进行至少6 个月的考察, 长期试验(25℃±2℃/60%RH±10%RH或30℃ ±2℃ /65%RH±10%RH)应采用3 个注册批次的样品进行至少12 个月的考察。如果以上几种试验结果有不明确的情况,应加试同样批次量的样品,其他考察条件、分析方法和考察指标根据药物性质进行确定。此外,产品被CDE 获批上市后,应承诺以上市后生产的前3 批产品进行长期留样稳定性考察,并对每年生产的至少1 批产品进行长期留样稳定性考察。
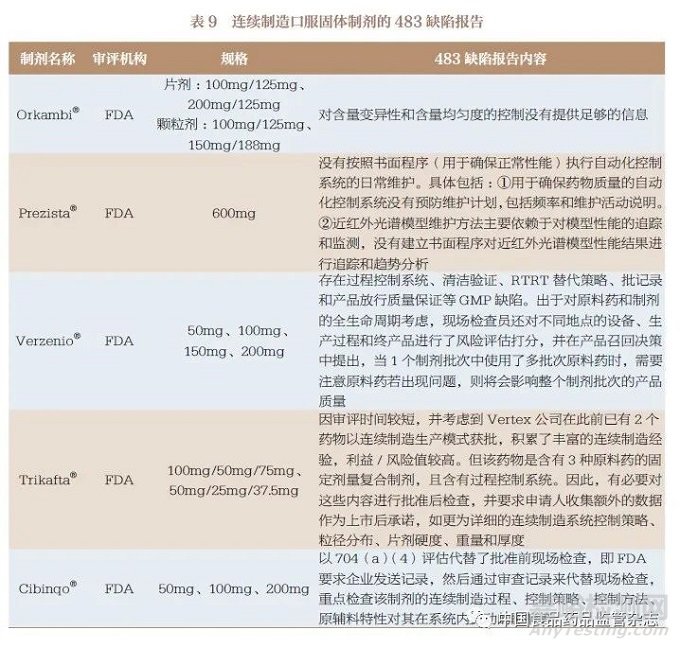
3.8 现场检查
现场检查内容多出现在FDA公布的审评报告中, 在FDA 获批的Orkambi®、Verzenio®、Daurismo®均进行了批准前现场检查,483 缺陷报告中列出了申请人质量体系不符合GMP 的情况,具体内容见表9,主要涉及生产工艺和控制方面等内容。
对于我国的2 种连续制造口服固体制剂上市申请,实施现场检查工作时,除了对处方与工艺研究、样品试制、技术转移、质量管理、稳定性研究、数据可靠性、生产现场的真实性等常规检查,更应注重连续制造商业规模生产过程和质量控制策略是否与申报资料保持一致,如厂房设施、连续制造关键设施设备和物料、连续制造生产系统、连续制造标准操作规程、批生产完整记录、连续制造工艺验证方案及报告、质量标准、过程分析技术与分析模型、不合格物料的分离能力等,同时检查连续制造商业规模生产条件是否具备连续制造的生产能力,保证持续输出质量稳定和均一的制剂产品。对于已上市口服固体制剂由传统批量生产模式变更为连续制造生产模式,由于该变更属于重大变更的情形,现场检查还应当调取先前的现场检查结果,考察既往是否存在重大不合规问题,在此次现场检查中是否对此作出相应的改进。
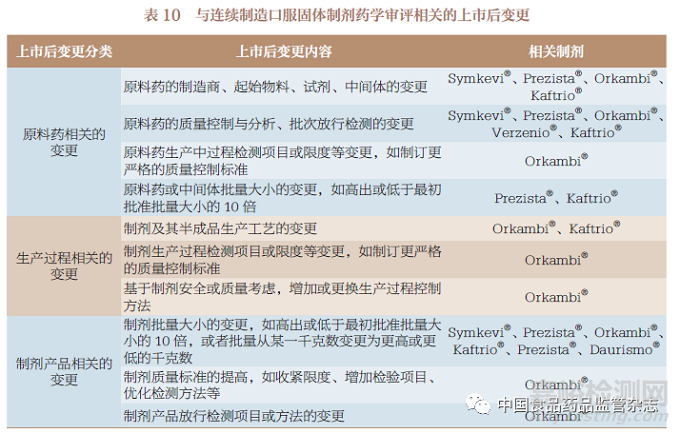
3.9 上市后变更
与10 种连续制造口服固体制剂药学审评相关的上市后变更主要分为3 种:原料药相关的变更、生产过程相关的变更、制剂产品相关的变更,具体内容见表10。此外,对于连续制造这种特殊生产模式,部分制剂还要求提交与过程控制变更管理相关的批准后变更管理方案。
药品上市后变更管理属于药品生命周期管理的一部分,对于我国的2 种连续制造口服固体制剂上市申请来说,已上市口服固体制剂由传统批量生产模式变更为连续制造生产模式本身就是一种重大的上市后变更情况,此外便是获批上市后又出现的原料药、生产过程和制剂产品相关的变更;未上市口服固体制剂采用连续制造生产模式申报上市获批后也会存在原料药、生产过程和制剂产品相关的变更。基于上述变更情况的药学审评工作,由于我国开展上市后药学变更审评工作时间相对较短,可借鉴表10中出现的与连续制造药学审评相关的上市后变更情况,鼓励申请人在对制剂及其工艺、质量控制等不断深入理解的基础上,采用ICH《Q10:药品质量体系》(Q10:Pharmaceutical Quality System)、《Q12 :药品生命周期管理的技术和监管考虑》等指导原则的变更管理工具,对变更进行重大、中等和微小的确定并展开相关研究。CDE 可基于申请人提交的补充申请、备案或年度报告材料,不断积累审评审批经验,可在借鉴EMA 和FDA 的批准后变更管理方案基础上,形成与连续制造生产模式相关的上市后变更案例,供相关医药企业参考,促进连续制造生产模式的持续改进和创新。
上文主要从原料药和辅料、制剂研发、生产工艺与工艺控制、批次描述、工艺验证、产品放行、稳定性考察、现场检查和上市后变更9 个方面对国外连续制造口服固体制剂药学审评内容的启示进行了阐述,此外还应关注到,在NMPA 或其直属单位已发布的各项指导原则、指南或标准中,暂无直接与连续制造生产模式相关的内容。若要推进连续制造口服固体制剂的研发与上市,完善药品监督管理政策和技术指导文件是排在首位的工作。因此,建议在现有药品监管法律法规框架下,明确监管路径,可基于上文各个药学审评方面的启示,陆续制定或完善与连续制造生产模式相关文件(表11)、GMP 附录或将其收载入《中国药典》。

4 结论
随着全球连续制造口服固体制剂不断获批上市,连续制造生产模式已成为美欧日等发达国家或地区高度重视的新兴技术。在新冠肺炎疫情全球大流行的环境下,药品紧缺问题突出,连续制造生产模式因其生产速度快、质量稳定、绿色环保等优点使其具有更特殊且重要的意义。药品生产技术的更新换代速度和医药行业快速发展需求,给我国药品审评机构、药品审评能力和药品审评体系现代化建设提出了新的挑战。本文通过对国内外已上市连续制造口服固体制剂的药学审评内容进行研究,形成了我国药品监管机构未来对此类制剂的药学审评启示。建议具有前瞻性的连续制造指导原则或标准陆续展开研究、制定、征求意见和发布,起到规范连续制造生产模式和指导其应用的效果,不断推进ICHQ13 指导原则在我国的实施与转化。鼓励有计划实施连续制造生产模式的医药企业,尽早地同CDE 进行沟通交流,提前规避和解决连续制造生产模式合规性和法规适用性的问题。我国药品监管机构应坚持国际化监管视野,不断提升我国药品监管能力,以审评工作促进连续制造药品的研发,促进安全、有效、稳定、均一和经济的连续制造药品上市,建立健全现代化药品审评体系,增强我国在国际药品监管领域的话语权,加快我国医药产业的高质量发展。
引用本文
孙钟毓,林泊然,李爽爽,梁梦颖,王浩伟,陈贵鑫 张惠,罗苏秦*,臧恒昌*.国内外已上市连续制造口服固体制剂药学审评内容的研究与启示[J].中国食品药品监管.2022.09(224):54-77.

来源:中国食品药品监管杂志


