您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-04 22:31
影像组学为从影像成像中提取临床相关信息提供了强有力的工具。影像组学可以通过提取高通量特征来预测患者的预后,使用大型训练样本来探究图像特征和疾病状态之间的微妙关系。但是,基于数据驱动的影像组学本质上无法解释潜在的生物学机制。早期的影像组学主要是对语义、放射科医生定义的特征进行分析,具有定性的意义。随着机器学习方法的迅速发展和普及,该领域迅速转向高通量数据分析,导致越来越大的特征数据集。这一趋势使研究的注意力转向提高预测能力,进一步偏离了对研究结果的生物学机制的理解。预测模型和生物学意义之间的这种脱节必然会限制其广泛的临床应用。影像组学和生物学意义相关联在该领域获得了越来越多的关注,有不同的新兴方法可用,包括与基因组学相关性、局部微观病理图像的纹理分析和宏观组织病理学标记的表达。本文介绍了这些方法,并讨论了它们的意义。作者预测,随着影像组学的应用越来越广泛,生物验证将成为该领域的标准实践,从而进一步巩固该方法在临床决策中的作用。本文发表在Radiology杂志。
影像组学是一个新兴的研究领域,专注基于影像图像数据分析的新型生物标志物的探究。这是基于医学图像探究潜在病理生理特征的方法,因此,定量分析有助于描述影像成像的生物学特性。大量定量图像特征的自动提取能够有效地阐明图像中的细微特征,这些特征可能为疾病诊断、预后和治疗反应提供信息。先进的机器学习方法的发展促进了影像组学研究的迅速扩展,并成功地检测出了定性影像分析无法提供的特征。自2012年首次出版以来,提及“影像组学”的出版物呈指数级增长,2019年几乎达到1000份。
现代医学得益于大量的测量技术,这些技术能够告知医生可能通过肉眼检查无法直接获得的疾病特征。生物过程可以在空间尺度上进行跟踪,从个体的水平一直到单个分子,成像方法覆盖了这一范围的大部分。影像成像主要基于解剖和代谢成像,如图1所示。通过在所用成像技术分辨率范围内的空间尺度上直接量化肿瘤成像表型,影像组学旨在提供对疾病多方面、间接洞察,包括肿瘤分级、组织学和遗传亚型以及预测结果。这些特征反映了在不同空间尺度上发生的变化。因此,在大多数研究中,能够进行影像组学预测的间接关系的生物学机制在很大程度上仍然无法解释。重要的是,由于影像组学数据可以纵向获得,因此可以用来量化潜在“生物特性”对外部扰动的响应。
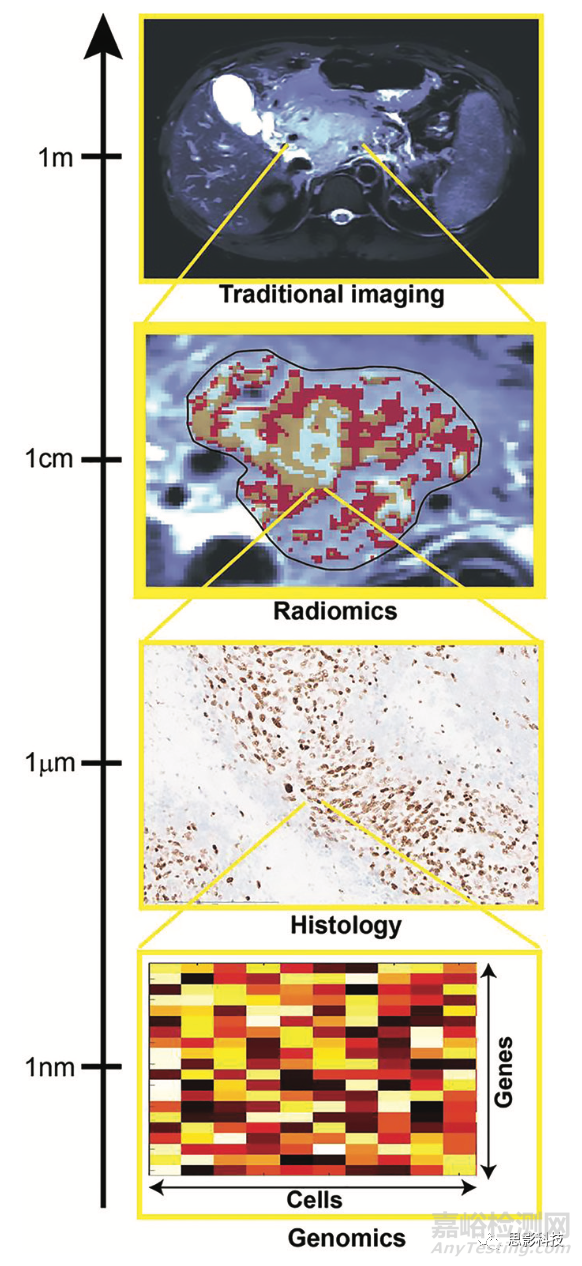
图1,图中显示了多尺度量化提供互补的肿瘤分析。组织学和基因组分析可以提供特定的小规模分析,有助于验证影像组学结果,重点是量化尺寸超过图像分辨率的空间模式。
影像组学生物标志物的探究几乎完全是数据驱动的。相比之下,传统的生物标志物探究通常是从一开始就基于生物学的假设驱动的。临床前实验通常可以在临床使用之前验证指标的作用机制。基因组学、转录组学、蛋白质组学和影像组学等方法扩大了特征参数范围,以找到预测结果的敏感标记物,因此通常涉及事后生成的假设。由于缺乏基本的生物学原理,“组学”方法的黑箱性质严重阻碍了其广泛应用,使验证尤其具有挑战性。提供影像组学特征的生物学背景,将是影像组学作为一种独立的诊断、预测或预后方法在影像学和肿瘤学界被普遍接受的一个重要步骤。随着该领域的发展,新兴的影像组学特征将需要采用其他新的临床诊断和预后方法所使用的报告指南和评估标准,包括与现有参考标准方法的比较。生物学验证作为这一流程的一部分,至关重要。
此外,在可能的情况下,了解所探究到的关系的生物学基础可以加强影像组学结论,并可以提供额外的验证和探索机会。例如,如果发现预后良好的影像组学特征与特定蛋白质的表达高度相关,则可以研究蛋白质表达和预后的关系。本文讨论了影像组学结合生物学机制验证的显著进展的研究,并假设实施新的验证标准,从而优先考虑建立生物学机制。
1、验证的重要性
影像组学本质上是数据驱动的,通过筛选大量特征以获得再现性和潜在信息。然而,由于考虑了许多特征,因此存在过度拟合或过度解释衍生模型的误差。随着分析技术的日益成熟,越来越需要对结果进行更严格的验证。大多数已发表的影像组学研究表明,除了使用独立的测试集外,没有对所用的特征进行验证。由于影像组学特征与临床结果之间的因果关系可能仍不清楚,这种方法并没有解决许多关于研究结果实际价值的问题。这一局限性已在“影像组学质量评分”的研究中得到认证,该评分取决于构建影像组学模型的不同评估指标。这一点的关键是特征提取和统计方法的标准化,使用多个机构的单独验证队列,以及影像组学在前瞻性临床研究中的应用。影像组学本体论项目为影像组学分析过程的标准化和简化做出了进一步努力,该项目为临床使用提供了一个全面的分析平台,包括多中心研究的解决方案。尽管这些方法有助于改善研究结果的再现性,但生物学验证仍然是一个极其重要指标,对于将影像组学分析转化为常规临床决策过程中可操作的一部分是必要的。
在其他高通量数据驱动研究中使用的生物学机制和方法水平在很大程度上不适用于影像组学。例如,基因组学筛查中确定的基因和通路可以在体外进行研究,并且由于大量可用的研究,可以纳入强大的资源数据库中,如基因本体论(9),它结合了每个基因和通路的功能信息。我们认为,随着影像组学领域的发展,以及与不同特征的生物学机制相关的更多信息变得可用,可能会编译和发布一个类似的数据库。如本文所述,分析方法的严格标准化对于这项任务至关重要。
在本文中,介绍了影像组学发现生物学验证的主要工作,重点介绍了可用于比较的主要生物相关性类别。
首先讨论了由语义特征描述的数据驱动的影像组学与视觉图像特征之间的关系,然后分别描述了可用于影像组学验证的生物学机制,这些生物学机制来自遗传和组织病理学显著相关性的数据。最后,讨论了“生镜”区成像作为一种影像组学方法,对于有效验证图像异质性背后的生物学发现具有重要前景。
本文旨在总结和讨论生物验证领域中可用和实践的方法,以促进其更广泛的应用。尽管许多研究表明了影像组学特征与生物学相关因素之间的关系,如组织学肿瘤分级或基因表达,但本文的重点是讨论其他独立相关因素以验证发现的生物学机制的报告。我们坚信,将生物学验证引入影像组学模型构建的标准实践将加速该方法在临床和患者护理中的常规应用。
2、语义分析
语义特征通常是放射科医生定义的公认指标,用于描述肿瘤的形态特征和位置。例如针状、鳞状、凹陷和中央坏死等。在使用更复杂的方法和数据驱动的特征之前,影像组学领域的早期工作可以将多个语义特征组合成更复杂的特征(例如,用于基因表达预测)。所考虑的特征的视觉性质确保了研究结果仍然相对偏物理机制的理解。随着计算机视觉和机器学习方法的迅速发展和普及,影像组学领域迅速向高通量分析和复杂组合特征转移。这导致了数据输入量的增加和分析成本的降低,但代价是对生物学机制的可解释性。
最近一些研究表明,基于影像组学的语义和传统图像特征可能提供有价值潜在的生物学机制,因为它们与视觉表型明显相关。Yip等人量化了非小细胞肺癌中语义特征和影像组学特征之间的相关性。重要的是,作者利用观察到的关系来讨论影像组学特征变化的物理和生物学机制。同样,Tunali等人引入了一个自动化方法,用于量化肿瘤-基质界面特征,显示其与非小细胞肺癌生存率的关系。然后,通过显示与语义评分特征(如分叶和边界定义)的显著相关性来验证对新特征的视觉解释。图2显示了这种定量方法的一个示例。量化肿瘤-基质表皮特征,显示其与非小细胞肺癌生存率的关系。然后,通过显示与语义评分特征(如分叶和边界定义)的显著相关性来验证对新特征的解释。图2显示了这种定量方法的一个示例。在模型中引入决策树也可以简化对特征信息内容的直观理解。Gevaert等人使用这种方法,利用语义和影像组学特征成功预测基因的突变状态。然而,作者强调了语义分析的一个重要缺点,即与主观评估相关的观察者间重复性差,科恩k系数较低。
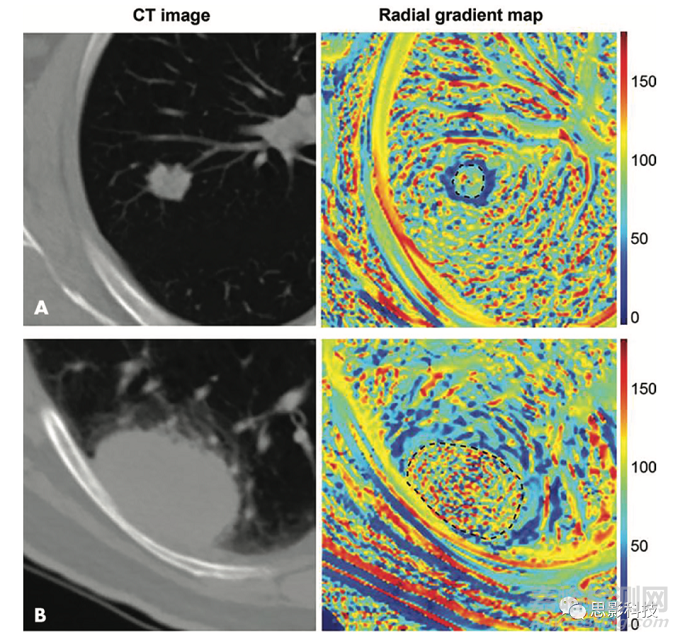
图2,影像组学可以量化肿瘤的视觉特征。Tunali等人使用两名患者(A和B)肺癌病变的CT图像(左)计算描述肿瘤边缘界面(黑色虚线勾勒出的肿瘤)的径向梯度图(右)。肿瘤周围区域map的简单平均值和标准差的量化与生存率相关,并与肿瘤边缘的定性语义特征相关,如边界定义。
一些研究集中于肿瘤特定视觉特征的自动量化,以提高分析的重复性和标准化。Koay等人研究定量评估CT图像中胰腺肿瘤的视觉清晰度,展示其预测生存率的能力。然后,可以根据组织学和基因组数据对这种方法进行评估,以进一步阐明测量表型的微观特征。这项假设驱动的研究采用了一些自定义图像特征来代替标准的影像组学方法,在可行的情况下,这种方法可能更适合于识别图像的信息和生物信息之间的明确关系。
类似地,已经提出了肿瘤异质性的多种定量指标,如Davnall等人(19)的综述所述。值得注意的是,只有一小部分试图量化异质性的研究讨论了所选指标的信息主要来自动态对比增强MRI和氟18-氟脱氧葡萄糖PET。大多数其他研究转而考虑纹理特征,例如灰度共生矩阵,它描述内部图像强度模式,假设这些特征与异质性之间存在潜在关系。虽然关于异质性定性定义与图像纹理特征之间关系的研究相对较少,但一些研究报告了间接关系。Skogen等人在胶质瘤中证明,已知与异质性相关的肿瘤分级与CT图像中强度分布的标准偏差相关。相反,Liu等人报告称,肿瘤分级与异质性之间没有相关性,而与纹理特征显示出强烈的联系。可能需要更多的研究来验证视觉特征、语义特征和定量指标之间的关系。
3、影像基因组学与基因表达的关系
数据驱动的图像特征提取还可以与遗传分析相结合,以预测生存率和肿瘤分级的突变状态。这被称为影像基因组学,不要与定义基因组学和放射敏感性之间关系的同一术语混淆。影像基因组学是一种快速发展的高通量方法,旨在从基因组学和影像组学中挖掘和关联与基因信息相关的图像信息。由于癌症基因组图谱倡议(26),尤其是结合相关癌症影像档案馆(27)提供的资源,这些特征越来越容易获取。尽管主要为遗传信息提供可替代成像特征,但影像基因组(28)方法也可以为影像组学特征提供一些生物学验证。从影像学和遗传数据中提取特征所使用的分析方法之间的相似性也可用于方法之间的交叉验证。在一项关于肺癌体细胞突变与放射学CT表型之间关系的综合研究中,Rios Velazquez等人(30)表明,非小细胞肺癌的多种影像组学特征与若干相关突变之间存在显著关联,包括表皮生长因子受体(EGFR)和Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)。Aerts等人(31)利用遗传信息阐明了与肺癌和头颈癌生存的影像组学特征相关的生物学特征。相反,Gevaert等人(32)将遗传特征作为预测图像特征的起点,从而进一步加强了影像组学和基因组织间的联系。
非小细胞肺癌中的表皮生长因子受体状态是一个广泛研究的课题,因为其发生频率高,而且这种突变可用酪氨酸激酶抑制剂治疗(33,34)。多项研究报告了与遗传检测确定的表皮生长因子受体突变状态相关的CT特征。然而,正如Yip等人(35)所指出的,其中许多人得出了相互矛盾的结论(36-38),这破坏了该方法的再现性。将基因组相关性与组织学分析提供的其他生物学指标相结合,可能证明有必要最终验证这些不一致的发现。在遵循这些原则的一项研究中,Sun等人(39)开发了免疫浸润的影像组学特征,将得分与相关基因表达组、病理结果和生存数据相关联。同样,同样,Tunali等人(40)证明,根据遗传图谱和免疫组织化学(IHC),能预测免疫治疗后生存率的CT影像组学特征也与缺氧密切相关。Mu等人基于PET/CT影像组学研究程序性死亡配体1或PD-L1状态和表皮生长因子受体突变状态的预测因子。当这两种表型结合在一起时,它们产生了一个强大的决策支持工具,因为这两种表型通常是相互排斥的。除了额外的验证之外,这些研究中的多重相关因素的组合还揭示了影像组学特征关系的生物学驱动力。Beig等人(43)利用癌症中氧合状态的已知相关性,通过患者MRI扫描发现与肿瘤缺氧相关的影像组学特征,并随后显示其与胶质母细胞瘤患者的生存密切相关。Grossman等人(44)提出了一种替代方法,旨在揭示影像组学特征和通路信息之间的关系。使用双聚类方法来确定与结果相关的影像基因组相关性集群,随后验证这些集群,以显示与免疫浸润或核因子kB或NF-kB表达(也参与免疫反应)的相关性,以及与靶向靶向IHC的相关性(图3)。组织学信息的引入可以提供必要的联系,以了解遗传学和描述宏观肿瘤纹理的影像组学特征之间的关系。
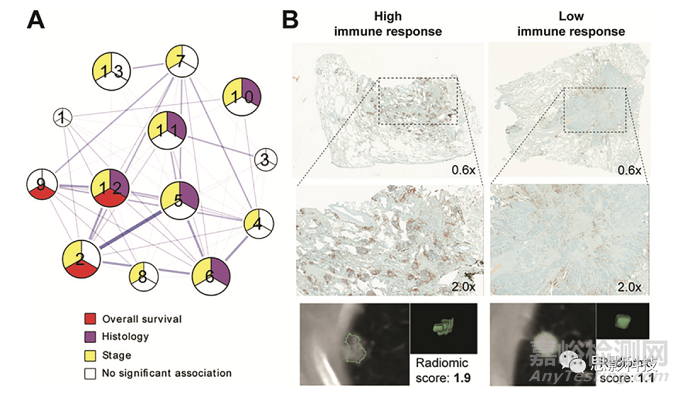
图3,影像组学数据和基因通路数据之间的关联可以从组织学上探索。A、该图描述了Grossman等人提出的通路富集和影像组学特征之间的相关性分析。多个簇(数字1-13)描述了不同生物过程和图像信息之间的关系。进一步将相关影像组学特征与免疫组织化学染色(核CD3表达)进行相关性研究,以验证研究结果,并为了解肿瘤遗传学和影像学特征之间的相互作用提供联系。B、显示了免疫反应强和/或影像组学评分高(左)和免疫反应低和/或影像组学评分低(右)的肿瘤示例。
Wu等人(45)没有考虑肿瘤体积,而是专注于肿瘤相邻实质的图像特征,并得出结论,其特征对患者生存的预测能力可能与相关信号通路的相关失调有关,如肿瘤坏死因子-α,或TNF-α。将具有类似信息内容的特征模块分组,并首先与遗传数据相关,以进行筛选,随后评估其对生存预测的能力。在一项类似的研究中,同一组人对乳腺癌进行了分析,证明了对比增强MRI的影像组学分析可用于识别具有不同生存率和分子通路特征的肿瘤亚型,这可能是生存率差异的基础(46)。Itakura等人(47)采用了一种独特的方法,即使用无监督分析来定义主要的肿瘤簇,这些肿瘤簇主要由其形状和增强模态来定义。在确认集群的生存差异后,相应的遗传通路差异被确定,为结果差异提供了潜在的生物学基础。
治疗反应可以进一步验证影像组学模型背后的生物学机制。Liu等人利用MRI灌注成像数据确定具有不同生存率的胶质母细胞瘤患者亚组。这进一步与相关的基因组数据相关联,以将对比度增强与肿瘤的血管生成特性相关联,并且该模型被证明能够正确预测抗血管生成治疗的反应,从而证实其生物学基础。
证明肿瘤特征和图像特征之间的因果关系仍然是大多数影像组学研究无法做到的,因为这项工作主要是临床和回顾性的,因此无法进行干预以测试观察到的相关性。这可以通过临床前研究来了解。Panth等人(49)借助一种可诱导基因小鼠模型,论证了遗传变化与影像组学特征之间的因果关系,该模型表明影响肿瘤缺氧特异性的因素。在一项更广泛的共同临床研究中,Zinn等人(50)通过分析野生型与敲除小鼠基因的肿瘤模型,证明了基因表达与影像组学特征变化之间的因果关系,并将其相关到人体肿瘤。这些研究为研究结果的作用机制和生物学基础提供了更详细和有力的见解,因此应予以鼓励。
4、组织病理学发现和IHC的补充验证
更接近解剖学的一步是描述肿瘤细胞群及其周围微环境表型的组织病理学信息。建立观察到的影像组学特征与病理结果之间的关系,可以为患者结果的生物学驱动因素提供强有力的联系,可能比基因图谱更具特异性。
多项研究使用组织学数据提供了比标准生存指标更详细的预后信息,从而证明了影像组学预测组织学肿瘤类型(51-53)或病理反应(54,55)的潜力。其他人则专注于预测更具体的信息,例如,Yin等人(56)将PET /MRI影像组学与病理样本得出的血管密度联系起来。然而,这项研究并没有使用组织学数据中的生物学相关性来验证和改善影像检查结果。在一种新的病理-影像组学模型中,Tang等人(57)根据两种免疫病理标记对患者进行分类,并将其作为额外的筛查步骤。他们得出了与相关免疫表型相关的生存预测因子,已知与患者预后相关。
Sun等人(39)利用IHC染色信息验证了与免疫浸润相关的生存特征的生物学基础。Ha等人(58)证明了组织病理学相关性在无监督影像组学模型评估中的应用。基于影像组学特征的显示出对肿瘤治疗和复发风险的不同反应。他们还观察到相关IHC标记的差异表达,从而深入了解结果差异的可能生物学来源。
对影像组学特征与患者预后之间机制的生物学验证需要仔细筛选有意义的相关性信息。Sone等的影像组学研究侧重于将特征与肿瘤氧合状态(缺氧)联系起来,如前所述,通过与相关遗传通路的关联进行研究,并/或借助组织病理学分析,依赖于肿瘤缺氧、疾病进展和多种癌症类型的治疗反应之间的关联(59,60)。Tunali等人(40)证实了非小细胞肺癌生存的影像组学模型与缺氧标记物碳酸酐酶IX的IHC之间的关系,碳酸酐酶IX最初是在影像基因组筛查中确定的。与Sun等人(39)类似,IHC分析用于连接成像和遗传信息,从而克服了通路数据的有限特异性,从而预测表型信息。
相反,影像组学方法可用于提供肿瘤缺氧的代替测量。传统上,直接肿瘤缺氧测量(61)使用分子成像技术,包括特异性PET和光学探针。虽然正在开发新型示踪剂(64),但成像在很大程度上受到了阻碍,动态范围较低,因此信噪比较低。相比之下,标准成像的影像组学分析有可能间接了解缺氧状态。如前所述,Beig等人(43)利用基因组学特征预测胶质母细胞瘤患者的缺氧引起的生存率。吡莫硝唑在缺氧中可通过IHC检测到。先前已基于基因组学描述了一项研究,该分析将吡莫硝唑染色与肿瘤特征相关(65)。Ganeshan等人(66)在结合放射学和IHC图像中更详细地观察了缺氧和血管生成的图像纹理特征和组织学指标,并报告了多个重要的关联。
Muzi et al(67)和Sörensen et al(68)基于氟18-氟咪唑PET成像的图像特征提取,探究出了与肿瘤缺氧信息直接相关的中等强度存活特征。未报告二级相关性。由于患者不能广泛使用氟18-氟咪唑PET,Crispin Ortzuar等人(69)利用传统的FDG /PET和CT数据研究了该PET缺氧标记物的替代标记。DeJong等人(70)的另一项研究描述了PET/CT影像组学的使用,试图测量低氧改变硝酸甘油治疗的反应变化。未报告有显著差异。
5、使用病理相关性进行局部放射学分析
将影像组学结果与肿瘤病理结果联系起来的另一种方法依赖于组织学图像的纹理分析。新兴且迅速扩展的病理组学领域(71)旨在应用高通量图像特征提取技术来挖掘病理数据中的微观模式。由于这些方法非常相似,可以将活体图像中的特征与从离体标本中提取的特征进行比较,这通常得益于图像模式的更清晰生物学定义,从而更好地理解特征。组织学数据的定量分析已被证明可以改善预后预测(72,73),超出了人类从业者的能力。Saltz等人(75)认为,放射学和病理学分析之间的相似性使得这些技术的结合有望提高预测能力。将影像组学方法直接应用于组织病理学图像显示了肿瘤分期的前景(76)。
将从宏观活体图像获得的影像组学特征与病理组学的亚细胞级数据进行比较是一个挑战,可能无法直接洞察影像组学的生物学基础。与影像基因组学分析一样,这两种方法在生物学信息来源上的巨大差距影响了明确的结论。Geady等人(77)根据病理数据生成了模拟CT图像,这是一项有希望的早期尝试,从而在潜层微观信息和派生纹理特征之间显示出良好的相关性。
已经提出了其他方法来克服这一局限性,方法是在与活体成像相匹配的空间尺度上关注组织病理学信息。Bobholz等人(78)共同采集了MRI和苏木精-伊红染色的组织学图像,这些图像被降采样到MRI分辨率,以比较两个数据集中的局部纹理信息。通过比较图像匹配区域的影像组学特征,确定了两种模式之间密切相关的特征。虽然没有直接揭示这些特征的生物学基础,但这些发现使我们更接近一个解决方案,因为苏木精-伊红染色模式的生物学意义比大多数MRI扫描更明确。此外,还应了解低分辨率影像特征和病理特征之间的密切相关性。McGarry等人(79,80)描述了这一方向的一个步骤,再次使用苏木精-伊红染色和多参数MRI数据集,对前列腺癌中与肿瘤分级相关的组织学参数进行局部影像组学预测,尽管该模型的无监督性质并未揭示不同多参数MRI模态对预测的直接贡献。T omaszewski等人(81)也使用MRI和病理图像的量化特征来验证治疗反应。这些示例说明了体内和体外图像的结合对于深入了解关系的详细空间分辨率的价值,如图4所示。这些发现的局部性质并不能总是直接转化为影像组学分析的主要目的,影像组学分析侧重于患者生存和反应的一般特征。然而,局部比较和观察到特征的相关性可以阐明影像组学指标的生物学意义,并可以为观察到的结果特征提供额外的验证,从而能够筛选与组织学发现相关的特征。
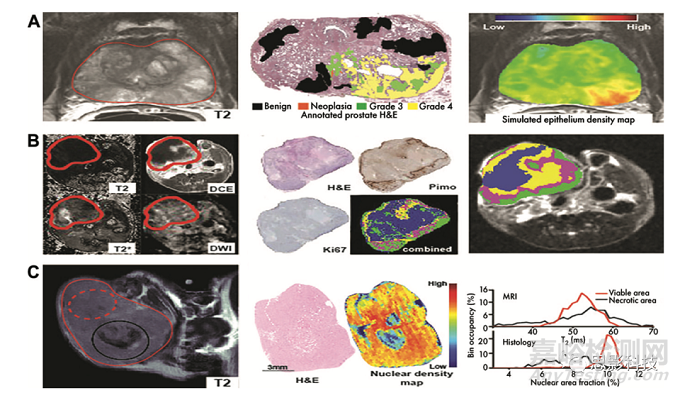
图4:结合组织学提供对图像特征的生物学见解。A、 McGarry等人利用多参数MRI信息(左)构建了模型,并在联合配准的带注释的苏木精-伊红染色玻片(中)上训练,以模拟前列腺上皮密度(右),与肿瘤分期相关。B、 Jardim Perassi使用多参数MRI(左),并与生存率、增殖和缺氧的组织学图(中)进行结合,以了解其生物学意义(右)。C、 Tomaszewski等人提出了T2加权MRI(左)直方图放射治疗反应的生物标志物,并使用组织学衍生核密度图(中)通过直方图特征的相似性来证明观察到的影像变化(右)。
6、生镜成像
影像组学分析已广泛应用于尝试告知和量化肿瘤异质性。“生镜成像”代表了一种识别不同肿瘤区域和细胞亚群的方法,它代表了传统全肿瘤分析和局部逐体素分析之间的中间地带,如前所述。结合多参数MRI(82)或PET/CT(83)等多种技术的图像,可以建立用于描绘肿瘤内不同功能区域(生镜)的定量特征。使用多维信息的复杂特征,这是一种与影像组学分析结合的方法,在生物学解释和验证研究结果方面带来了共同的挑战。利用MRI或PET/CT数据(87)进行聚类分析,相对生镜区域体积被报告为生存(85)和遗传通路失调(86)的预测因子。通过对坏死和水肿等明显组织表型的独立描述,可以对生镜区域的生物学意义提供有限的见解(86)。在组织学验证的帮助下,Henning等人(88,89)基于化疗后的临床模型追踪了肉瘤缺氧、存活和坏死MRI生镜区域的时间动态。通过对图像和相应的组织学发现进行逐像素空间共同配准,可以在临床前提供更详细的生物学信息,从而证明MRI生镜区域可用于描绘缺氧、坏死和其他情况(90)。许多临床定量影像学研究的回顾性设计限制了此类见解。为了阐明临床影像生镜成像的生物学意义,有必要进行前瞻性影像组学研究,包括方案中共同收集的病理学特征,以及早期报告,如卵巢癌病例研究(91)和肾癌持续研究(92)或胰腺癌总肿瘤标测试验。
将肿瘤和周围组织划分为不同的生理亚区也可用于影像组学分析。Beig等人(93)分别对脑肿瘤的水肿、坏死和增强区域进行了特征提取,显示了它们对无进展生存预测的不同信息内容以及与基因表达的关联。还使用了类似的方法(94)将影像组学特征与代谢特征联系起来,通过MR谱学测量。然而,由于对多个区域的分析,特征数量的增加需要更大的队列规模和详细的验证。
经过生物学验证的生镜成像对于其临床应用-放射治疗规划至关重要(95)。正如Enderling等人(96)所强调的那样,了解生理肿瘤亚区的空间分布可以根据局部放射敏感性曲线进行剂量绘制,以优化反应。这些基于图像(影像组学)和剂量形状(剂量学)特征的数据驱动剂量规划方法的早期发展已经有望减少辐射毒性(97,98)和实现个性化剂量处方(99)。
7、讨论
本文表明,最近研究在影像组学的生物学验证方面做出了重大努力。确定了迄今为止用于影像组学组学生物学基础的四类主要生物学相关性和方法,包括基因表达数据、免疫组织化学染色的蛋白质表达、微观组织结构和物理肿瘤生镜成像。表1列出了这些核心内容及其评估的总结。
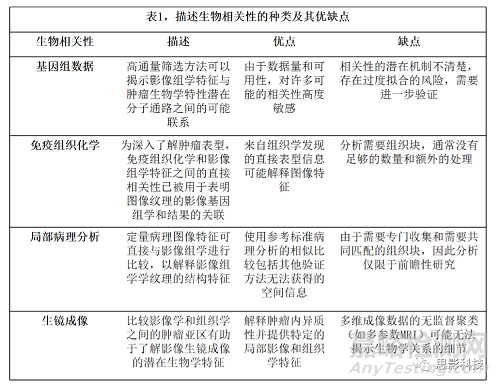
在传统的影像组学中,在一个独立的训练集中训练和验证的特征随后可以研究其与特定生物学指标的关联,如基因表达或IHC染色强度。Sun等人(39)和Tunali等人(40)使用的这种方法可以加强模型,回顾性地分析结果预测的可能机制。相反,生物相关性可明确用于模型构建,得出与结果间接相关的影像组学特征,如Beig等人的研究(43)揭示生物相关性与肿瘤缺氧的预后价值。表2给出了旨在为影像组学特征提供生物学见解的不同方法的示例,以及这些发现及其意义。
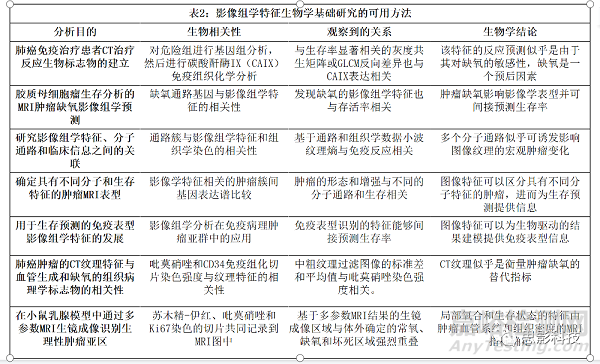
随着该领域的发展,越来越多的研究预计,除了与生存率或其他终点指标的主要关系外,还将报告与影像组学模型的至少一种相关性特征。这些可以在过程的不同阶段合并,作为特征选择的预筛选工具,或作为生存率计算前测试数据的主要来源。组织切片的微观结构也可用于进一步的观察。
结合临床和临床前实验也可能在影像组学的生物学验证中起到重要作用。动物研究能够进行必要的实验干预,以建立生物学和影像组学之间的因果关系,并为深入验证提供精确的、空间配准的组织学分析。然而,成像结果在空间尺度之间的直接可解释性仍然是一个挑战。越来越多的临床报告(例如,在大脑[78]、前列腺[80]或卵巢癌[91])证明了三维打印辅助体内和体外图像配准的可行性和高价值,提供了对局部成像特征生物学意义的空间分辨洞察。
8、结论
迄今为止,除了使用一个独立的验证队列外,许多影像组学研究没有对结果进行验证。这种趋势导致再现性差,因此影响应用。随着对影像组学特征生物学理解重要性的进一步认识,应制定标准化验证方法流程图,并在影像组学界部署。正如我们在本文中总结的那样,许多方法已经可以用于特征的验证和生物学分析。展望未来,我们建议所报告的研究都应努力包括此类分析,作为模型构建或后续验证的一部分,为观察到的生物学机制提供假设。这将使研究结果背后的生物学特性的讨论成为该领域的标准,并在同行审查过程中得到实施。

来源:思影科技


