您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-15 22:15
随着国家对医药卫生领域投入的持续加大、医药卫生体制改革的不断深入,我国医药产业结构经过多年的调整优化,已进入到较为成熟的阶段,医药产业也成为国民经济中发展最快的行业之一。
中国药学会发布的《2019年中国药学会医院用药监测报告》中指出,近5年来全国各级医院用药剂型中使用金额占比最高的为注射剂。
注射剂系指原料药与适宜辅料制成的供注入体内的无菌液体制剂,给药剂量精准、起效迅速、可避免首过效应,临床应用广泛。
但同时因其独特的给药方式与药效发挥特点,注射剂常被认为是风险程度最高的剂型之一,其质量安全性历来被各国药品监督管理部门所重视。
本文通过对1995年以来《中华人民共和国药典》(ChP)附录、制剂通则中有关注射剂收载内容的回顾,比较注射剂收载内容的变化,特别是必检项下的增修订内容,解读ChP对提高注射剂质量要求的路径;并介绍“质量源于设计(quality by design,QbD)”理念在注射剂研发中的应用过程和应用前景。
1 ChP注射剂通则增修订的历史沿革
随着改革开放的不断深入,中国特色社会主义进入新时代,国家先后实施药品审评审批制度改革、“健康中国2030”战略等重大举措,以满足人民日益增长的美好生活的需要。
ChP作为我国保障药品质量的法定标准,经过多年的调整、增修订,在沿用一贯的“原则性要求+必检项”的叙述模式下,标准体系不断完善、整体水平不断提高,极大地保障了国民用药水平。
其中,注射剂项目在每次ChP增修订过程中均有一定程度上体例格式的变动。
自1995年以来,ChP附录、制剂通则中注射剂必检项下项目(即描述为“除另有规定外,注射剂应进行以下相应检查”)增修订情况如表1所示。
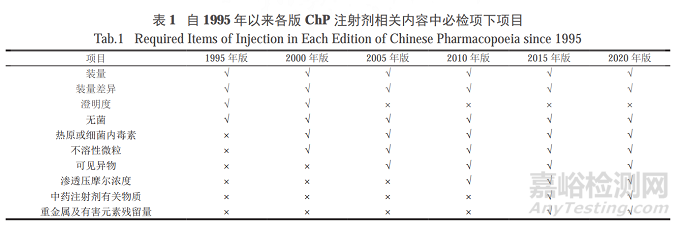
必检项目的增多体现出人们对注射剂的质量标准要求提高了,如在2000年版中新增“热原或细菌内毒素”、“不溶性微粒”两项检测项目,2005年版中新增“可见异物”,2010年版中新增“渗透压摩尔浓度”。
随着中药现代化步伐的加快,中药注射剂走入了大众的视野。但随之而来频发的临床应用不良事件又让患者望而却步。
2015年版ChP在有机整合2010年版一、二、三部内容的基础上,根据中药特点,重点加大了对矿物质药物中重金属及有害元素的控制。
2020年版ChP则聚焦药品生产企业在ChP执行过程中的难点,对原有表述方式进行了修正和规范,如2015年版必检项下“装量检查”部分,标示量与标示装量这2个概念较为模糊:
装量检查时油溶液、乳状液或混悬液“每只(瓶)的装量均不得少于其标示量”、生物制品多剂量供试品的单次剂量不低于“标示量”、预装式注射器和弹筒式装置的供试品“按单剂量供试品要求进行装量检查,应不低于标示量”。
新版药典修正了上述3处的模糊表述,明确检查时装量应与标示装量进行比较,进一步完善了注射剂必检项下内容,提高了ChP的可执行性,对我国制药生产水平的发展起到了积极推动作用。
在原则性要求模块,ChP立足于当下药品研发新形势,聚焦国内外制药行业发展现状及先进指导原则,不断与时俱进,规范国内药品生产市场。
2005年版中新增对注射剂亚剂型“乳液型注射液”的质量要求——“乳液型注射液不得有相分离现象”,同时规范抑菌剂的使用,降低注射剂使用风险。
2006年4月,齐齐哈尔第二制药有限公司因使用二甘醇代替原处方中的丙二醇而生产出的假“亮菌甲素”致人死亡事件震惊全国。
同年8月,安徽华源生物药业有限公司的克林霉素磷酸酯葡萄糖注射液(“欣弗注射液”),因生产时擅自修改灭菌工艺导致制剂“热原或细菌内毒素”不合格,引发严重不良反应。
两起药物不良事件的发生暴露出注射剂的使用安全性问题。
因此,2010年版ChP中明确规定“注射剂必要时应进行相应的安全性检查,如异常毒性、过敏反应、溶血与凝聚、降压物质、热原或细菌内毒素等,均应符合要求”,将安全性检查上升为法定规范,有效规避了上述药品不良事件的发生。
2015年版ChP在上版基础上进行整合,解决了长期以来注射剂通用检测方法不统一、内容冗杂等问题;
2020年版又以其为基础,进一步明确了注射剂的定义,将原在“生产与贮藏”环节中的“乳状液型注射液,不得用于椎管注射。混悬型注射液不得用于静脉注射或椎管内注射”的要求提至定义环节。
同时2020年版ChP进一步强化了药品质量全生命周期监管的理念,如在上版“注射剂原辅料要求、生产与贮藏期间的注意事项”主要内容的基础上,新增“一般制备工艺”要求,加强了对生产源头和生产过程的质量安全控制;
新增“注射用无菌粉末配制成注射液后应符合注射剂的要求”、“注射用浓溶液稀释后应符合注射剂的要求”,引导企业关注注射用无菌粉末和注射用浓溶液配制成注射剂时的质量控制问题。
提高药品生产质量,让人民群众用上好药,是满足人民群众美好生活向往的需要;提升药品质量标准,规范药品市场,是ChP增修订的目标;从法规层面上更大程度地保障注射剂安全,是每一版ChP注射剂部分增修订的主线内容之一。
注射剂质量管理也应是各药品生产企业需要着重思考与努力的方向。
2 注射剂开发中的QbD理念
2015年版ChP收录的注射剂相关内容为注射剂通则、注射剂有关物质检查法和注射剂安全性检查法应用指导原则,分别对注射剂的原辅料要求、生产与贮藏期间的注意事项以及注射剂有关物质和安全性检查项进行了简要描述,主要采用最终产品质量控制的形式在一定程度上保障注射剂的安全性和有效性,但对注射剂生产过程控制的指导少有涉及且不完整,难以满足对注射剂质量全生命周期监管的要求。
在新版药典增修订过程中,新增注射剂一般制备工艺内容,规范注射剂的生产过程,指导制剂生产企业科学地设计工艺流程,将关注点由最终产品质量控制逐渐转移至过程中质量控制,引导企业健全质量管理标准体系,加强对注射剂质量的全生命周期监管。
新版药典中的“过程管理”与“全生命周期监管”这一试水与QbD理念不谋而合。
QbD理念是在2004年美国FDA发布的文件《Pharmaceutical CGMPs for the 21st century-a risk based approach》中正式提出的。随后,人用药品注册技术要求国际协调会(ICH)将其纳入药品质量体系。
QbD是一种系统性的贯穿药品全生命周期的研发方法,它基于质量风险管理与知识管理,在对产品和工艺准确理解后,以预定目标为主线,确定原辅料的关键物料属性(critical material attributes,CMA)及其与制剂的关键质量属性(critical quality attributes,CQA)间的相互关系,运用风险评估、试验设计(design of experiment,DoE)等手段确定合适的生产工艺,并利用过程分析技术(process analytical technology,PAT)等建立满足产品质量保证水平的控制策略,在产品的整个生命周期保障产品质量。
制药行业中QbD理念的引入,将传统的产品质量控制由下游的产品终端转移至上游的产品研发端,大大提高了药品研发能力及速度。
目前,QbD理念已在多种药物剂型研发中广泛应用,尤其是口服固体制剂方面。
作为安全系数要求最高的剂型之一,注射剂如何准确运用QbD理念消除药物及生产工艺对药品质量的影响,使药品在设计研发之初就能规避很多潜在的开发风险,这是注射剂制剂研发者应关注和考虑的重点。
2.1 产品理解阶段——确定目标药品质量概况(QTPP)及制剂的CQA
准确理解QTPP是制剂产品研发的奠基石。
QTPP是制剂产品开发的设计基础,是对目标药品质量特性的前瞻性总结。
QTPP的选择和确定要以临床需求为指导,并充分考虑预期临床用途、给药途径、剂型、剂量、药包材,以及影响体内药动学特性和最终产品质量的因素等问题。
谢力琦等在对原研制剂利妥昔单抗注射液(商品名:美罗华)已公开信息的调研和上市产品的质量分析基础上,确定了其生物类似药的QTPP,如表2所示。
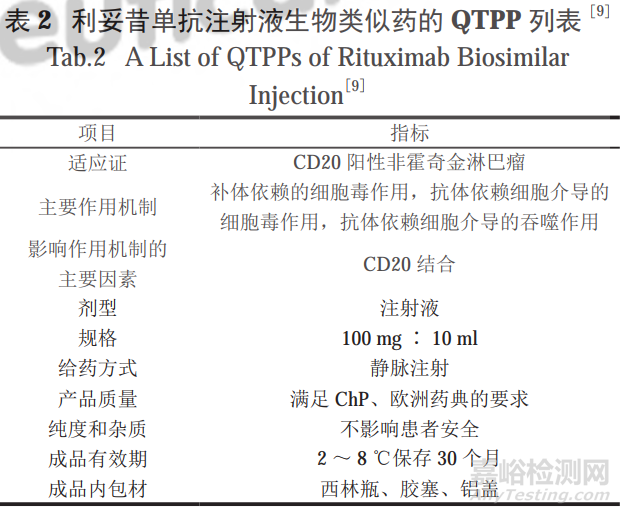
CQA来源于QTPP,是QTPP的具象形式,主要包括制剂的物理、化学、生物或微生物的性质或特征,以及影响因素等。
与QTPP相比,CQA项目内容更灵活多变,并会随着制剂开发的不断进行和对产品和生产过程的理解不断更新。
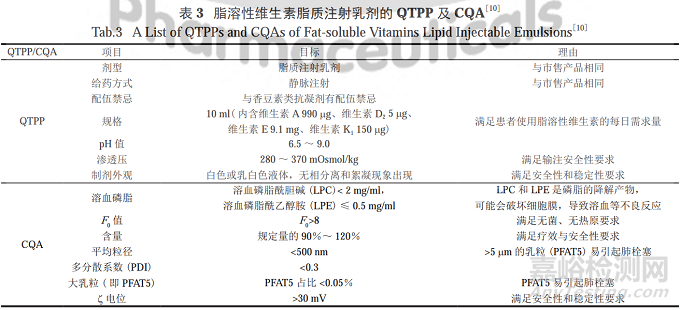
DENG等运用QbD理念,成功制备了高质量、高安全性的脂溶性维生素脂质注射乳剂。静脉注射乳剂中乳粒的粒径大小与分布对制剂安全性和有效性影响较大,粒径较大时易导致炎症、组织损伤等一系列不良反应。
研究者在对美国药典(USP40-NF35)<729>中关于脂质注射乳剂规定的理解基础上,将乳粒的粒径及分布作为CQA之一。此外,考虑到静脉注射乳剂这一特殊剂型,加入溶血磷脂这项指标。
基于此,脂溶性维生素脂质注射乳剂的QTPP及CQA汇总见表3。
在历版ChP增修订中,必检项下项目一直是其增修订重点。
随着项目数量的不断增多和要求的日益提升,注射剂产品的质量得到了大幅度提高。
在ChP收载的注射剂内容中,必检项目为制剂产品QTPP、CQA的确定指引了研究方向。
装量与装量差异、澄明度、渗透压、无菌等必检项目通常被认为是注射剂QTPP不可或缺的组成要素;表征无菌条件的F0 值等,则被作为CQA进行研究。
此外在特殊注射剂的研发中,常加入可能会影响注射剂体内行为的药物粒度分布、体外释放行为等内容作为CQA内容。
2.2 工艺理解阶段——风险评估,定义设计空间
确定制剂的CQA和QTPP后,首先应当关联物料CMA及生产工艺参数与CQA间的关系,利用DoE或其他工具对潜在的高风险变量进行风险评估,并确定应进行的研究优先级,确定影响CQA及QTPP的CMA和关键过程参数(critical process parameter,CPP),进而定义特定产品的设计空间。
对于注射剂而言,准确分析和把握原辅料的理化性质是制剂工艺设计开发的基础。
注射用辅料,特别是一些注射剂处方中的“非必需添加剂”,且在使用过程中存在安全风险的成分,如活性炭、Tween-80等,在历版ChP增修订过程中均会有一定程度的体例格式或内容上的修改,引导企业关注辅料对注射剂CQA的影响。
例如,活性炭的加入可有效除去热原,但同时可能会导致其中的可溶性杂质进入药液而无法去除,并易污染生产车间洁净区和空调净化系统;Tween-80、聚氧乙烯氢化蓖麻油等增溶剂,用量较大时可能产生溶血现象。
基于QbD理念的注射剂处方设计可有效评估各类辅料对制剂CQA和QTPP的影响程度,在保证质量安全的前提下优化制剂处方。
如在环孢素A纳米乳液研发中,ZIDAN等运用QbD理念,采用三因素三水平响应面法评估表面活性剂蓖麻油聚氧乙烯醚(Emulphor El-620)、助表面活性剂单辛酸甘油酯(Capmul MCM-C8)和油相甜橙油的用量对预设CQA的影响,最终获得了优化的制剂处方。
GIROTRA等利用改性的双乳液溶剂扩散技术制备纳米粒,采用2^4全因子设计试验考察了制剂处方中泊洛沙姆188浓度、聚乳酸-羟基乙酸共聚物(PLGA)浓度、聚乙烯醇(PVA)浓度、有机相/水相比例等对纳米粒粒径、包封率和释药速率的影响,最终成功制备了用于脑部药物递送的佐米曲普坦纳米粒。
确定药品生产过程中的CPP及其对CQA的影响对于新药和仿制药的开发和质量控制同样至关重要。
注射剂生产工艺通常包括原辅料前处理、制水与配液、过滤与灭菌、灌装与成型等环节,各生产流程中的CPP不尽相同。
在原辅料前处理环节,原辅料来源、包材相容性等可作为关键风险控制点重点考察。研究表明,注射剂中加入的Tween-80会导致一次性聚氯乙烯(PVC)输液器中增塑剂邻苯二甲酸二辛酯(DEHP)浸出量的增加,进而危害人体健康。因此在考察含Tween-80注射液与含DEHP输液器相容性的试验中,毒性物质DEHP的浸出量与每日允许最大暴露量(permitted daily exposure,PDE)间的差值是制剂安全性评估的重点。
在制水与配液、过滤与灭菌环节,无菌和无热原则是风险控制的重点。定期检测制药用水的水质、对管道进行清洗消毒,可有效降低微生物污染的可能性。
采用“最终灭菌”的产品(以输液剂和水针剂为主),灭菌设备及其参数控制情况是风险评估的主要对象。滤膜型号和材质的选择、连接方式、除菌滤器的上下游压差、生产关键步骤的时间等项目则可作为采用“过滤除菌”或“无菌分装”的注射剂产品的关键风险控制点。
注射剂无菌、灭菌工艺的选择是综合产品性质、灭菌后制剂的稳定性与安全性等多方面因素确定的。
例如SCHMITT等以利多卡因为模型药物,设计开发了一种可持续释药的PLGA/聚乙二醇(PEG)载药系统——可注射用聚合物糊剂(injectable polymeric paste,IPP)。考虑到IPP特殊的非水环境,研究人员选择了电子束辐照灭菌处理工艺,并通过一系列试验筛选确定了最终辐照水平,可保障制剂无菌和无热原的要求。
2.3 过程理解阶段——制定控制策略,全生命周期监管与持续改进
完善统一各剂型论述框架是2020年版ChP四部增修订的一大亮点,其对上版药典中大多数剂型缺乏的工艺与技术方面的阐述进行了补充,并对原辅料、工艺与技术、质量与控制、包装与使用、贮存与运输等5个方面的技术要点进行了明确规定,还强调对注射剂进行全生命周期监管。
制定QbD控制策略能对制剂产品的整个生产流程进行全方位控制,以确保生产出符合质量要求、工艺稳健的制剂产品。
与传统质量控制策略不同,QbD控制策略更多强调的是动态化、过程化。
合理的QbD控制策略是要运用合适的分析技术实时监测关键工艺参数的变化,及时发现存在异常波动的工艺状态。
合适的分析技术对于确保整个QbD过程取得成功至关重要。
PAT概念是美国注册分析化学师协会于1993年首次提出的。2004年美国FDA发布的PAT指南(Guidance for industry: PAT-a framework for innovative pharmaceutical development,manufacturing,and quality assurance)正式拉开了PAT在制药行业中应用的序幕,研发和创新的重点逐渐转移到了制造过程中实时分析方法的开发上来。
PAT是一个集设计、过程分析和生产控制为一体的质量控制系统,通过实时检测生产过程中原辅料、制剂中间体等的关键质量指标与性能特征来保障最终制剂产品的质量。
常用的PAT工具主要有近红外光谱、拉曼光谱等。此外,共振声谱、光声光谱等PAT工具均可用于注射剂的生产过程控制,如表4所示。

不同PAT工具的应用范围及优缺点不同,实际应用时常采用多种工具联用来对注射剂生产过程进行全方位的监测与控制。
不溶性微粒是导致注射剂不良事件频发的主要因素之一,常被确定为注射剂CQA。KRISHNA等联用红外光谱、拉曼光谱、X射线光电子能谱、扫描电镜-能量散射光谱、电感耦合等离子体-质谱等多种分析工具对布洛芬注射剂中的不溶性微粒进行全面研究,确定了微粒数量及来源,为后续布洛芬注射剂的工艺开发提供了理论依据。
DEBEER等以5%甘露醇溶液作为冻干模型,联用拉曼光谱法和近红外光谱法实时监控冻干产品质量。拉曼光谱法可监测冷冻过程并对中间产物和终产物进行表征,近红外光谱则可监测干燥过程。拉曼光谱和近红外光谱的联用实现了PAT工具间的互补,且同时使用2个过程分析器可对冷冻干燥过程进行连续且几乎完整的监控,便于干预异常波动以避免批次损失。
注射剂作为高风险药品,除对生产过程具有高要求外,贮存、流通、使用等环节的过程控制同样值得制药企业投入更多关注。
3 新形势下注射剂研发的关注点
自我国第一款自主研发的注射剂——柴胡注射液成功上市以来,我国注射剂工业呈现出技术由易到难、规模由小到大、质量要求越发严苛的发展态势,品种由单纯的氯化钠注射液、葡萄糖注射液等附加价值低的产品转向微球、脂质体注射液等高附加值、高收益的特殊复杂注射剂。
以《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》为起始点的仿制药一致性评价工作开展至今已有4年,注射剂一致性评价工作也已于今年5月14日正式拉开帷幕。
2020年版ChP作为我国保障药品质量的法定标准,在药品研发、生产、流通和应用中发挥着重要作用。新版药典的增修订为注射剂的新药研发与仿制药一致性评价工作指引了研究方向。
3.1 全面审计和评估“原辅包”材料的质量
注射剂因其特有的给药方式,对原料药、辅料和包装材料的质量要求相较于其他剂型更高。
2015年版ChP中,共收录大豆油(供注射用)、大豆磷脂(供注射用)等13种、14项注射用原辅料;2020年版对其中10项进行了修订,注射用辅料标准进一步提高。
不仅注射用原辅料要满足ChP的要求;而且根据特定品种的工艺生产特点,还要对影响终产品QTPP的关键原辅料进行合理内控,尤其应关注特殊辅料的加入对注射剂质量的影响。
同时在注射剂处方设计时应参考《关于调整原料药、药用辅料和药包材审评审批事项的公告》要求,对原辅料的来源和质量进行全面审计和评估,建立完善的针对“原辅包”生产企业产品质量的审计、核查监控体系,提高产品质量自查纠错能力,以确保后续制剂生产企业制剂产品商业化生产的稳定性,加强对注射剂质量的全生命周期监管。
3.2 关注注射剂的关键“风险控制点”
近年来,国家多次发布与注射剂相关的公告文件,逐步规范国内注射剂市场,提高注射剂质量。
2020年版ChP针对注射用无菌粉末、注射用浓溶液等非最终制剂产品新增了配制后的质量控制要求,提示广大生产企业应全面关注并执行制剂生产质量控制,根据自身产品特点,以经评估确定的CQA为主要考察指标,针对性地进行全面详细的工艺研究,密切关注注射剂生产中的关键“风险控制点”,如过滤过程的参数设置、灭菌条件和装载情况、生产过程中光线及残氧量等影响因素的控制、药品装量等,以提升药品质量为目标,全面加强风险防控与质量管理,提高企业自身的风险防范意识与能力。
除对注射剂单一剂型的要求提升外,2020年版ChP四部制剂通则中新增了“包装与贮藏”论述,这一变化同样值得制剂生产企业广泛关注。
相较于生产环节的质量控制而言,流通贮藏环节的质量控制难度更高。
如光敏型药物对贮藏条件的要求较为严苛,除采用常规的遮光型包装材料外,还应关注到贮藏、流通时光照条件对药品稳定性的影响;生物制品中的活性成分易受所处环境如温度、光照等影响而活性降低甚至消失,对药品质量安全造成不良影响,流通环节可考虑冷链避光运输。
要合理运用稳定性试验等获得的重要试验数据,充分考虑流通过程中的运输路线、交通工具、产品包装及放置条件等对注射剂稳定性的影响,关注每个关键环节的量值传递规律,从而实现对药品全生命周期的有效监管与控制,防范与化解注射剂使用时的重大风险隐患。
通过弹性调控并持续改进药品生产的技术路线,可降低药品的生产和贮藏成本,并进一步保证注射剂产品质量。
随着一致性评价工作的深入开展,注射剂仿制药的研发成本攀升,一款注射剂仿制药上市的背后是高人力成本和经济成本以及微不足道的收益。
我国制剂生产企业只有不拘泥于药典标准,谋求更高的企业内部标准,在开展仿制药研发的同时瞄准临床需求,及时追踪潜力药物开发现状,开发制剂新技术,才能在制药全球化的潮流中占据优势地位。
4 结语
随着“十三五”时期供给侧改革的持续深入进行,“4+7”药品带量采购初见成效,我国医药产业进入转型“阵痛期”,大量低附加值的小型药品生产企业面临淘汰风险。如何根据自身产品特点,准确把握注射剂生产中的关键“风险控制点”,在产品设计之初就规避产品同质化问题,提高自身产品的行业竞争力,是广大医药企业应关注的重点。
ChP标准的不断提高标志着国民用药水平、我国医药产业水平和国家监督检验水平的提高。
新时期、新要求、新机遇,制剂生产企业必须在准确把握新版药典标准的基础上,严格对照新版药典的增修订内容,及时改进技术路线,以药典标准为基线制定企业内控标准,全面提升产品质量和核心竞争力,更好地保障公众健康,积极推动我国医药产业的蓬勃健康发展。

来源:铭研医药


