生产具有一致质量的重组腺相关病毒 (rAAV) 的上、下游工艺的优化取决于快速表征关键质量属性 (CQA) 的能力。在 rAAV 生产的背景下,病毒滴度、衣壳含量和聚体被确定为潜在的 CQA,影响 rAAV 介导的基因治疗产品的效力、纯度和安全性。尽管快速、高通量的方法开始被开发和商业化,检测这些属性的分析方法通常会因工艺开发的周转时间长或产量低而受到影响。这些方法尚未在学术或工业实践中得到很好的确立,支持性数据也很少。在这里,我们回顾了已建立和即将推出的 rAAV 质量属性定量检测分析方法。在评估每种方法时,我们强调 rAAV 快速在线表征的进展。此外,我们发现从传统方法过渡到新方法的一个关键挑战是后者缺乏学术和工业经验。这篇文献综述可作为选择针对质量属性的分析方法的指南,以在rAAV 介导的基因疗法的工艺开发过程中进行快速、高通量的过程表征。
重组腺相关病毒 (rAAV) 被广泛用作体内基因治疗的载体,主要是因为它们对人类无致病性、低免疫原性和长期基因表达。美国食品药品监督管理局 (FDA) 已经批准了两种基于 rAAV 的基因疗法,用于治疗罕见的单基因疾病:脊髓性肌萎缩症 (Zolgensma) 和 Leber 先天性黑蒙 (Luxturna)。此外,基于 rAAV 的基因疗法目前正在 200 多项临床试验中进行研究,用于治疗从肿瘤到神经系统疾病的一系列疾病。随着rAAV 的临床潜力得到认可,在不影响效力、纯度和安全性的情况下规模放大其生物生产过程的挑战变得越来越受重视。
生物药生产平台的开发需要识别产品的关键质量属性 (CQA) 并表征 CQA 与工艺参数之间的功能关系。CQA 被定义为“一种物理、化学、生物或微生物特性或特点,其应处于适当的限度、范围或分布内,以确保所需的产品质量”,CQA 是一种属性 - 广泛对应于产品的特性、效力、纯度或安全性 - 如果超出其目标范围,将对产品质量和功效产生严重影响。工艺参数变化对这些 CQA 的影响的表征,例如通过使用实验设计,提高了对工艺的理解,使其得以优化,并最终通过设计确保产品质量(表 1)。对于生物药,如 rAAV,药物底物的属性(例如,一致性)和杂质知识 - 无论是与产品相关的(例如,非活性产品异构体和聚体)还是与工艺相关的(例如,宿主细胞蛋白或 DNA) - 帮助在开发早期识别CQA。尽管与工艺相关的属性并不是 rAAV 生产所独有的,但与 rAAV 产品或产品相关杂质有关的 CQA 才刚刚开始被明确识别。在这篇综述中,我们重点关注 rAAV 生产的生产力、病毒滴度、具有完整基因组的衣壳的比例(含量比)以及聚集衣壳的数量,基于它们对产品安全性和功效的影响而可作为潜在的CQA。
表1. 与工艺开发相关的重要术语的定义
rAAV的质量属性通常使用耗时的质量控制检测进行分析,以对最终产品进行批次放行测试,确保它们符合安全使用的监管规范。然而,此类产品开发时间短,需要具有快速周转和高通量的经济分析方法。例如,用于早期筛选 rAAV 生产平台的部分因子设计(三个级别的五个工艺参数)需要对实验进行快速、高度并行的分析。这种通量不可避免地会导致大多数已建立的质量控制分析的分析能力出现瓶颈。或者,快速、高通量的分析方法可以迅速产生可操作的结果,促进对过程的理解并加快开发决策。然而,有限的样品数量和基质效应(例如,缓冲液特性、残留 DNA 或蛋白质以及离子强度)对工艺开发中的此类方法提出了挑战。通常,实验室规模的生产仅可获得几毫升 (mL) 的纯化 rAAV - 相当于1012-1014 载体基因组 (vg) - 因此分析所需的样本量可能会导致产品的显著损失。同时,样品中的病毒浓度涵盖多个数量级,从粗培养收获液的 1010 - 1011 vg/mL 到纯化产物中的 1013 - 1014 vg/mL,并且样品基质变化很大,在最初的下游步骤中,残留的副产物、宿主细胞蛋白和 DNA的质量浓度比 rAAV 高 10 - 100 倍。这种过量的残留副产物限制了特异性不足的方法的适用性,除非进行了大量的样品纯化工作。
在本文中,我们首先介绍基因组和衣壳滴度、含量比率和聚体含量这三个质量属性,用于表征 rAAV 中产生的主要衣壳类型(图 1)。为了将这些质量属性确定为 CQA,我们将概述它们在常见生产过程中的可变性以及它们对 rAAV 产品安全性和有效性的一般影响。然后,我们在工艺开发的背景下讨论它们作为 CQA 的优点和缺点。最后,我们将介绍当前最先进的、用于表征 rAAVCQA的分析方法,并为进一步的方法开发提出建议。
rAAV的产品相关CQA
作为第一个潜在的 CQA,病毒滴度或浓度是指感染性、基因组或衣壳滴度(图 2)。在这里,我们将关注基因组和衣壳滴度,因为从工艺开发的角度来看,它们实际上是可测量的。基因组滴度代表包含载体基因组(即病毒体)的衣壳,估计样品的效力,被主要用于 rAAV 临床给药剂量的确定。相反,衣壳滴度代表所有衣壳,与包含的基因组无关。总衣壳的定量对于下游回收或纯化工艺的操作和优化至关重要,这些工艺取决于产品的上样而不是其效力,例如,制备型层析柱的上样,或柱馏分的合并。此外,衣壳往往会聚集,这取决于它们的总浓度和环境条件,例如温度、离子强度和 pH 值。因此,根据所考虑的工艺单元,基因组和衣壳滴度都可以指示产品的效力、安全性和功效。相比之下,感染性滴度(一种体外生物活性的量度)需要 1-3 天才能量化,并表现出多个数量级的可变性;因此,及时表征产品效力是不切实际的。其定量方法基于端点稀释测定、感染中心测定和转基因表达测定,这些方法将不在本文中进行讨论。
含量比,作为第二个潜在的 CQA,是指病毒衣壳缺失或具有部分基因组的比例,分别称为空衣壳或部分包裹衣壳,代表rAAV 生产中最常见的产品相关杂质(图 1)。不同的因素,例如载体基因组的长度和类型(即单链或自互补),会导致没有预期载体基因组的衣壳总比例的差异性。此外,生产平台的选择和质粒的大小会影响非转基因序列的反向包裹,导致不同程度地产生部分包裹 DNA 杂质的不希望的衣壳亚群。空衣壳,以及带有非转基因序列的衣壳,可以引发不必要的免疫反应并竞争载体结合位点,增加免疫毒性的风险并降低完整衣壳的转导率,这是产品功效所必需的。完整衣壳与所有衣壳的比率,称为含量比,在收获时的生产培养物中可以从 <1% 到 30% 不等,并且在不同批次的生产运行之间不一致(图 1)。含量比影响工艺效率和产品纯度,最近已将含量比添加到基于病毒的基因疗法的监管产品规范中,并且是工艺开发中的一个重要质量属性。与空衣壳不同,部分包裹的衣壳和带有宿主细胞/质粒 DNA 的完整衣壳可能具有额外的基因毒性作用,具体取决于包裹的基因组的类型。除了空的和部分包裹的衣壳外,其它杂质也可能导致免疫或基因毒性作用,例如残留的辅助病毒(来自上游转导步骤)、残留的蛋白质(来自宿主细胞或细胞培养基),或核酸(宿主细胞 DNA/RNA)。
作为第三个潜在 CQA 的衣壳聚体代表了另一种与产品相关的杂质,对载体产品的安全性和长期稳定性产生不利影响,因为即使是痕量水平(例如,<1%)也为进一步聚集提供了成核位点。rAAV 制剂中存在小的低聚物(d < 100 nm)和大的、亚可见聚集体(d > 100 nm),并且样品基质中的高浓度衣壳、残留核酸或低离子强度被证明有助于rAAV2 的聚集。因此,聚集可能发生在下游工艺中存在这些条件的多个节点,例如,在浓缩步骤期间或作为缓冲液置换的结果。为确保产品安全,需要尽量减少聚集程度并确定影响该产品属性的工艺条件。
图 1. rAAV 生产过程中产生的主要衣壳类型概述:所有衣壳的比例结果包括在收获时rAAV 生产培养液(“收获液”),例如,在任何纯化之前的细胞裂解液中,以及在产品中纯化后(“纯化液”)中,即在从细胞裂解液中纯化完整衣壳之后,但在将完整衣壳与空衣壳几乎完全分离的任何精纯步骤之前。数据基于报告的大规模 rAAV 生产的文献。根据大小(多聚体,d < 100 nm)或大(d > 100 nm)来识别聚体,其含量与商业纯化的 rAAV 产品相同。
图 2. rAAV 样品的传染性、基因组和衣壳滴度之间的差异:生产过程中滴度的常见范围以其常用单位给出,基于报告的大规模 rAAV生产的文献。
分析方法在质量属性表征中的表现
分析方法必须具备一系列特性,以证明其适用于其预期目的(即方法确认和验证),以及满足工艺开发中的特定需求(表 3)。对于后者,这些特性还可能包括适用于近线(at-line)或入线(in-line)应用。与需要将样品从采样点移至实验室环境的离线(off-line)分析相比,能够近线或入线应用的方法有助于使用靠近采样点(近线)或直接集成到工艺本身(入线)。工艺开发中使用的方法不要求基于分析程序验证监管指南中定义的特征对分析方法进行确认和验证。尽管如此,这些特征中的大多数,例如准确度、精确度和特异性,仍然适用,因为通常在开发的早期阶段使用这些特征来对检测进行确认。对于后期开发阶段以及认证生产所使用的分析,需要基于监管指南进行全面分析验证,而不仅是质量确认。表 4 总结了本综述中讨论的分析方法的上述特征,表 5 列出了关键结论。
表3. 与方法确认、验证和工艺开发需求相关的分析方法的特征
表4. 本文讨论的分析方法的最重要性能标准的数据
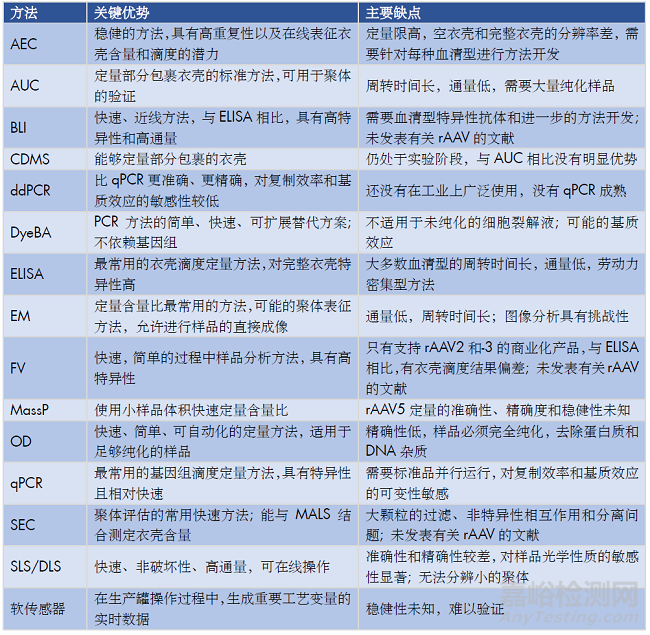
表5. 每种分析方法的主要优点和缺点
原文:A.L.Gimpel, G.Katsikis, S.Sha, et al., Analytical methods for process and product characterization of recombinant adeno-associated virus-based gene therapies. Molecular Therapy: Methods & Clinical Developmen, 2021, 20.
参考资料
【1】《基因治疗研发和生产外包服务市场研究报告》,弗若斯特沙利文咨询公司,2021年5月
【2】《基因治疗的研究进展》,中国细胞生物学学报,2020年4月
【3】《2022基因治疗行业研究报告》,动脉网、蛋壳研究院,2022年6月