2020年2月,为了支持仅以电子格式提供510(k)递交文件的过渡,CDRH开发并试行eSTAR。
2020年9月,CDRH将eSTAR的使用范围扩大到所有未递交组合产品的510(k)递交者。随后,2021年9月,FDA发布了一份电子递交模板指南草案。
2022年7月,FDA推行以电子方式上传由CDRH主导的510(k)和De Novo的eSTAR和eCopy格式的上市前医疗器械递交文件,以最终取代制作包含eSTAR或eCopy文件的任何光盘(CD)、数字视频光盘(DVD)或闪存驱动器并将其邮寄给FDA的需求。自2022年7月18日起,客户协作门户网站的进度跟踪器的现有用户(如510(k)递交的官方通讯员)可以试用这个新的电子递交方式,并向FDA提供有关该工具的关键用户反馈。
2022年9月22日,FDA发布了最终指南,即Electronic Submission Template for Medical Device 510(k) Submissions,指南指出,自2023年10月1日起,所有510(k) 递交文件,除非获得豁免,否则必须使用eSTAR电子文档形式递交。
也就是说,FDA对于在2023年10月1日之前收到的510(k) 递交文件,FDA接受通过以下两种方式之一递交eCopy或eSTAR格式的510(k) 递交文件:
*线下快递邮寄:保存在电子存储介质中并邮寄给FDA;或
*线上发送电子版510(k)文档;
但是2023年10月1日之后,只能使用线上eSTAR电子方式递交510(k)。
2022年10月3日,FDA宣布可以通过CDRH客户协作门户("CDRH Portal")在线发送eCopy或eSTAR上市前递交文档,即允许任何人通过注册一个CDRH Portal的账号来线上发送CDRH eCopy或eSTAR。
eSTAR是什么呢?
eSTAR的英文全称是electronic Submission Template And Resource,它是构建在结构化动态PDF中的电子提交模板,它将510(k)递交内容都自动化嵌入到一个PDF文档中,并包含从IMDRF文件以及监管文件(如指南)中提取的监管信息。它可以指导准备510(k)递交文档,申请人在建立、查看和编辑510(k)时可以使用更多动态功能,能够组织很复杂的信息。
eSTAR是目前唯一一种电子提交模板。为了简单起见,使用此电子递交模板创建的电子递交通常被称为eSTAR。
eSTAR旨在通过帮助确保提交者为CDRH的上市前审查提供高质量、全面的数据,提高各种医疗器械的提交质量。通过标准化的格式,提交者可以确保其提交内容完整,CDRH可以更有效地进行上市前审查,以帮助及时获得安全、有效和高质量的医疗器械。
eSTAR 电子递交的特点有哪些?
1. 界面直观;
2. 无需安装特殊软件;
3. 支持图像和动态信息;
4. 支持移动设备和iOS系统;
5. 递交内容结构具有指导性;
6. 可以自动验证,不需进行RTA,但是这取决于对每项内容的准确答复,FDA会验证答复的准确性,回答不准确可能会导致递交审核提前暂停,即,如果问题的任何附件都与问题无关,或者如果对任何问题的答复不准确,则递交文件可能会提前进行技术审查,要求纠正这些不足之处;
7. eSTAR PDF不需要遵守eCopy指南文件,也不需要压缩并放在MISC FILES文件夹中,但是,与eSTAR PDF一起提供的任何其他文件都需要遵守eCopy指南文件;
8. eSTAR无需提供的IFU声明(FDA 3881表格)、上市前审查递交封面(FDA 3514表格)或符合性声明(如适用),因为所有这些都内置在eSTAR PDF中。此外,如果您选择使用eSTAR创建510(k) Summary,则无需在eSTAR中提供额外的510(k) Summary。
目前有哪些递交类型支持eSTAR电子递交?
医疗器械和体外诊断医疗器械的510(k) 和 Novo递交,支持eSTAR电子递交。
如何使用eSTAR准备递交文档?
1. 下载正确的eSTAR PDF模板并保存,然后在Adobe Acrobat Pro中打开它。
2. 阅读、理解并遵循eSTAR PDF模板的Introduction, Key, FAQ, 以及 Version History部分中的说明。
3. 相应地填写模板。该模板仅用于构建而不是提交您的递交文档。模板末尾的说明提供了如何提交的说明。
请注意:如果eSTAR PDF的大小超过1 GB,则提交的处理可能会延迟;如果可能,请合并类似内容的附件(例如,软件需求规范),以便仅需要为eSTAR中的每个附件类型问题提供一个附件。
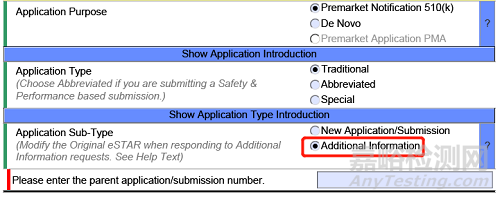
如何递交对AI请求的回复文件?
修改您的原始eSTAR,并在eSTAR的“申请/递交类型”部分指出,申请子类型是对AI请求的回复。在您表示打算对FDA的AI请求作出回复后,eSTAR末尾将出现一个附加部分,您可以在该部分对AI请求进行回复。

510(k) 递交、审核过程中豁免eSTAR情形有哪些?
目前,FDA豁免以下510(k)递交文件/信息的510(k)电子提交要求:
※交互式审查答复;
※修正:
· 监督审查的上诉/请求;
· 实质性简要请求;
· 相应修正的变更;和
· 最终决定后的修改(即,add-to-files)。
备注:如果FDA审核员通过电话或电子邮件进行交互式审核,递交者应通过电子邮件向审核员回复所需附件和附加信息。对AI请求的其他回复必须以eSTAR提交,应在eSTAR的相应章节中包含FDA审查信息的实际变更(例如,Labeling章节中应包含更新的labeling草稿)。
与eSTAR提交相关的MDUFA用户费用是多少?
eSTAR递交与递交类型相关联,具体用户费用,请见之前的微信文章:
美国FDA评审费涨幅56%,小企业助力节省75%
如何线上递交eSTAR文档?
通过CDRH客户协作门户("CDRH Portal")在线发送eSTAR上市前递交文档,需先注册一个客户协作门户的账户,即CCP账户,网址如下:
https://www.fda.gov/medical-devices/industry-medical-devices/send-and-track-medical-device-premarket-submissions-online-cdrh-portal
如何线下快递邮寄递交eSTAR文档?
通过邮寄快递,向CDRH文件控制中心(DCC)提交eSTAR:
目前DCC邮寄地址如下:
eSTAR审查时长是多久?
在FDA收到eSTAR递交文件后,尽管eSTAR不会有RTA过程,但是FDA会对eSTAR进行病毒扫描和技术筛查(预计在收到510(k) eSTAR后15天内进行)。
如果递交的eSTAR不完整,FDA将通过电子邮件通知递交者,并告知不完整的信息,递交文件将被搁置180天或直到向FDA递交完整的替代eSTAR。
以上就是FDA eSTAR---医疗器械510(k)电子提交的具体要求