近期,西南交通大学的鲁雄教授、谢超鸣研究员团队、四川大学的赵志河教授、王军教授在科爱出版创办的期刊Bioactive Materials上联合发表研究文章:针对在糖尿病条件下牙周骨组织修复困难的问题,本研究基于仿贻贝细胞粘附机理,开发了一种包含聚多巴胺还原氧化石墨烯(PGO)和聚多巴胺修饰羟基磷灰石纳米颗粒(PHA)的电活性海藻酸盐/明胶支架用于糖尿病牙周骨缺损的修复。PHA赋予支架骨诱导性,PGO为支架提供导电通路。电活性支架通过向干细胞传递内源性电信号并激活Ca2+通道来促进骨再生。此外,聚多巴胺的酚羟基通过糖酵解通路和RhoA/ROCK通路抑制M1巨噬细胞极化,激活M2巨噬细胞。由于支架的电活性、活性氧清除能力、抗炎和免疫调节能力协同作用,促进了糖尿病牙周炎症微环境中的牙槽骨缺损再生,为设计免疫调节生物材料治疗免疫相关疾病和组织再生提供了一种新的策略。
研究内容简介
牙周炎是一种常见的慢性炎症性疾病,可导致牙周组织破坏,主要包括牙槽骨缺损和牙龈萎缩。尤其在糖尿病条件下,糖尿病会加重炎症,过度激活破骨细胞(加剧骨吸收),并通过降低促进骨再生的生长因子表达来损害牙周炎中的骨偶联。高水平的葡萄糖会触发激活免疫细胞趋化因子的产生。长期炎症状态会诱导晚期糖基化终产物和活性氧的产生,从而导致局部牙周微环境中炎症因子的过度表达。此外,糖尿病与M1型巨噬细胞的长时间极化有关,后者可诱导慢性炎症。因此,局部免疫反应的调节对于糖尿病患者的牙周骨再生非常重要。
贻贝启发的聚多巴胺(PDA)被认为是一种很有前途的抗氧化剂,通过清除活性氧和下调炎症介质来降低氧化应激。据报道,PDA也具有免疫调节能力。该团队前期研究表明,基于PDA的导电丝纤维贴片通过促进细胞粘附、减轻炎症、缓解氧化应激和重塑细胞外基质(ECM)来加速糖尿病伤口愈合。有趣的是,该导电贴片将电信号传递给细胞,伤口愈合的质量得到了改善。同理,内源性电信号也可促进骨再生。
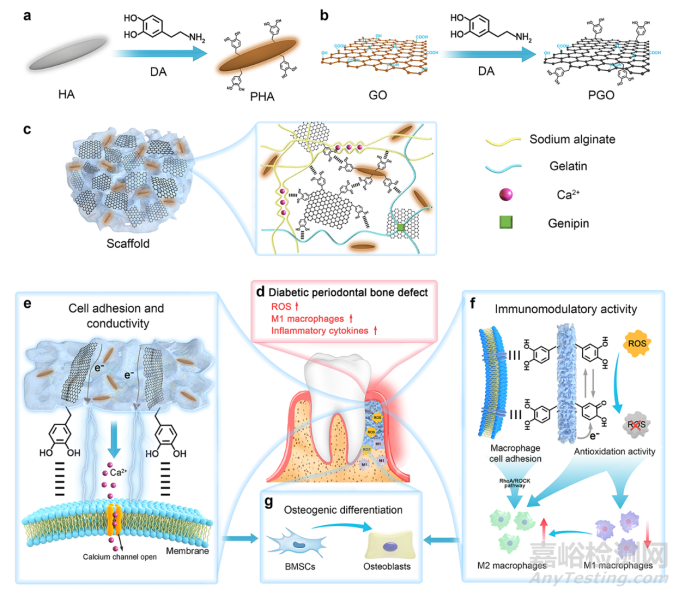
基于以上目的,本研究中该团队设计了一种导电海藻酸钠/明胶(AG)支架,以调节糖尿病牙周炎症微环境,促进牙周骨缺损再生。PGO-PHA-AG复合支架的设计思路及其在牙周骨缺损中的修复机理如图1所示:该支架包含PGO和PHA两种纳米颗粒(图1a,b)。PDA的特性使PHA和PGO能够很好地分散在AG网络中,最终得到用于糖尿病牙周骨缺损的电活性支架(图1c,d)。支架中的PGO提供了一条导电通路,使支架具有电活性。通过电活性,支架将内源性电信号传递给细胞,从而激活细胞表面的钙离子通道(图1e)。PDA对细胞的粘附能力和ROS清除特性协同赋予支架免疫调节能力,即降低巨噬细胞的M1向极化以下调炎性因子的表达,并促进巨噬细胞极化为M2型(图1f)。最终PGO-PHA-AG复合支架的电活性和免疫调节能力协同促进糖尿病牙周炎症微环境中的牙槽骨缺损再生(图1g)。
图1 用于糖尿病牙周骨缺损再生的具有多功能特性的PGO-PHA-AG支架合成示意图。(a)PHA合成示意图。(b)PGO合成示意图。(c)物理化学双交联PGO-PHA-AG支架网络中的相互作用方式。(d)糖尿病牙周微环境中ROS、M1型巨噬细胞和炎性因子过度表达。(e)该支架促进细胞粘附,将内源性电信号传递给细胞,进而激活钙离子通道。(f)PDA的细胞粘附能力和ROS清除能力赋予支架免疫调节能力,降低巨噬细胞向M1型方向极化,促进巨噬细胞向M2型巨噬细胞方向极化并分泌成骨相关细胞因子。(g)支架的电活性和免疫调节能力协同促进糖尿病牙周骨缺损再生。
一、PGO-PHA-AG支架具有良好的导电性能、力学性能、回复性、吸液能力
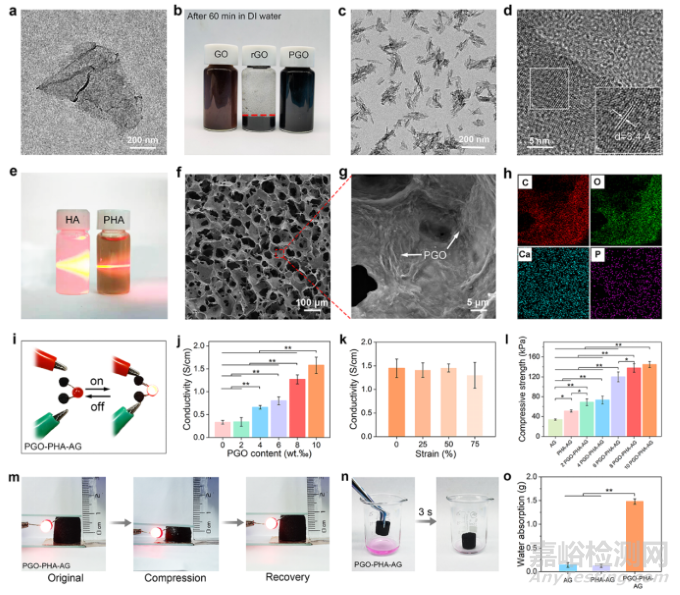
PDA功能化可加强PGO的导电性,PGO为支架提供了导电通路,使支架具有良好的导电性能。PHA和PGO纳米颗粒的纳米增强效应增加了支架的压缩强度。PGO的亲水性为支架带来优异的吸液能力(图2)。
图2 PGO、PHA、PGO-PHA-AG支架的表征。(a)PGO的TEM图像。(b)GO、rGO、PGO分散于去离子水中60分钟后的图像。(c)PHA的TEM和(d)高分辨TEM图像。(e)PHA表现出典型的丁达尔效应。(f, g)PGO-PHA-AG支架的SEM图像。(h)PGO-PHA-AG支架的EDS元素mapping图像。(i)PGO-PHA-AG支架接入电路并点亮发光二极管(LED)。(j)不同PGO含量的支架的电导率。(k)压缩PGO-PHA-AG支架后的电导率(0, 25, 50, 75%)。(l)AG支架、PHA-AG支架、PGO-PHA-AG支架的压缩强度。(m)对带有发光二极管的PGO-PHA-AG支架进行压缩,压缩应力去除后回复到初始形状。(n)将PGO-PHA-AG支架置于含罗丹明的去离子水中3秒。(o)AG、PHA-AG、PGO-PHA-AG支架的吸液能力。
二、PGO-PHA-AG支架具有良好的电活性、活性氧清除能力和免疫调节能力
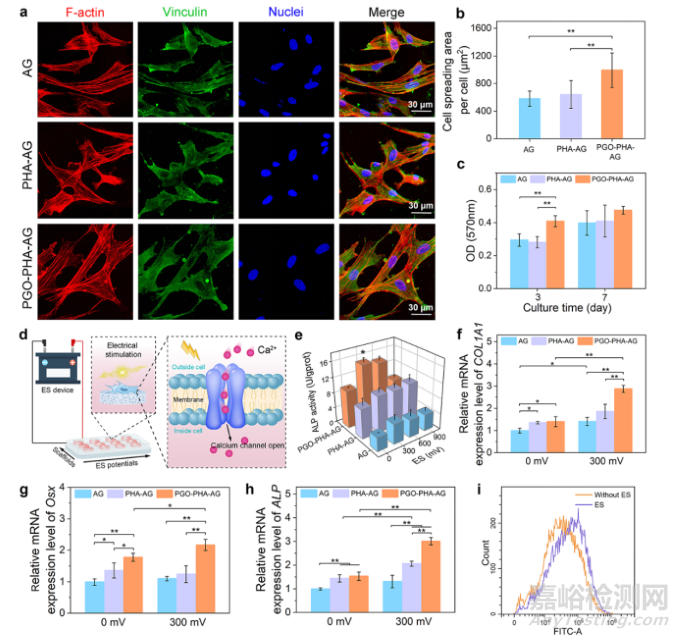
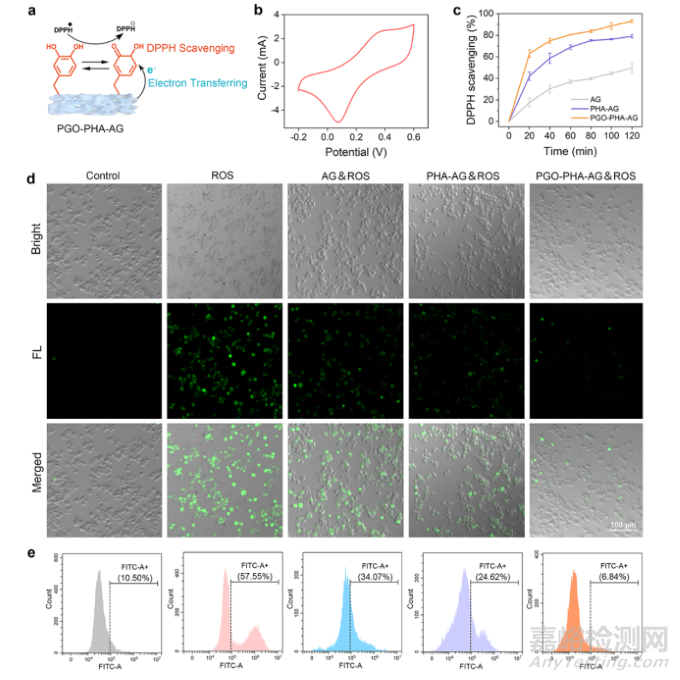
PGO-PHA-AG电活性支架是一个有前景的促干细胞成骨分化平台。PHA为支架提供骨诱导能力,PGO为支架提供导电通路。电刺激和PGO-PHA-AG支架协同促进BMSCs的成骨分化。PGO-PHA-AG支架将电信号传递给BMSCs,激活BMSCs表面的Ca2+通道,细胞内的Ca2+浓度增加,进而促进BMSCs的成骨分化(图3)。由于支架表面丰富的邻苯二酚基团和氧化还原性能,其可有效保护细胞免受过量ROS的损害(图4)。PGO-PHA-AG支架可调节巨噬细胞从M1型极化为M2型,并促进M2型巨噬细胞分泌成骨相关细胞因子(图5)。为探究支架对巨噬细胞的免疫调控机制,该团队对不同组的巨噬细胞进行转录组测序。结果发现支架一方面通过清除ROS抑制糖酵解通路减少M1型巨噬细胞,另一方面通过RhoA/ROCK信号通路激活巨噬细胞向M2型极化(图6)。
图3 支架表面的BMSCs的粘附和高通量电刺激。(a)BMSCs在AG、PHA-AG和PGO-PHA-AG支架表面的细胞形态。(b)BMSCs的细胞铺展面积。(c)培养3和7天后,BMSCs在不同支架上的增殖活性。(d)高通量电刺激的示意图。电活性支架向BMSCs传递电信号,导致Ca2+内流,最终促进BMSCs成骨分化。(e)在不同电压刺激下,14天后不同支架上的BMSCs碱性磷酸酶(ALP)活性。(f–h)培养14天后,有无电刺激对不同支架上的成骨相关基因表达的影响,包括I型胶原(COL1A1)、成骨细胞特异性转录因子(Osx)、碱性磷酸酶(ALP)。(i)通过流式细胞术检测异硫氰酸荧光素(FITC)通道中Fluo-4 探针标记的细胞,检测电刺激对PGO-PHA-AG支架上细胞内的Ca2+浓度的影响。
图4 PGO-PHA-AG支架的体外抗氧化性能。(a)PGO-PHA-AG支架的抗氧化能力的机制。(b)PGO-PHA-AG支架的循环伏安(CV)曲线。(c)不同支架清除DPPH自由基的效率。(d)不同支架清除细胞内ROS的性能。(e)通过流式细胞术检测FITC通道中DCFH-DA标记的细胞。
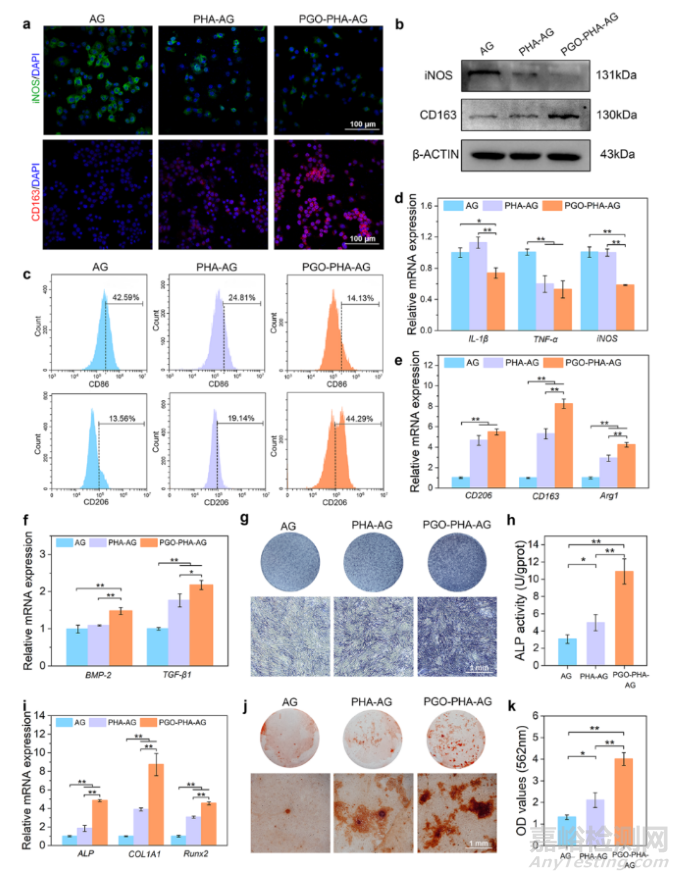
图5 PGO-PHA-AG支架对巨噬细胞的免疫调节能力。(a)和不同支架培养的巨噬细胞的诱导型一氧化氮合酶(iNOS)、CD163、细胞核的免疫荧光染色。(b)iNOS和CD163的免疫蛋白印迹分析。(c)通过流式细胞术检测CD86(M1型巨噬细胞)和CD206(M2型巨噬细胞)的表达来评估巨噬细胞的极化情况。(d)M1巨噬细胞相关基因表达,包括白细胞介素-1β(IL-1β)、肿瘤坏死因子-α (TNF-α)和iNOS。(e)M2巨噬细胞相关基因表达,包括CD206、CD163和精氨酸酶1(Arg1)。(f)巨噬细胞分泌的成骨相关基因,包括骨形态发生蛋白-2(BMP-2)和转化生长因子-β1(TGF-β1)。(g, h)巨噬细胞条件培养液培养7天后BMSCs的ALP染色和ALP活性定量分析。(i)在巨噬细胞条件培养液中培养7天后,BMSCs的成骨相关基因表达,包括ALP、COL1A1和Runx2。(j, k)巨噬细胞条件培养液培养14天后BMSCs的ARS染色和定量分析。
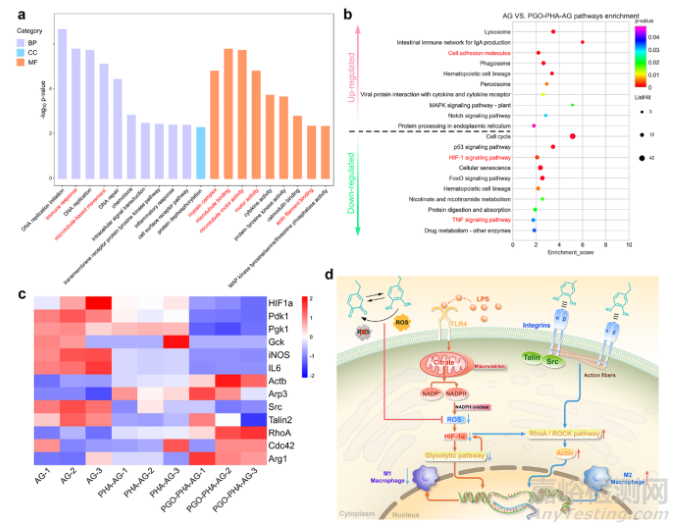
图6 PGO-PHA-AG支架诱导巨噬细胞极化的机制探究。(a)在AG和PGO-PHA-AG支架上培养的巨噬细胞的基因本体分析。BP:生物过程;CC:细胞成分;MF:分子功能。(b)AG与PGO-PHA-AG组的KEGG通路富集分析。(c)对涉及HIF-1信号通路、糖酵解通路、促炎细胞因子、细胞粘附分子、细胞骨架排列和机械传导的差异表达基因进行热图分析。(d)PGO-PHA-AG支架上巨噬细胞极化机制示意图。
三、PGO-PHA-AG在糖尿病牙周骨缺损模型中的促修复性能
基于支架良好的电活性、抗氧化活性、抗炎能力、免疫调节能力协同作用,该支架可加速糖尿病炎症条件下的牙周骨组织修复再生(图7和8),为设计免疫调节生物材料治疗免疫相关疾病和组织再生提供了一种新的策略。
图7 大鼠体内糖尿病牙周骨缺损修复。(a)支架植入糖尿病大鼠牙周骨缺损模型。(b)大鼠下颌骨植入部位的Micro-CT图像。(c)四组的骨密度(BMD)比较。(d)四组的骨体积与总体积的比率(BV/TV)比较。(e, f)植入后28天缺损区域的H&E和Masson染色。FT: 纤维组织;NB: 新骨;MB: 成熟骨。(g–l)植入后14天牙周缺损区域8-羟基脱氧鸟苷(8-OHdG)、4-羟基壬烯醛(4-HNE)和白细胞介素-6(IL-6)(红色)的免疫荧光染色和均一化荧光强度。
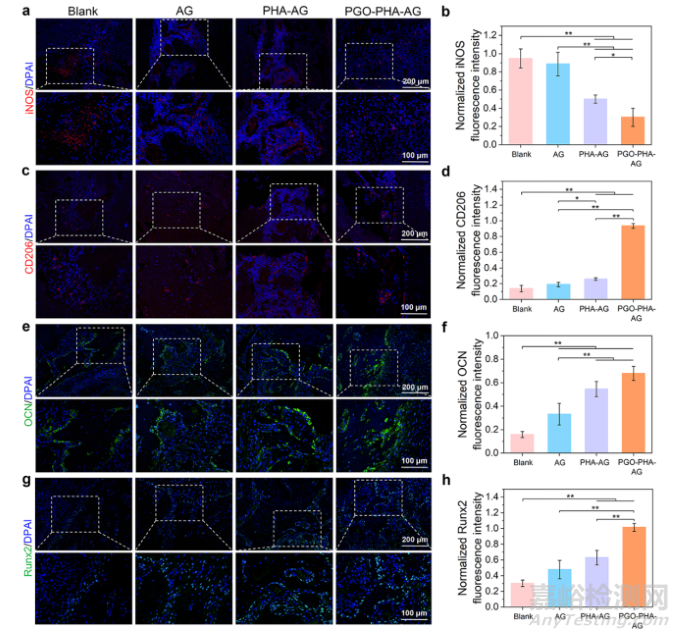
图8 缺损区域的免疫荧光染色。(a–d)缺损区域iNOS和CD206(红色)的免疫荧光染色,以及均一化荧光强度。(e–h)牙周缺损区域骨钙素(OCN)和Runt相关转录因子2(Runx2)(绿色)的免疫荧光染色,以及均一化荧光强度。