如何充分利用动物实验信息,以提高探索性临床试验的效率,一直是药物开发人员关心的重大课题。目前主要有三大应用场景:首次人体试验,最大起始推荐剂量(MRSD);II期剂量探索试验有效剂量范围的初步估算;通过给与人化剂量观测动物模型的有效性和安全性。前两种需要从动物剂量换算至人体剂量,后一种需要从人体剂量推算动物剂量。本文详细综述了几种动物和人剂量转换的几种方法,可以为业内人员提供有益的指导和帮助。
临床中人体起始剂量及其在物种间的转换是一个复杂的过程。在许多情况下,无法获得针对特定物种的初始药物剂量。种属之间的类推可用于从适当的动物数据预测人血浆药物浓度曲线和药代动力学参数。然而,通常的剂量转换假设仅基于体重是不合适的,因为生物化学功能系统在物种之间是不同的,并最终改变PK参数。从动物到人的剂量外推需要考虑体表面积、药理、生理和解剖因素、PK参数、代谢功能、受体和寿命,以确保临床试验的安全性。在众多因素中,体重和体表面积可用于剂量换算。
异速放大法(Allometric scaling)是一种经验方法,该方法依据临床前各种属的体内数据采用整体异速放大的方法来推测人体剂量。其中剂量的相互关系取决于剂量对身体表面积的标准化产生等效的生物效应的假设。异速放大法因其相对简单而得到了最广泛的应用;然而,由于它的经验性质,人们在使用它时应该谨慎。异速放大方法假设存在特定的特征,这些特征在物种之间是独一无二的,并考虑动物的PKs可能的差异。
1 FIRST-IN-HUMAN剂量
对于任何在临床前研究中成功表现出良好效果的治疗分子,在初始临床试验中选择首次人用(FIH)剂量都是临床药物开发的重要任务。重要的是要有一个理想和安全的人体起始剂量,因为高剂量可能导致严重的毒性,而低剂量可能会延长剂量上升过程,延迟临床结果,并增加在FIH临床试验中暴露于无效剂量的患者数量。
有许多方法可以确定FIH剂量,包括DOSE-BY-FACTOR(基于未观察到的不良反应水平[NOAELs])、药代动力学指导方法、最小预期生物效应水平(MABEL)、PK-PD模型、类似药物方法和微给药。欧洲药品管理局(EMA)建议,如果不同的方法对人体的安全剂量给出了不同的预计,那么应该考虑使用最低值作为FIH研究的起点。下文将重点阐述剂量因子法(DOSE-BY-FACTOR)。
DOSE-BY-FACTOR
图1 人体研究中预估起始剂量的示意图表示
剂量因子法(DOSE-BY-FACTOR)是一种常用的经验方法,从精心设计的动物毒理学研究的剂量-反应曲线关注药物的NOAEL。在这种方法中,剂量的选择是基于最小的毒性风险,而不是最小的人体药理活性。这种经验方法对作用于已确定靶点的新分子和/或具有相对成熟的药理学的新分子很有效。FDA 指南推荐剂量因子方法,其中使用异速生长因子调整的任何新药或生物疗法的 NOAEL(在动物中评估)用于估计健康人类受试者临床研究的最大推荐起始剂量(MRSD)。
这种方法考虑了每个物种体表面积的大小,这与它们的新陈代谢有关。此外,假设对体表面积进行归一化处理时,物种之间存在1:1的关系,从而确定MRSD。其他考虑的信息包括相关的临床前数据、药理活性剂量(PADs)、毒理学特征和 PKs 。一般来说,MRSD是根据临床前毒理学研究估计的,并进一步应用安全系数。用于预估人体研究中MRSD的五个步骤如图1所示。步骤包括确定动物物种的NOAEL,将NOAEL转化为人当量剂量(HED),选择物种,应用安全系数,最后考虑药理活性剂量(PADs)。
1 确定NOAEL
NOAEL是不会引起显著不良反应的最高剂量水平,是从典型动物毒性研究的剂量-反应曲线中得出的安全剂量水平。应在至少三种动物中确定NOAEL值,其中一种应是非啮齿类动物。
2 将NOAEL转换为人体当量剂量(HED)
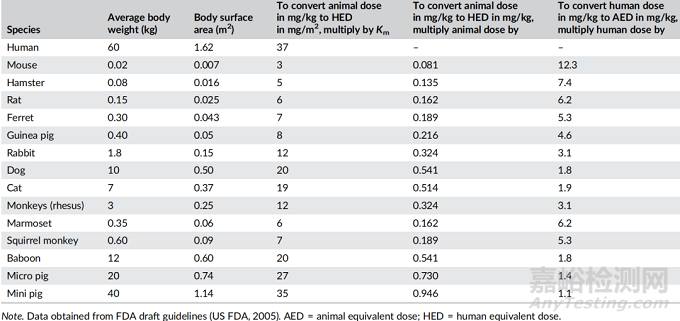
对体表面积的修正可能是有利的,因为它增加了安全值,并导致更保守的起始剂量。因此,在这一步中,NOAEL剂量转换为以体表面积为基础,使用表1所述的不同动物种属的适当比例因子进行HED换算。换算的概念是体表面积取决于动物体重(W),并随W0.67而变化,因此使用的换算系数为W0.67(Shin & Seol, 2010)。
动物种类的表面积(A)一般取A = KW0.67,其中K为常数,W为动物体重(g)。“K”值随物种的不同而改变,如小鼠(9),大鼠(9.6),豚鼠(9),兔子(10),犬(11),猫(8.7),猴子(11.8)。因此,体重为150克的大鼠,其表面积可计算为A = 9.6×1500.67= 275 cm2或0.0275m2。下面将详细介绍用不同方法测定HED。
表1 基于动物和人类的剂量转换
3 种属的选择
在接下来的步骤中,选择最适合估计HED的种属。在无法确定最合适的种属的情况下,使用HED最低的动物种属(被认为是最敏感的种属)来推导潜在的人类暴露参数。选择最优种属的关键因素是药物在不同种属之间的吸收、分布、代谢和排泄(ADME)和作用方式的差异。然而,人类的ADME可能不同,但基于体外研究比较的代谢数据可能是可用的,可以使用。
因此,还可以根据ADME选择特定的动物种属。并且,以前的研究表明,特定的动物种属更能预测人类对某一类药物的毒性,可以在确定动物种属时加以考虑。然而,对于某些药物,种属的选择需要额外的考虑,因此,具有最低HED的种属不是主要标准。在这种情况下,要考虑相关受体的表达、与毒性相关的生物化学和生理的相似性,以及药物有限的生物跨物种药理反应性等因素。
4 应用安全系数
观察到的HED进一步调整为乘以默认的安全系数,以提供第一剂临床用药的人体受试者足够的安全边际,此默认值可能不适用于所有情况。它可以在特定条件下增加或减少,以提供额外的安全保证,以保护FIH剂量。这一安全因素导致了外推的可变性、人类更大敏感性的不确定性、感知毒性的困难、受体密度或亲和力的变化、不可预测的毒性以及物种间ADME的差异。
当非临床安全数据审查中提及以下任何问题时,安全系数通常会增加(>10),这些问题包括陡峭的剂量-反应曲线、严重的毒性、可变的生物利用度、不可监测的毒性、无先兆体征的毒性、不可逆的毒性、无法解释的死亡率、剂量或血浆药物水平诱导作用的大变动性、非线性的PKs、剂量-反应数据不充分、新的治疗靶点、或者解释能力有限的动物模型。
反之,安全系数可以降低(<10),如药物具有良好的特征、通过相同的途径给药、或具有相似的代谢特征和生物利用度。如果包括人类在内的所有被测试物种的毒性特征是相当的,那么安全系数也可以降低;毒性易于监测、可逆和可预测,且与受测物种的毒性呈中-浅剂量-反应关系时安全系数也可降低。与建议的人类临床时间表相比,当毒性研究持续时间较长,并假设毒性是累积的,毒性与治疗浓度的急性峰值无关,且在重复剂量研究早期没有发生时,也可以考虑较低的安全系数。
5 考虑药理活性剂量
最后,将MRSD值与人的PAD进行比较。人类PAD的选择是考虑了很多因素,这些因素通常在药物类别和临床适应症之间有很大的差异。PAD被定义为在具有预期药理活性的动物物种中测试的最小剂量。一般来说,药物分子的PAD值是由动物研究或适当的药理学模型确定的。得到的MRSD(步骤4)可以用来比较从合适的药理学模型中得到的PAD值。
然而,我们可以使用体表面积转换因子从动物的PAD值来估计HED,然后与MRSD进行比较。如果HED小于MRSD,建议基于科学原因减少临床剂量。此外,对于某些种类的药物或生物制剂,可能由于夸大的药理作用而产生毒性。在这种情况下,PAD可能是比NOAEL更敏感的潜在毒性指标,因此需要降低MRSD。在临床实践中,通常建议开始时剂量要低于MRSD(美国FDA, 2005)。
2 应用和局限
剂量因子法的主要优点之一是它对小分子有良好的安全记录,而且易于使用。这种方法主要适用于全身用药。然而,当药物经鼻内、皮下或肌内给药时,需要额外考虑。另一方面,使用安全系数使得该方法非常保守。此外,这一程序不适用于生理浓度下使用的内源性激素和蛋白质以及疫苗。并且,它主要限于预期全身暴露的药物剂型,不涉及临床试验中的剂量上升或最大可吸收剂量。
3 基于剂量-体表面积归一化的转换
使用体表面积来转换物种间的剂量是一种经典的方法,主要是因为正常成人的血浆体积/总循环血浆蛋白与体表面积之间具有极好的相关性。在临床试验中,已发现体表面积异速标度对物种间剂量转换的影响可增加安全性。美国FDA还建议,只有通过体表面积的归一化,才能准确地进行物种间的剂量外推。确定HED的一般方程为: HED(mg/kg)= Animal NOAEL(mg/kg)×[Weightamimal(kg)/Weighthuman(kg)](1-b)。
一般来说,对于mg/m2归一化,“b”应为0.67。因此,使用[Weightanimal(kg)/Weighthuman(kg)]0.33在动物和人的体重范围内估计换算系数。例如,在体重185克的大鼠体内,已知NOAEL值(27 mg/kg)的新药分子的HED可以确定为:HED(mg/kg)= 27(mg/kg)×[0.185(kg)/60(kg)](0.33)=4(mg/kg)。此外,FIH可以通过HED来计算,即4(mg/kg)乘以人体体重(60kg)得到240mg(每人),然后除以安全系数(10)得到人体研究的初始剂量为24mg(每人)。另一方面,正常的种间mg/kg换算(不考虑体表面积)通常会导致显著高于按剂量因子法的HED。
4 根据mg/kg和mg/m2换算
剂量与体重之间的关系并不是影响剂量外推的唯一因素。通过使用修正因子Km,可以将mg/kg剂量转换为mg/m2剂量,从而实现剂量转换。用物种的平均体重(kg)除以其体表面积(m2)得到。因此,对人体来说,Km因子可以用平均体重(60公斤)除以体表面积(1.62 m2)得到37。
表1总结了通常用于评估HED的不同动物物种的Km因子值。以mg/kg为单位的动物剂量计算HED的公式如下: HED(mg/kg)= Animal dose (mg/kg)×(Animal Km/Human Km)。由于特定物种的Km因子是一个常数,因此使用Km比可以进一步简化上述方程。通过动物Km因子除以人类Km因子,可以很容易地得到表1中提到的Km比值的值。例如,小鼠的Km因子(3)除以人的Km因子(37),即0.081(表1)。
此外,对于小鼠NOAEL值为89 mg/kg的新药分子,可以通过将小鼠剂量(89 mg/kg)乘以Km比(0.081)来估计HED(mg/kg),即7.2 mg/kg。然而,Km因子在不同的动物种类中是不同的,并且在一个物种中,随着体重的增加,Km因子会按比例上升到W0.67。例如,大鼠的Km值为5.2(100克大鼠)、6(150克大鼠)和7(250克大鼠)不等。因此,在体重为150克的大鼠中,NOAEL值为50 mg/kg的药物活性成分的HED测定方法为: HED(mg/kg)= 50 mg/kg×(6/37)= 8.1 mg/kg。
然而,对于体重为100克的大鼠,Km因子值为5.2,因此,HED计算为: HED(mg/kg)= 50 mg/kg×(5.2/37)=7 mg/kg。在考虑表面积的同时,还可以利用Km因子在动物种类之间转换剂量(mg/kg)。
例如,我们可以将小鼠体内的剂量(50 mg/kg)转换为兔体内相应的剂量,假设其等效基于mg/m2。兔子的Km比值的值首先由小鼠Km因子(表1中的3)除以兔子Km因子(表1中的12),即0.25确定。然后将小鼠剂量(50 mg/kg)乘以计算出的兔Km比值的值(0.25),得到兔剂量(12.5 mg/kg)。将动物或人的剂量单位(mg/kg改为mg/m2)的改变通常是利用表1中的Km因子: mg/m2= Km×mg/kg。
5 动物等效剂量的测定
现有或临床可用药物的动物等效剂量(AED)的换算可根据体表面积进行估算,只需将人体剂量(mg/kg)乘以表1中提到的Km比,使用下式:AED(mg/kg) =Human dose(mg/kg)×Kmratio。例如,一种药物对人的最大剂量是3.25 mg/ kg。然后,通过将HED(mg/kg)乘以Km比(表1中的12.3),可以很容易地估计出小鼠的AED,即40mg/kg。
6 剂量研究的总结
人体安全起始剂量的转换和预估是研究实验和/或临床研究中不可缺少的部分。预估FIH剂量仍然具有挑战性和复杂性,应谨慎进行。有必要记住的是,实际的临床研究不能完全被动物研究取代,因为没有动物物种在所有方面模仿人类。有各种各样的FIH剂量测定方法,它们各具优点和局限性,但尚未就一种理想的或通用的方法达成共识。
研究人员必须考虑每种技术的意义和局限性以及预期药物部分的PK和PD,以选择最准确的方法。不同的方法用于确定FIH剂量意味着物种间的剂量转换是至关重要的,需要在新药开发期间在剂量转换之前进行适当的注意。在不同方法给出的安全剂量值不同的情况下,应考虑以最低剂量作为FIH研究的起点,同时在估计人体实际起始剂量时考虑安全系数的边际。
参考文献:
1.Shery Jacob, et al;Dose translation between laboratory animals and human in preclinical and clinical phases of drug development. Drug Dev Res. 2018;79:373–382.
2.Shery Jacob, et al,; A simple practice guide for dose conversion between animals and human,J Basic Clin Pharma 2016;7:27-31.