您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-12-02 04:10
摘 要
11月22日,国家药监局器审中心发布了《来源于人的生物样本库样本用于体外诊断试剂临床试验的指导原则》(简称生物样本库指导原则),对IVD临床试验中涉及到入组生物样本库样本的情形进行规范。说到生物样本库大家可能稍显陌生,但是临床中用既往留存样本或历史样本肯定是很熟悉的。本文小编带各位一起梳理梳理相关的思路,希望对后续的临床方案设计有所启发。
前 言
正所谓时也,势也,随着技术和国内IVD行业的发展,监管的思路和重点也需要进行调整,在这个背景之下新版《体外诊断试剂临床试验技术指导原则》(简称新规)在去年9月份发布。一石激起千层浪,新版指导原则引发了大讨论,是不是再也没有免伦理了?既往留存样本是不是基本不能用了?……
为了答复大家的疑问,临床二部吕允凤部长开展了《IVD临床试验技术指导原则——变化与不变》的培训,从新规的整体思路、结构改变、方案设计细节、偏倚控制等各个方面进行了专业权威的讲解,为此小编整理过一篇《新规笔记 | IVD临床再无免知情?》,感兴趣的可以再翻看翻看。
书归正传,除了伦理之外,新规还对既往留存样本进行了讲述:
“特定情况下,某些受试者样本可以来自既往的、其他研究的样本集或无特定用途的样本集。此种情形下则需特别注意避免引入偏倚!”
但具体是啥特定情况呢?新规没有明说,不过在2021年的新规征求意见稿可以看到一些端倪,“有些情况下,可在样本收集的前瞻性设计中补充部分回顾性收集的样本,例如某些稀有样本,采用前瞻性设计很难在有限的时间内收集到足够的数量,此时可考虑从生物样本库中入组样本。”但是正式版的新规最终还是没有讲明,也没有引入前瞻性和回顾性的概念。
而刚发布的生物样本库指导原则又把特定情况找补回来一点:
IVD临床试验中,原则上应在制定临床试验方案后,按照方案规定的入组/排除标准、受试者招募方式、样本采集方式等进行受试者入组并采集样本。这样的临床试验设计有助于确保受试人群能够代表目标人群的各种特征,从而对试验体外诊断试剂临床性能进行科学的评价,为证明试验体外诊断试剂安全有效、支持说明书宣称的预期用途提供充分证据。
*编注:这是最符合原则要求的前瞻性入组设计。
在某些特殊情况下,以上述方式入组足够数量的样本难以实现,可能使用既往留存样本集作为临床试验样本入组的补充方式(例如,某些稀有样本入组),或者既往留存样本入组不仅限于少数样本的补充、还会在临床试验样本中占有一定比例。规范化、标准化管理的生物样本库是其中可选择的样本来源之一。
这里引出了生物样本库,也就是通常讲的回顾性设计。接下来我们拆开了看一下。

整个生物样本库指导原则,如果只用四个字概况,那就是控制偏倚!
Part.1 基本要求
1.1.临床试验如允许纳入生物样本库样本应有充分的理由,并进行相应的偏倚控制。(注:师出有名,也就是说,没有充分的理由是不行的)
1.2.生物样本库中生物样本和相关数据的采集、保存和应用等应符合基本的伦理准则,保护受试者隐私,且不会给受试者带来额外的风险。
1.3.生物样本库样本的管理和使用应符合《中华人民共和国生物安全法》《中华人民共和国人类遗传资源管理条例》等法律法规及相关部门规章的要求,且应进行规范化、标准化的管理,符合有关生物样本库质量和管理的国家、行业标准及技术规范要求,建立适当的质量管理体系,获得必要的样本保藏资质,应有定期的质量控制和质量检验。
Tips:那么,对生物样本库有哪些标准化的要求的,简单搜索一下国标,已经有一堆:
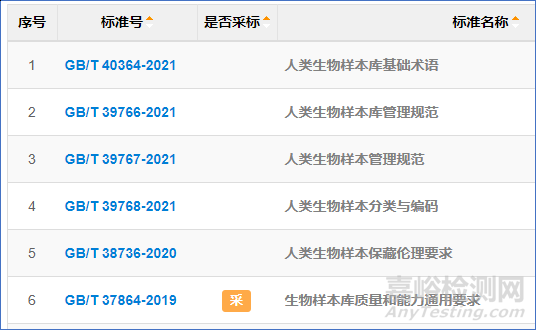
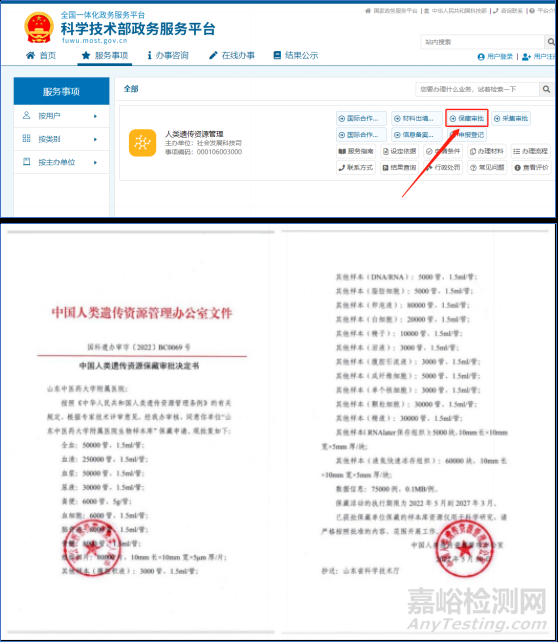
Tips:那么,必要的样本保藏资质是什么?科技部人类遗传资源管理——保藏审批,下次记得问问筛选的机构有没有这个资质。
1.4.生物样本库中的样本应具有拟开展临床试验所需的必要的受试者临床背景信息,剩余样本量满足临床试验需求;从样本库建立到临床试验开展期间,样本采集和储存技术以及疾病诊断标准、诊断方法等没有发生影响试验体外诊断试剂临床性能评价的实质性变化,导致不能入组该临床试验。
1.5.入组的生物样本库样本应尽量为原始样本,且样本类型符合临床试验方案要求,不建议采用人体生物样本的衍生物,例如:从人体生物样本中提取纯化的核酸等。
1.6.生物样本库只能作为样本入组的来源,相关临床试验仍应在具备相应条件且按照规定备案的医疗器械临床试验机构开展。需要从生物样本库入组样本时,原则上,样本来源应为本临床试验机构的生物样本库。
1.7.临床试验方案中应特别说明将允许入组生物样本库样本,相关方案经伦理委员会批准后方可实施。
Part.2 如果生物样本库样本仅用来补充某些稀有样本
2.1临床试验中,经过编盲后,试验操作者和结果判读者应不能区分样本是来自生物样本库的样本还是按照临床试验方案采集的样本。
2.2生物样本库样本采集方式、处理方式、储存条件和时间等应符合临床试验要求。应特别考虑目标被测物可能的降解是否会影响临床性能评价。(比如样本的保存环境,如果实际应用是2~8℃保存3天以内,结果选用-80℃冻了一年的,其是否能反应产品的真实性能?)
2.3临床试验中有关受试者目标状态的临床诊断结论等,可以引用生物样本库中的相关数据,但需要确认临床诊断与样本采集同步进行,以避免因疾病进程不同引入偏倚;对于临床试验中目标被测物的检测(包括试验体外诊断试剂和对比方法等)则建议在临床试验中同步进行,不建议引用生物样本库中既往的检测数据,以避免由于检测不同步、样本储存时间差异较大引入偏倚。
2.4生物样本库样本的纳入可能导致具有罕见状况的受试者在临床试验受试人群中的比例显著高于在自然状态下目标人群总体中的比例,这个潜在偏倚应在统计分析中加以考虑。
Part.3 如果生物样本库样本在临床试验中占有一定比例
除上述问题以外,还需格外注意充分论证可能的受试者选择偏倚等问题:
3.1应充分了解生物样本库建立的目的、样本接收范围等,确定受试人群是否能够代表临床试验目标人群的各种特征(而不仅仅是最典型的特征)。
3.2一般的,临床试验受试者入组时应实现随机抽样的原则,从而使受试人群(抽样)对目标人群(总体)具有良好的代表性。如果临床试验需要纳入生物样本库样本,且样本量占有一定比例,则为了保证受试人群的代表性,生物样本库样本量应足够大,从而在一定程度上满足随机抽样的要求。涉及稀有样本入组时可根据临床试验目的综合考虑。
3.3生物样本库建立后是否存在非随机的样本剔除或耗尽等,使得生物样本库的样本组成发生非随机的变化(例如与样本稳定性或受试者目标状态相关的样本库组成结构变化),导致临床试验目标人群的某些特征缺少代表性。
➣ 同时新规还讲到需要考虑以下内容:
定量检测的临床试验中,样本是否能够覆盖整个线性范围;
样本是否为产品适用的样本类型,且保存条件和时间满足被测物稳定性要求等。
Tip——偏倚控制
新规专门新增了偏倚的概念,如同风险管理应该贯穿IVD全生命周期一样,偏倚控制应该贯穿临床试验的全程,临床试验的设计、机构的选择、同步试验、盲法设置等等都是在对偏倚进行控制,提高临床试验的有效性。

结语:以上便是关于生物样本库中既往留存样本选用的摘要和个人理解,重点就是偏倚控制,希望能对各位战友后续的临床设计有所启发,限于能力和阅历,不正之处欢迎批评指正!

来源:小桔灯网


