摘要:为促进儿童用药研发,国家卫生健康委员会等发布了3 批《鼓励研发申报儿童药品清单》。本研究检索整理了清单中精神神经类化学药品的适应证、国内已上市剂型、参比制剂等信息,结合具体实例和国外审评报告等文献资料,从审评角度对研发中可能涉及的药学研究问题进行分析并提出一些考虑,以期为纳入品种的相关研究提供科学参考。可以考虑临床需求,结合给药剂型、原料药性质、质量控制等多方面深入药学研究,促进国内儿童用药开发。
为儿童设计高质量药物是各国面临的持续挑战,我国儿童用药研发与发达国家相比相对滞后,存在可及性较低等问题,如儿童用药品种数整体较少、剂型及规格较单一、超说明书用药情况普遍等[1]。第7 次全国人口普查数据显示,2020年中国0~14 岁人口数约为2.5 亿,占全国总人口的 17.95%[2]。我国儿童人口基数大,儿童用药需求量大,规范儿童用药对于维护儿童健康权益有重要意义。
近年来,我国出台了一系列儿童药品保障工作相关的政策与法规。国家卫生健康委员会、工业和信息化部、国家药品监督管理局(NMPA)从2016 年开始先后公布了3 批《鼓励研发申报儿童药品清单》(以下简称《清单》) [3—5],以促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,同时推动企业合理布局并减少企业盲目研发。2021 年印发的《“十四五”国家医药工业发展规划》中明确要健全儿童用药临床评价体系,发挥儿童药研发和产业化联盟作用,加快开发符合儿童生理特征的新品种、适宜剂型和规格[6]。国家药品监督管理局药品审评中心也开通了儿童用药审评审批绿色通道,2021 年全年我国共有47 个儿童用药获批上市(其中14 个产品通过优先审评审批程序获批),获批数量明显高于往年[7]。
本研究检索并整理了《清单》中精神神经类化学药品的适应证、国内上市剂型等信息;并结合具体实例和国外审评报告等文献资料,对研发中可能涉及的药学研究问题进行分析并提出一些考虑,以期为纳入品种的相关研究提供科学参考。所述内容仅代表个人观点和审评体会,供读者参考。
01、《清单》中精神神经类化学药品的品种情况
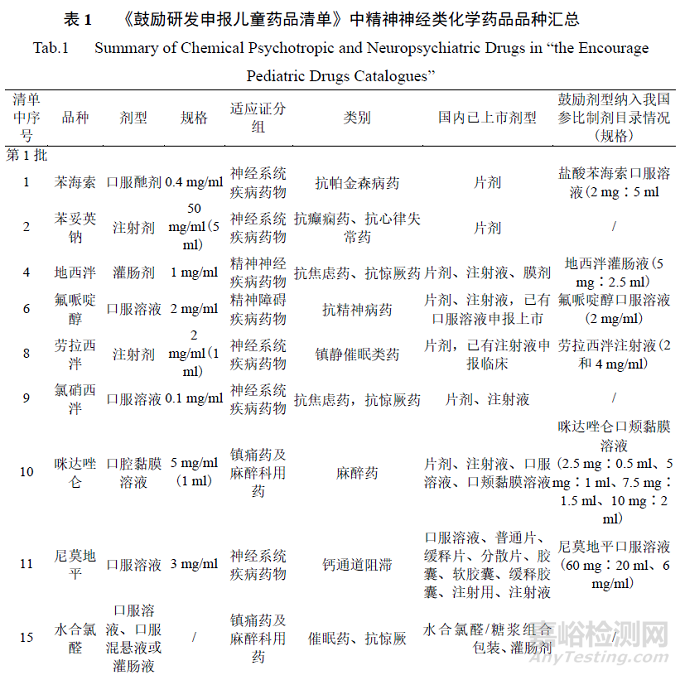
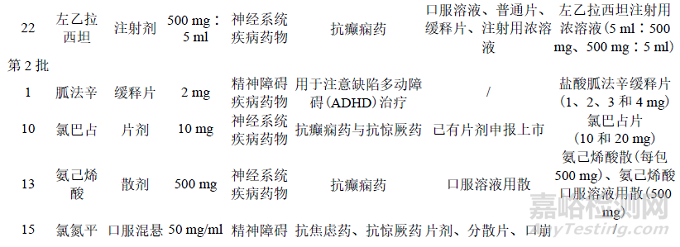
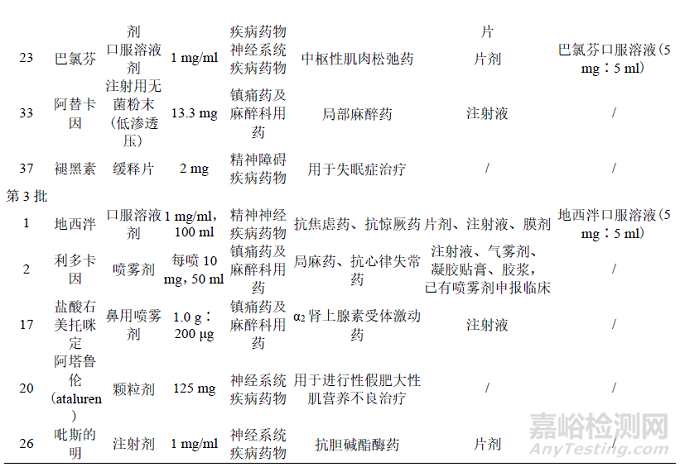
为落实《关于保障儿童用药的若干意见》,国家卫生健康委员会等部门梳理了当时国外已上市但国内尚无注册上市的儿童适宜药品的剂型规格,制定了《清单》。本研究对品种情况的简要分析如下:3 批《清单》中共计包含106 个药物品种;适应证包括精神神经系统、循环系统、内分泌系统、感染以及肿瘤等多种疾病;剂型包括口服液体制剂(口服酏剂、口服溶液、口服混悬液、口腔黏膜溶液、糖浆剂等)、注射剂、片剂、胶囊剂、颗粒剂、灌肠剂等,其中口服液体制剂较多,共46 种,一定程度上体现了鼓励研发的剂型方向[8]。
通过检索NMPA 官方网站(“药品查询”栏目可查询到NMPA 已批准上市的药品),从品种、剂型、规格、适应证、类别、国内上市剂型、参比制剂纳入情况等项目入手,对涉及的精神神经类化学药品品种逐个进行梳理,汇总结果见表1(截至 2022 年 6 月 30 日)。目前部分品种已有《清单》鼓励研发的剂型在国内上市,如咪达唑仑口腔黏膜溶液、尼莫地平口服溶液、水合氯醛灌肠剂、氨己烯酸口服溶液用散等,这些近年获批的品种为儿童用药提供了适宜剂型、填补了国内相关领域治疗药物空白。另外在参比制剂发布方面,我国仿制药参比制剂目录中(截至第54 批)已纳入表1 中部分鼓励研发品种。
02、 代表性药物药学研究关注点探究
目前儿童用药开发趋势是开发匹配年龄的剂型,其应具有可变和准确的剂量、可接受的适口性并使用符合法规要求的合适辅料等[9]。以下按剂型分类,结合近年来获批的儿童用药具体品种,从处方、工艺和质量控制方面进行汇总,对部分药学研究问题进行分析并提出一些考虑关注点。
2.1 口服固体制剂
固体剂型仍是工业界易选的剂型,具有长期稳定、制造灵活和较低生产成本等优势,但固体制剂也存在一些缺点,比如固定的剂量可能仅能针对小部分人群(大多数儿童用药剂量需要基于儿童体质量计算)、儿童不能或不易吞服较大的固体制剂、存在窒息或者误吸的风险等。近年来,国外开发了一些不同释药机制的调释固体制剂,一定程度上使儿童患者获益。
例如,盐酸胍法辛(guanfacine hydrochloride)为可乐定咪唑啉开环类似物,2009 年美国FDA 批准其缓释片(商品名Intuniv,规格为1、2、3 和4 mg)用于治疗ADHD,目前国内未有盐酸胍法辛制剂上市。此缓释片日服1 次,可提高儿童用药顺应性且一定程度上减少血药浓度的峰谷波动。审评报告显示[10],1 和2 mg 规格的产品辅料包括羟丙甲纤维素、甲基丙烯酸共聚物、乳糖、聚维酮、交联聚维酮、微晶纤维素、富马酸和山嵛酸甘油酯;3 和4 mg 规格在上述辅料的基础上增加了绿色混合颜料。EMA 审评报告显示[11],此骨架型缓释片采用直压工艺且存在原料过量投料来补偿生产过程中损失的情况;主要生产工艺包括4个步骤,辅料筛选、将活性药物成分与辅料混合和筛分(或研磨),然后直接压片和包装。由于主成分含量较低,混合步骤对含量均匀度和调释特性的控制较为关键,可以进行关注。FDA 审评报告中指出,生产中过程控制了多个关键参数(重量、硬度和脆碎度)。另外,原研专利实施例中明确了具体使用辅料的型号,显示优选的片剂硬度为4.0~11.0 kPa,更优选4.5~8.0 kPa[12]。质量控制方面,EMA审评报告中列出了性状、鉴别、含量均匀度、含量测定、有关物质、溶出度和微生物限度质控项。
2.2 口服液体制剂
液体制剂由于剂量灵活性和易于吞咽等性质,最适于儿童人群中的低龄人群。液体制剂与药物依从性相关的主要挑战是适口性,为增强其稳定性和适口性通常会加入功能性辅料,如抑菌剂、增溶剂、矫味剂和着色剂等,这类辅料应合理使用以减少潜在的不良反应。另外液体制剂的处理和贮存成本相对较高,一些安全性功能例如儿童安全盖和特殊琥珀色玻璃瓶等也可能会增加成本。近年来,液体制剂有尽量减少使用安全性风险辅料和开发单剂量包装形式等发展趋势。
咪达唑仑(midazolam)是咪唑并苯二氮䓬类的衍生物,具有抗惊厥作用、催眠镇静作用和抗焦虑和肌肉松弛作用。咪达唑仑口腔黏膜溶液是在欧盟上市的原研药品(商品名Buccolam,规格为2.5 mg∶0.5 ml,5 mg∶1 ml,7.5 mg∶1.5 ml,10 mg∶2 ml),用于治疗婴儿、幼儿、儿童及青少年患者(3 个月至小于18 岁)持续的急性惊厥发作[13]。EMA 审评报告显示[14],该产品为无色澄清液体,拟定pH 控制范围为 2.9~3.7,辅料包括氯化钠(等渗剂)、盐酸(pH 调节剂)、氢氧化钠(pH 调节剂)和注射用水,不含抑菌剂、增稠剂、着色剂、矫味剂或缓冲剂,适用于儿童人群。4 个不同规格产品的处方比例相同,仅填充量不同。各规格用不同颜色的标签(黄色、蓝色、紫色和橙色)来区分,分别用于不同年龄段人群。包装采用单剂量包装,包含单次使用的琥珀色聚丙烯预灌封口服注射器(无针头)、高密度聚乙烯帽和聚丙烯柱塞杆。由于本品在紧急情况下使用,处方中不包含缓冲盐且给药体积小,药液的pH 值在给药后可快速增大至口腔生理值(pH 7.4),因此产品目标pH 3.3 是可接受的。咪达唑仑的吸收具有pH 依赖性,在高pH 下结构发生关环(存在开环和闭环结构形式),脂溶性和透膜性增加,有利于颊黏膜快速吸收。虽然此产品是非无菌制剂,但需要采用无菌过滤工艺以保证较低的生物负荷。EMA 审评报告中还提供了简要的工艺描述,咪达唑仑碱分散在氯化钠溶液中,加入盐酸形成咪达唑仑盐酸盐并调节至目标pH 值。溶液通过无菌过滤器过滤到预先灭菌的容器中,最后将溶液灌装到注射器中。拟定的关键中间体包括过滤前溶液,并进行了外观、pH 值、鉴别、含量、有关物质和微生物限度测定,灌装步骤也对装量进行了控制。在质量控制方面,EMA 审评报告中的质控项目包括外观、鉴别、pH 值、含量均匀度(装量差异)、含量、有关物质和微生物限度[14]。英国药典(BP 2022)也收载了咪达唑仑口腔黏膜溶液,仿制制剂制定质量标准时可参考原研产品标准和药典标准等拟定。
2.3 注射液
对于部分特定的儿童人群,注射剂是常用的给药剂型。左乙拉西坦(levetiracetam)是吡咯烷酮衍生物,具有抗癫痫作用。药品审评中心公开的原研进口产品(左乙拉西坦注射用浓溶液,商品名Keppra)技术审评报告中显示[15],现适应证为“用于成人及 4 岁以上儿童癫痫患者部分性发作(伴或不伴继发性全面性发作)的治疗。本品可在患者暂时无法应用口服制剂时替代给药”。癫痫患者需长期服药,但口服药也经常存在不适用的情况,临床急需注射液作为短期替代品种。作为符合儿童生理特征的儿童用药品种,原研进口产品在2021 年新增适应证补充申请时按优先审评审批批准上市。根据美国的原研药品说明书[16],每5 ml 左乙拉西坦注射用浓溶液含左乙拉西坦500 mg、注射用水、氯化钠45 mg、乙酸钠8.2 mg 和冰乙酸(调至pH 5.5)。给药时,需将推荐剂量的浓缩液稀释在稀释剂100 ml 中,再进行15 min 的静脉输注。EMA 审评报告显示[17],无菌浓溶液对光和热不敏感,灭菌工艺采用终端蒸汽灭菌;质量控制项目包括性状、鉴别、pH 值、有关物质、不溶性微粒、装量、细菌内毒素、无菌和含量测定。美国药典(USP 2022)收载了左乙拉西坦注射用浓溶液,拟定质量标准时可作为参考。目前左乙拉西坦注射用浓溶液已纳入全国集中采购(第三批),国内已有多家仿制药上市。
2.4 可能存在的问题和考虑点
制剂研究有时会欠缺对原料药的关键理化性质研究,原料药内控标准有待提高。可以关注原料药的生物药剂学分类系统(BCS)分类情况、溶解性等,如盐酸胍法辛为BCS Ⅱ类药物,在水(约1 mg/ml)和有机溶剂中溶解性低[10],且为pH依赖型弱碱性药物,酸性条件下的溶解性优于碱性条件。原研调释制剂中加入富马酸作酸碱调节剂,可一定程度促进盐酸胍法辛的溶解。另外,溶解性较低药物的粒径对制剂体外溶出可能有一定的影响,可以通过研究设定合理的粒径控制范围,如盐酸胍法辛原研调释制剂报告和专利显示其采用直压工艺制备,且加入了粒度分布适宜的适于直压的稀释剂等辅料[11—12]。专利实施例中对原料药粒度进行了控制,缓释片中使用的原料粒径分布d(0.5)为5~25 μm,d(0.9)为10~50 μm。
有时仿制制剂研究时对参比制剂和最新技术要求的研究不够深入。可以进行充分的文献调研和试验,结合剂型特点,明确目标产品质量概况(QTPP)和关键质量属性(CQA),进而进一步研究。例如针对注射剂,需特别关注灭菌和无菌工艺的研究、包装系统密封性和相容性研究等;固体口服调释制剂在质量对比时易遗漏乙醇剂量倾泻试验研究;需关注参比制剂包装的特殊性,如咪达唑仑口腔黏膜溶液原研制剂的4 个规格包装标示颜色区分清晰,在进行仿制时可借鉴等。另外,研究时可以及时跟进国内外最新技术指导原则和公告等。NMPA 于2021年发布了《儿童用药(化学药品)药学开发指导原则(试行)》等12 项儿童用药专项指导原则[7],从药学、药理和临床等各方面逐步建立审评标准体系;针对部分药物在儿童人群中超说明书使用的问题,NMPA 于2021 年发布公告批准两批8种药品说明书增补儿童用药信息,其中包括3 种临床常用的精神神经系统用药(氟哌啶醇口服制剂、利培酮口服制剂和氟西汀口服制剂)[18]。在具体产品的开发过程中,国内外相关指南、已上市产品信息、国外审评报告和专利等均对研究有良好的借鉴意义。
在研发立项方面,可以结合国际先进技术不断探索新的研发思路。例如针对治疗ADHD,美国FDA 批准了一系列哌甲酯类制剂,包括口服溶液、普通片、缓释胶囊、缓释片、咀嚼片、透皮贴剂等,其中的缓释胶囊品种释药机制各异,国内也可借鉴其研发思路对制剂进行优化[19]。另外,灵活的固体制剂被世界卫生组织(WHO)认为是最合适儿童的剂型,多颗粒剂型(multi-particle dosage forms,MDFs)近年来成为国外儿童用药开发的热点,包括迷你片、口腔分散片、迷你口崩片等[2,9]。
03、 结语
本研究通过梳理《清单》中精神神经类化学药品信息,对其中口服固体、口服液体和注射剂的代表药物的处方、工艺和质量控制进行汇总。不同年龄段儿童人群适宜采用的给药途径和剂型存在较大差别,可以结合人群特点和儿科临床需求进行开发,参考口服给药剂型决策树选定合理的剂型[2,20]。此外,对研发中可能涉及的药学研究问题,提出了加强原料药内控、深入文献调研和开拓研发立项思路的考虑。儿童用药研发申报涉及多方面密切协调配合,需要从审评审批、科技专项立项、生产供应、临床合理用药配药等多角度联动,共同提升儿童用药的安全、有效和可及性。