据初步统计,目前中国糖尿病患者人数是1.14亿,患病率高达11.6%,位居世界第一,糖尿病并发症发病率达到90%。据文献报道男性糖友性功能低下或ED约50%以上,服用西地那非无效。迄今糖尿病治疗仅局限于控制血糖,对治疗糖尿病并发症仍无能为力。项目发明人丛晓东与中国药科大学团队历经30年研发,挖掘中医药宝库,聚焦于糖尿病和糖尿病并发症原研药的开发,从中药大黄中发现的天然产物大精酸,用于糖尿病并发症。2005-2006年进行临床前研究,药学方面取得了积极进展;2007年与中国药科大学戴德哉教授合作对药理药效、作用机制进行了系统的研究,药效成果获国际医药专家的认可,并陆续公开了一些数据。
目前获得重大突破,取得:(1)中国、欧、美、日、俄发明专利证书;(2)糖尿病并发症的新作用机制及药效获国际医药专家的认可,在国际著名核心期刊SCI公开10多篇研究报告;(3)项目列为国家重大新药创制科技重大专项立项,2017ZX09301066。
今天推荐一篇2013年在欧洲药理学杂志发表的一篇文章,“大精酸通过抑制ERS和IκBβ—治疗男性糖尿病ED”,当年点击率破历史记录,杂志总编特地发来贺信表示祝贺。该论文曾在2009年国际第一届天然药物与药理学术大会主题讲演,并获特别大奖。
摘要
2型糖尿病常伴有男性性功能减退(糖尿病ED),是由于睾丸功能障碍,但发病机制的起源尚不清楚。本文采用高脂饮食(HFD)和低剂量链脲佐菌素(STZ)制作2型糖尿病大鼠,建立糖尿病睾丸病模型,评价促炎症因子参与机制,包括内质网(ER)应激,和核κBβ抑制因子(IκBβ),证明炎症因子介导糖尿病男性性功能低下的机制并观察大精酸的药效。糖尿病大鼠血中睾酮和促黄体激素(LH)减少,同时观察到生成睾酮的关键蛋白-类固醇合成触发调节蛋白(StAR)的降低,和反映2型糖尿病特点的胰岛素受体底物(IRS-1)的降低,被激活的核κBβ抑制因子(IκBβ)和内质网(ER)应激因子,伴侣同源蛋白(CHOP)等炎症因子的降低。在体试验还观察到:精子计数和活动力均明显降低和性行为明显减少。
另外,高糖培养睾丸间质细胞(Leydig cells)的体外试验出现上调的:IκBβ,ER应激传感器PERK(PKR 样内质网激酶)和磷酸化 Akt/ Akt 的蛋白比值。这些变化可能是由于炎症中的炎症因子与活化的NADPH氧化酶有关,大精酸能显著缓解这些变化。总之,由高脂饮食和低剂量 STZ诱发的糖尿病睾丸病具有炎症实体特征,大精酸通过使活化的IκBβ和ER应激的正常化,可完全缓解糖尿病阳痿。
1.前言
男性性腺机能减退常继发于二型糖尿病病。诱发男性性腺功能减退的病变可能包括氧化应激和凋亡变化,这可在链脲佐菌素诱导的糖尿病试验病中观察到(Tang等,2008)。低烈度被认为是糖尿病的一个重要潜在机制(Romeo et al., 2012);一些促炎/促炎因子(包括内皮-1 (ET-1)和NADPH氧化酶)的变化可能会导致受影响睾丸的病变(Cheng et al., 2010)。线粒体异常和NADPH氧化酶激活有助于活性氧的生成,从而通过未折叠的蛋白反应和随后的ER应激导致ER(内质网)中异常蛋白的积累(Zhang, 2010)。尽管轻度ER应激可能有利于维持胰腺β细胞中的胰岛素生物合成(Kaufman et al., 2010),但持续的ER应激会损害受影响的细胞,因此需要降低ER应激来挽救β细胞群和糖尿病肾脏(Tirupathi Pichiah et al., 2011; Hu et al., 2011)
内质网(ER)应激的特征是核转录因子(IκBβ)如类ER激酶(PERK)和C/EBP同源蛋白(CHOP)的上调,表明疾病中隐含的低烈度炎症反应(Zhang,2010;Kaufman等人,2010年)。ER应激对于降低缺氧睾丸中睾酮的生物合成至关重要(Liu等人,2012),并且与2型糖尿病伴胰岛素抵抗的并发症有关(Hu等人,2011;McAlpine等人,2010年)。在糖尿病肾脏中发现的ER应激是由高剂量的STZ(链脲佐菌素,65 mg/kg,i.p .)在大鼠中产生的,类似于临床观察到的1型糖尿病(Hu等人,2011年)。然而,更令人感兴趣的是在由高脂肪饮食和低剂量的产生的大鼠模型中研究糖尿病ED的变化(Zhang等人,2006;Sharma等人,2011年)。单独喂食高脂肪食物的兔子可能表现出勃起功能障碍和睾丸异常(Filippi等人,2009年;Mallidis等人,2011年)。ER应激是否在2型糖尿病大鼠的雄性性腺功能减退中起关键作用仍有待确定。
胰岛素受体底物-1 (IRS-1)是一种介导代谢综合征的胞质衔接蛋白,代表细胞内胰岛素流动的敏感性。IRS-1在睾丸支持细胞、早期精母细胞、肾小管周肌样细胞和睾丸内皮细胞中高度表达,反映了睾丸中的临界胰岛素流量(Kokk等人,2007)。结果表明IRS-1升高是治疗2型糖尿病大鼠的有效疗法(Si等人,2012年)。因此,IRS-1下调可能是胰岛素受体敏感性下降和睾丸功能障碍减少的信号。脂肪组织释放的瘦素会增加炎症因子(如IL-8)的水平,并可能影响IRS-1和Akt途径(Tong等人,2008)。有趣的是要确定上调的瘦素受体(OBRb)是否可能反映2型糖尿病睾丸病中IRS-1的减少。在糖尿病患者中,NFκB与淋巴单核细胞积极相关,表现为炎症反应,抗氧化剂N-乙酰半胱氨酸抑制上调的NFκB (Amore等人,2012年)。在HFD和低STZ诱发的2型糖尿病大鼠中,尚不确定这些异常是否与炎症有关(涉及睾丸中IκBβ的上调),并且可能被抗炎症药物减轻。
大精酸Argirein具有抗炎活性,因此通过其抗炎活性减轻糖尿病肾病(高等人,2010;胡等,2011)。我们假设HFD和低STZ导致的糖尿病睾丸损伤诱导炎症反应,包括活化的IκBβ和ER应激伴侣蛋白伴随着降低的IRS-1,以及睾丸中异常的PPARα/γ(过氧化物酶体增殖物激活受体α/γ)、MMP2/9(基质金属蛋白酶)和Cx40/43(间隙连接蛋白)。大精酸的抗炎活性可能会减轻这些变化。血管紧张素-II (A II)是刺激NADPH氧化酶激活产生活性氧的关键介质(Cabello-Verrugio等人,2011年),缬沙坦阻断血管紧张素-2受体可抑制NADPH氧化酶及其相关的炎症反应。因此,我们测试了大精酸是否可以通过抑制炎症/促炎症因子来缓解2型糖尿病睾丸病。
2.材料和方法
2.1 材料
大精酸自制,STZ购自适马公司。MMLV RT(莫洛尼鼠白血病病毒逆转录酶;Pro- mega,Madison,WI)和Taq DNA聚合酶(天根生物技术公司,中国北京)购自中国南京的天威公司。购自美国加州圣克鲁斯的一级抗体有:StAR、CHOP、PERK、IRS-1、MMP-2、PPARα、PPARγ、p-Akt、Akt;和来自Bosta,Co .:的是MMP-2、MMP-9、Cx40、Cx43,来自Abcam的是OBRb。HRP缀合的多克隆山羊抗小鼠IgG和多克隆山羊抗兔IgG购自中国武汉的Boster Biological Technology。
2.2 .动物
成年雄性Sprague-Dawley大鼠,体重200-220g,从浙江省杭州市的浙江实验动物中心获得,许可证号为SCXK20080033。动物处理程序得到了国家自然科学基金会和大学科学部的批准,对大鼠的处理严格遵守中国江苏省科技局制定的处理实验动物的指南。
2.3 .高脂肪饮食和STZ注射大鼠中的糖尿病
给雄性Sprague-Dawley大鼠喂食高脂肪饮食(HFD)和低剂量的STZ,以建立2型糖尿病大鼠模型稍作修改(张等人,2006年;Si等人,2012年)。用含10%蔗糖、10%猪油、5%蛋黄粉、0.5%胆固醇和74.5%基础饲料的HFD喂养大鼠,购自南京青龙山动物中心。给大鼠喂食HFD 22克/天,相反,在正常情况下限制食物(普通食物15克/只)。普通饲料由36%玉米、23%研磨小麦、10%麸皮、12%大豆粉、3%鸡蛋组成;12%的鱼粉、2%的干酵母、1%的碳酸氢钙混合物、多种维生素和微量元素。在为期12周的实验期间,用限制性普通食物喂养的大鼠表现出正常的体重增加和糖尿病大鼠相对良好的健康状况。限制食物有利于减少胰岛的糖脂毒性(徐等人,2009;胡等,2011)。
将大鼠分为7组:对照组、未治疗的糖尿病组和用缬沙坦(Val,12)和大精酸(AR,50,100,200)治疗的糖尿病组(mg/kg,i.g .)。在前4周,每组大鼠仅给予HFD,而正常组仅接受常规食物。在第5周开始时,用HFD喂养的大鼠接受STZ (35毫克/千克,腹膜内)一次或两次,间隔一周。当空腹血糖水平达到16.7 mM时,HFD低STZ大鼠被认为是糖尿病大鼠。在第9-12周,进行了缬沙坦或三剂大精酸的干预。一组正常大鼠分别用大精酸(200毫克/千克,静脉注射)处理。正常组和未治疗糖尿病组的大鼠给予等体积的0.5%羧甲基纤维素钠(CMC-Na)。每隔3天监测一次体重增加,并在第4、8和12周末对各组进行比较。
2.4 .生化分析
血清葡萄糖、睾酮和促黄体生成素(LH)水平通过化学发光法测定,如先前报道(冯等,2007)。睾丸乳酸脱氢酶(LDH)、酸性磷酸酶、琥珀酸脱氢酶(SDH)和丙二醛(MDA)的活性按南京程健生物工程研究所提供的试剂盒说明进行测定。
2.5组织学评估
睾丸组织用10%中性福尔马林固定,包埋在石蜡中,切成5mm厚的片,用常规苏木精-伊红(H-E)染色处理。病理学家在对实验剖面不了解的情况下,在光学显微镜下对所有切片进行检查,并在200倍放大倍数下拍照(冯等人,2007)。
2.6精子和性行为
通过腹膜内注射20%氨基甲酸乙酯来麻醉雄性大鼠,并且如先前报道的那样评估精子密度和运动性(冯等人,2007)。
雄性大鼠的性行为按照之前描述的程序进行监测,并做了一些修改(冯等人,2007;Saito等人,2003年;Suresh等人,2009年)。选择阴道涂片显示发情前期特征和连续重复4天发情周期的2个周期后的雌性大鼠(8周龄)。将雄性大鼠在黑暗中放置10分钟后,在低水平红光照明下将一只性接受雌性大鼠引入该室。在夜间20分钟内(21:00至21:20)记录交配行为。记录并比较7组动物的在体活动频率和射精频率
2.7 .睾丸间质细胞培养
根据我们之前的实践,分离了成年大鼠的Leydig细胞(Zhang等人,2013)。简而言之,在冰上剥离白膜后,在无菌条件下从大鼠中取出睾丸,并在37°C下用稀释于D-Hanks溶液的0.25%胶原酶II消化近18 min。然后加入含胎牛血清的DMEM培养基终止消化。以1000 r/min的速度离心消化组织,并用100目筛过滤。此后,进行细胞计数以确保细胞密度保持在1 x 105/ml。最后,将细胞接种在培养容器中。必须每天更换培养基,1周后将细胞随机分为7组:对照组、与高葡萄糖(25 mM)孵育60 min的细胞和高葡萄糖组、在过去30分钟内接受缬沙坦(10-6M)和大精酸(10-5,10-6,10-7M)治疗的培养,以及接受大精酸(10-5M)治疗的正常培养。PPARα、PPARγ、OBRb、采用RT-PCR和Western Blotting检测PERK和IκBβ。罗布麻苷(APO,10-5M),一种NADPH氧化酶阻断剂,也被应用于高葡萄糖培养基中,以进行比较大精酸和缬沙坦。
2.8反转录PCR
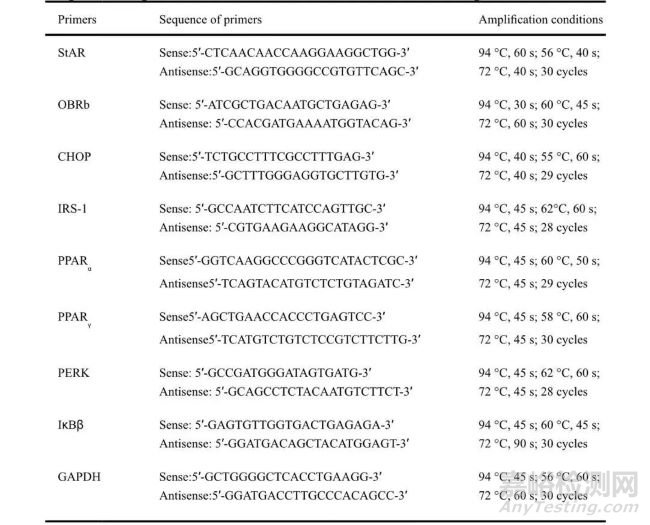
根据以往的报告,采用RT-PCR检测睾丸中StAR、CHOP、OBRb、IRS-1、IκBβ、MMP2/9、Cx40/43以及Leydig细胞中StAR、PPARα、PPARγ、OBRb、PERK、IκBβ的mRNA丰度(Li等人,2008)。简而言之,根据制造商的介绍,使用MMLV逆转录酶将Trizol试剂从睾丸组织和培养细胞中提取的总RNA反向转录为cDNA。RT-PCR在25 μl体积中进行,cDNA等分试样为1 μg,产物用溴化乙锭染色,并在紫外灯下检测(GDS8000Sygene,剑桥,英国)。使用专业图像分析软件分析每条条带的光密度,并计算目标基因与GAPDH内标物的比值。引物的核苷酸序列和PCR扩增条件列于表1。
2.9.Western blot分析
为了进行定量分析,以体内睾丸中的StAR、IRS-1、OBRb、CHOP、IκBβ、MMP2/9和Cx40/43的蛋白水平以及体外高葡萄糖孵育的Leydig细胞中的StAR、PPARα、PPARγ、OBRb、PERK、IκBβ、p-Akt/Akt (Ser 473)的蛋白水平为靶点。采集一部分睾丸组织(100 mg)和培养的Leydig细胞,匀浆并在四个体积的提取缓冲液中提取,然后在4°C下以10,000 x g离心(10 min)。测定蛋白质浓度后,使用前将上清液储存在-20°C下。
将等分试样在加载缓冲液中加热至98°C,并在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)上进行分离。转移到硝酸纤维素膜上并用脱脂牛奶(5%,w/v)封闭后,在4°C下用特异性一抗将印迹培养过夜。三次洗涤后,将印迹与辣根过氧化物酶(HRP)-结合的山羊二抗IgG(f fir fir currency bio retries;1:1000)在室温下放置1 h,并用DAB试剂盒检测。通过成像采集设备(Labworks,UK)对条带进行可视化,并通过光密度测定进行定量。相对丰度是通过对照β-actin标准化测试蛋白的密度获得的(Zhang等人,2011年)。
图1。在进入实验时,与基线相比,以3天的间隔监测体重增加(g)。在第4、8、12周末的3个时间点进行比较。高脂肪饮食(HFD)在4周结束时产生更大的体重增加,并且在第5周开始时给予单次低剂量的链脲佐菌素(STZ,35 mg/kg,i.g .),消除了在8周结束时HFD增加的体重。大精酸(ARL,ARM,ARH: 50,100和200)或缬沙坦(Val: 12)的干预(mg/kg,i.g .)在过去4周内进行,并且不改变体重。平均标准差,n = 10。**P < 0.01,相对于正常值(NOR)。
表1 用于RT-PCR扩增的引物序列和条件
Sequence of primers and conditions used for RT-PCR amplification
2.10统计分析
所有数据均采用SPSS 11.5(美国)软件进行分析,并以平均值S.D表示。统计评估采用单因素方差分析。然后,使用Bonferroni多重比较测试来检查差异的显著性;在检查两个独立样本的方差时,使用了独立样本t检验。P<0.05的概率值被认为具有统计学意义。
3.结果
3.1 .体重
通过测量体重增加来监测大鼠,并在各组之间进行比较。在4周结束时,发现HFD上的大鼠体重相对于普通食物上的大鼠有更大的增加。在第5周开始时,腹腔注射单次低剂量的STZ,然后,体重增加。
在8周结束时,体重减轻。在最后4周,加入大精酸或缬沙坦的干预,在第12周,与未治疗或正常大鼠相比,没有发现体重增加的进一步增加。与正常大鼠相比,施用大精酸的正常大鼠在体重上没有表现出任何变化(图1)。
3.2 .血清葡萄糖、睾酮、LH和睾丸LDH、酸性磷酸酶、SDH和MDA
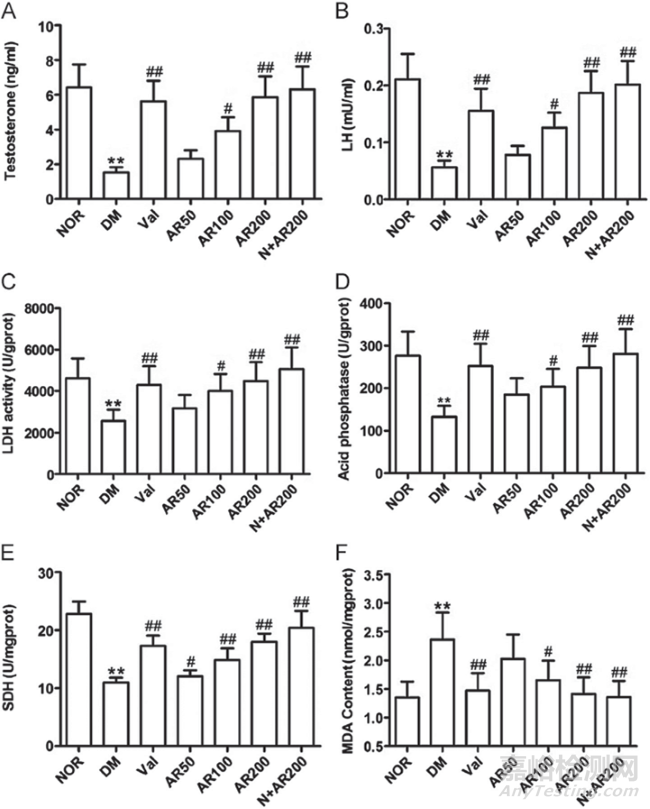
在用HFD和低STZ治疗的大鼠中,血清葡萄糖(mmol/l)从11.9±2.4显著升高至24.7±5.5,P<0.01,并且用大精酸100和200 mg/kg进行干预,即分别显著降低高血糖水平至20.1±2.4和17.9±3.6,P<0.05和P<0.01。与未治疗组相比,缬沙坦还表现出降血糖活性,将血糖水平降低至16.28±3.8 mmol/l,P<0.01。DM组的血清睾酮相对于正常显著下降(图2A)。为了检测下丘脑-垂体-睾丸轴(HPT轴)的变化,发现与正常相比血清LH降低(P<0.01) (图2B)。
在接受高脂肪饮食和低剂量STZ治疗的糖尿病大鼠中,发现血清中睾酮(A)减少、LH (B)减少,睾丸中LDH (C)、酸性磷酸酶(D)和SDH (E)活性降低,MDA (F)增加,并且通过分别用大精酸(50、100、200)和缬沙坦(12)治疗(mg/kg,即)显著缓解了这些变化。平均S.D .,n =10。*P<0.05,**P<0.01,与正常组比较;#P <0.05,#P< 0.01,与糖尿病组相比。
血清睾酮水平升高与血清LH恢复相关,对大精酸的反应呈剂量依赖性。睾丸LDH、酸性磷酸酶和SDH活性显著降低。与单用糖尿病大鼠相比,大精酸和缬沙坦显著消除了这些变化(上图2C-E)。
糖尿病睾丸病中MDA生成量的升高具有显著性,并且通过大精酸或缬沙坦干预得到缓解。正常雄性大鼠中大精酸药物治疗对任何参数均无影响(上图)。
3.3 .精子和着床
从糖尿病大鼠附睾尾部采集的精子密度和能动性显著降低(图2A和B)。对性行为的评估是基于观察雄性大鼠对夜间见到雌性大鼠的反应,与正常大鼠相比,糖尿病雄性大鼠的交配和射精数量明显增加和减少。(图3C和D)通过大精酸或缬沙坦缓解了精子发生和性行为方面的缺陷(图3A-D)。大精酸以剂量依赖性方式减弱这些变化,其有效性与缬沙坦相当。例如,以200 mg/kg剂量服用大精酸的正常雄性大鼠对精子和交配没有表现出影响。
在高脂肪饮食和低剂量STZ的糖尿病大鼠中,精子和性行为的变化是显著的,这些变化通过大精酸(50,100,200)和缬沙坦(12)干预(mg/ kg,i.g .)得到缓解。(一)、精子计数,(二)、精子活动率,(三)、着床数,(四)、射精数。均S.D .,n=10。*P<0.05。**Po0.05,#P<0.01,与糖尿病相比;$P <0.05,$ P<0.01,与AR50相比。
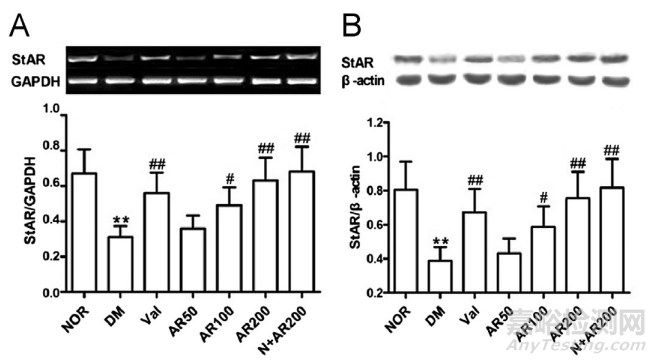
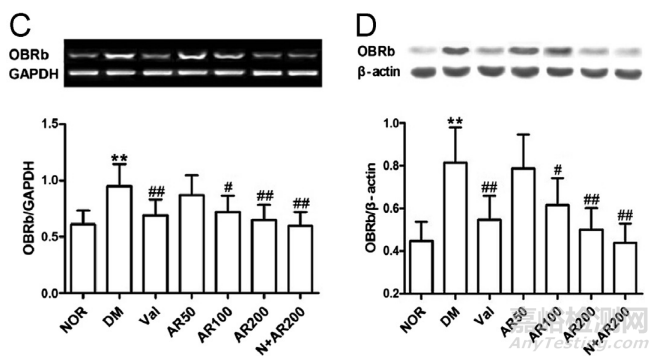
3.4.StAR、IRS-1、OBRb、CHOP和IκBβ体内
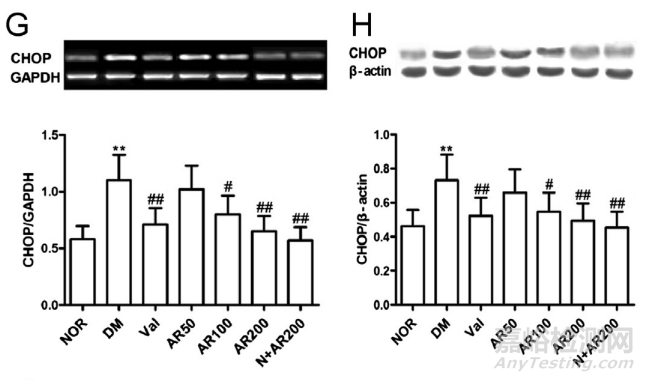
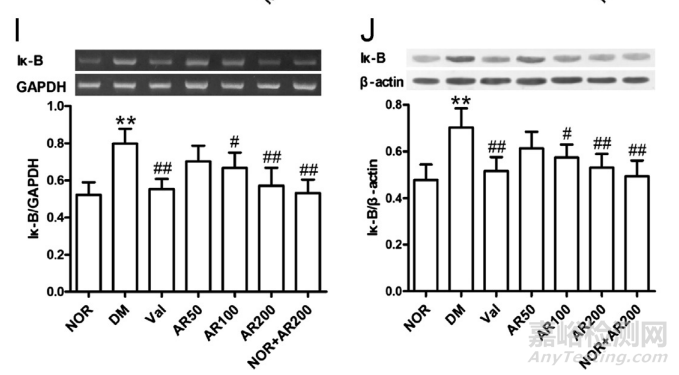
在接受HFD和低剂量链脲佐菌素注射的大鼠中,StAR的mRNA表达和丰度均较体内正常水平降低(P<0.01),表明糖尿病睾丸中睾酮生物合成活性较正常水平降低(图4A和B)。有趣的是,我们发现StAR蛋白下降是否与IRS-1的变化有关。与正常睾丸相比,糖尿病睾丸中IRS-1下调显著,P < 0.01(图4C和D)。瘦素受体,相对于正常睾丸,OBRb在糖尿病睾丸中显著上调(P <0.01)(图4E和F)。与正常睾丸相比,ER应激传感器CHOP的增加在糖尿病睾丸病的病理学中有明显的隐含意义(P<0.01)(图4G和H)。相对于正常水平,IκBβ的上调在2型糖尿病睾丸病中显著(图4I和J)。使用大精酸干预后,这些异常明显变钝。对缬沙坦的反应也为阳性,然而,在正常大鼠中对大精酸治疗无反应(图4)。
在高脂肪饮食和低剂量STZ治疗的糖尿病大鼠的睾丸中,StAR、OBRb、IRS-1、CHOP和IκBβ水平出现显著异常。与对照组相比,在糖尿病睾丸病中,StAR ((A)、(B))和IRS-1 ((C)、(D))的表达减少,与OBRb ((E)、(F))、CHOP ((G)、(H))和IκBβ(I)、(J) 的表达增加相关,这是显著的。这些变化分别通过大精酸(50、100、200 mg/kg,i.g .)或缬沙坦(12 mg/kg,i.g .)缓解。平均S.D .,n= 10。*P<0.05,**P<0.01,与正常(NOR)比较;#P< 0.05,#P<0.01,与糖尿病(DM)比较。
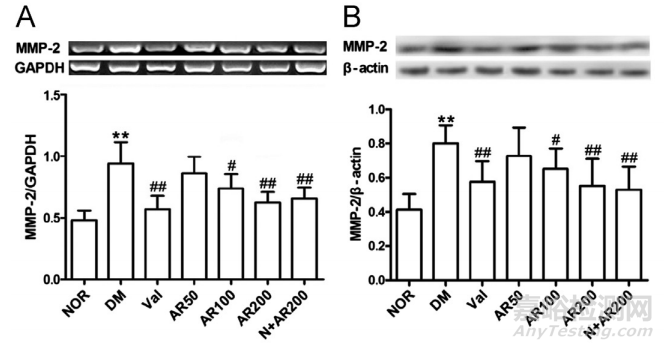
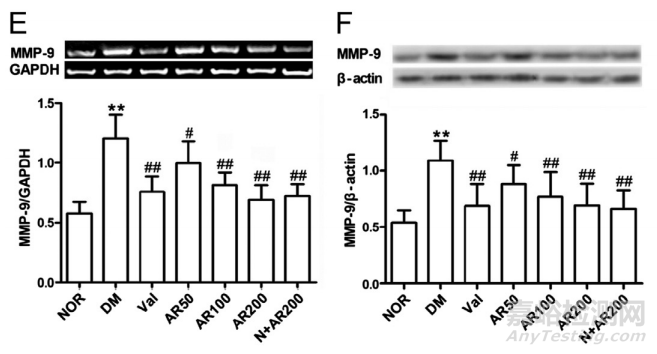
3.5 . MMP 2/9和Cx40/43
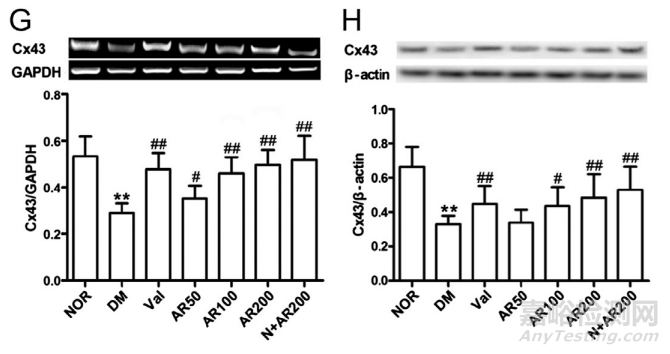
在糖尿病睾丸病中,MMP2/9的基因表达和蛋白丰度显著上调(图5A-D)。同时聚焦生殖细胞间通过连接蛋白缝隙连接的信号传递,Cx40/43的表达和蛋白较正常明显下调(P<0.01)(图5E-H)。与未治疗的患病睾丸相比,在过去4周内使用大精酸或缬沙坦治疗显著减弱了异常(P<0.01)。
在糖尿病大鼠睾丸中,MMP2 ((A)、(B))、MMP9 ((C)、(D))、Cx40 ((E)、(F))和Cx43 ((G)、(H))的mRNA表达和western blot有明显改变。通过体内大精酸或缬沙坦干预,这些变化显著减弱。平均S.D .,n= 10。*P< 0.05,**P< 0.01,与正常(NOR)比较;#P< 0.05,##P< 0.01,与糖尿病(DM)比较。
3.6. 体外StAR、PPARα、PPARγ、OBRb、PERK、IκBβ参数
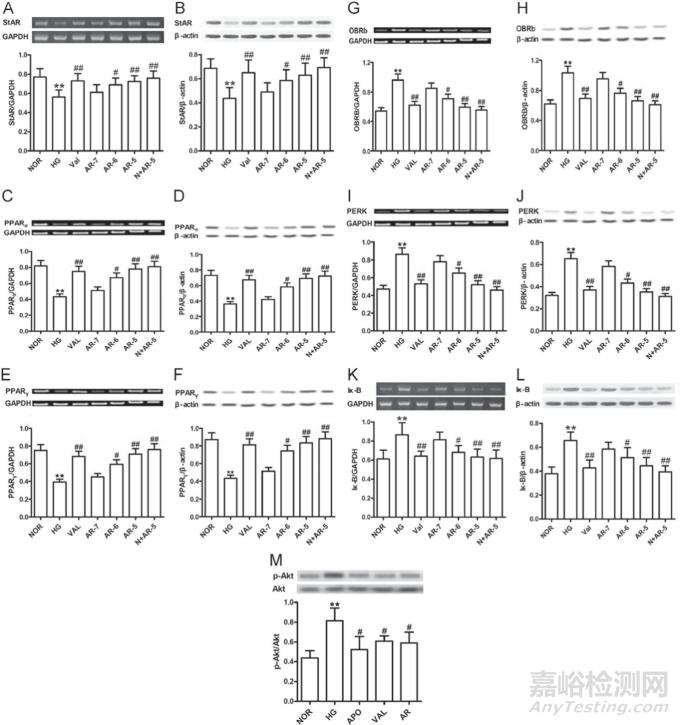
在体外培养的Leydig细胞(从正常雄性大鼠中急性分离)中测量了StAR、PPARα、PPARγ、OBRb、PERK、IκBβ和p-Akt/Akt的mRNA和蛋白表达。与正常组相比,在高葡萄糖培养60 min时,StAR显著下调(P o0.01),与下调的PPARα和PPARγ相关(P<0.01)(图6A-F)。同时,相对于正常,OBRb、PERK和IκBβ显著上调,P o0.01(图6G-L)。大精酸和缬沙坦能显著缓解这些变化。然而,在正常葡萄糖培养基中的Leydig细胞中未发现对大精酸的应答。相对于正常水平,发现p-Akt/Akt上调(P<0.01),并分别被大精酸、缬沙坦或NADPH氧化酶阻断剂APO减弱(图6M)。
图6。在高葡萄糖培养基培养60 min的体外睾丸间质细胞(Leydig cells)中,发现StAR ((A)、(B))、PPARα ((C)、(D))、PPARγ ((E)、(F))、OBRb ((G)、(H))、PERK ((I)、(J))和IκBβ ((K)、(L))的RT-PCR和蛋白分布发生显著改变。这些变化通过大精酸(10-7,10-6,10-5M)或缬沙坦(10-6M)得到缓解。(M) 在高葡萄糖培养的Leydig细胞中发现p-Akt/Akt上调,分别被大精酸(10-5M)、缬沙坦(10-6M)和APO(罗布麻苷10-5M, NADPH氧化酶阻断剂)抑制。平均S.D .,n = 5-6。*P< 0.05,**P< 0.01,与正常(NOR)比较;#P< 0.05,#P<0.01,与高糖(HG)比较。(A) 睾丸间质细胞中的StAR,(B) 睾丸间质细胞中的StAR 细胞,(C) 睾丸间质细胞中的PPARα,(D) 睾丸间质细胞中的PPARα,(E) 睾丸间质细胞中的PPARγ,(F) 睾丸间质细胞中的PPARγ,(G) 睾丸间质细胞中的OBRb,(H) 睾丸间质细胞中的OBRb,(I) 睾丸间质细胞中的PERK,(J) 睾丸间质细胞中的PERK,(K) 睾丸间质细胞中的IκBβ,(L) 睾丸间质细胞中的Iκ-Bβ和(M) 睾丸间质细胞中的p-Akt/Akt。
3.7 .组织变化
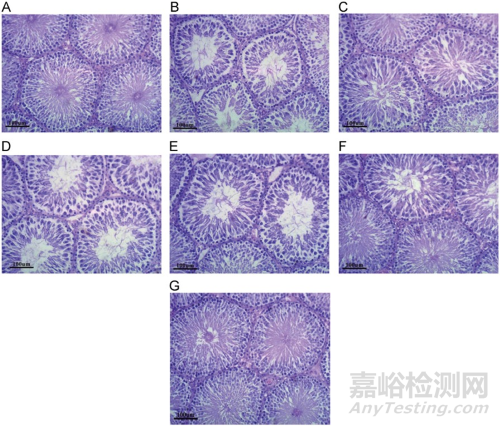
以正常大鼠为对照,观察了HFD和低剂量STZ对雄性大鼠睾丸的组织学影响。在H–E染色的正常睾丸中,多层上皮细胞排列整齐,密集在曲细精管中,生殖上皮与曲细精管基底紧密相连。精子在小管腔内丰富,间质细胞高密度地存在于小管之间的间隙中。在糖尿病睾丸中,扭曲的结构明显显示生殖生殖细胞层扭曲和减少,精子缺失,在管腔中心呈现大空间。多层上皮细胞和细胞外基质的骨架被严重扰乱,在生殖 糖尿病睾丸生精小管的细胞和基底。小管之间的间质细胞密度大大减少。这些变化代表了糖尿病睾丸中雄激素和精子活性较低的图片,并且分别通过大精酸和缬沙坦的干预而显著减弱(图7)
高脂饮食和低剂量STZ注射12周后,糖尿病大鼠睾丸的H–E染色形态学发生了显著变化。在最后4周(200倍)中,通过在大鼠中用3个剂量(50、100和200)的大精酸或缬沙坦(Val,12)治疗(mg/kg,i.g .)来缓解这些变化。(A)正常;(B)糖尿病;(C)糖尿病+Val;(D) 糖尿病+大精酸50;(E) 糖尿病+大精酸100;(F) 糖尿病+大精酸200;和(G) 正常+大精酸200。
4.讨论
本研究中,接受HFD和低剂量STZ治疗的大鼠表现出睾丸功能障碍,其特征为血清睾酮和LH水平低、性行为减少、组织学结构异常,与StAR下调相关。IκBβ和ER应激伴侣的上调在对高血糖/高糖培养基的反应中具有重要意义。异常的线粒体和NADPH氧化酶是活性氧的主要来源,有助于改变内质网和细胞核之间的互动;活性氧生成和NADPH氧化酶激活由AT-1受体介导(Cabello-Verrugio等人,2011);因此,使性功能障碍效应减弱,这与Silva等人(2009年)的研究结果一致。
响应于低血清睾酮,代谢综合征中的男性性腺功能减退以性腺功能减退为特征(Dandona等人,2008;Mah和Wittert,2010),FSH和LH水平较低,这可能是由于糖尿病引起下丘脑-垂体神经网络病变所致。
LDH、酸性磷酸酶和SDH活性的下降可能表明,通过减少来自共同承诺的TCA(三羧基酸循环)的能量产生,睾酮的生物合成和精子发生受损。SDH活性降低与线粒体功能障碍有关(Aly等人,2012年)。
在睾酮生物合成中,StAR被认为是限制性步骤,并且在睾丸功能障碍中总是发现减少的StAR(罗等人,2011;Wang等,2010)和我们之前的报告(冯等,2007;张等,2013)和正可能由ER应激介导(Liu等,2012)。
肥胖患者中常发现男性性腺功能减退(Pauli等人,2008年)。脂肪组织的增加会分泌更多的瘦素来激活OBRb (Han等人,2010年),并对生精小管中的生精细胞和管间间隙中的Leydig细胞产生不利影响。氧化应激是由于瘦素及其受体刺激交感神经系统而产生的(Tentolouris等人,2006;康斯坦蒂尼蒂斯等人,2009年)。因此,OBRb的激活提供了一种以氧化剂增加和IRS-1减少为特征的炎症实体(康斯坦蒂尼蒂斯等人,2009;Pilon等人,2010年)。
前4周期间,仅在HFD进食的大鼠的体重增加幅度大于在普通食物中进食的大鼠。低剂量STZ的毒性可消除体重增加。在HFD联合STZ的大鼠中,激活的OBRb在12周结束时是显著的。HFD大鼠可能显著影响瘦素水平,但不影响OBRb水平(Staszkiewicz等人,2007年)。
在本研究中,OBRb升高可能是由以下因素引起的高血糖综合作用的结果低STZ。事实上,仅高葡萄糖培养基就足以上调Leydig细胞中的OBRb蛋白。HFD的肥胖可能会影响精子质量(Fernandez等人,2011年),并影响小鼠的精子发生和潜在的保护作用(Palmer等人,2011年)。精子数量和能动性的显著变化以及性行为的显著减少是由HFD病和高血糖症的共同作用引起的。
通过上调OBRb,和low引发大鼠睾丸功能受损和勃起功能障碍(Zhang等人,2006年);并且亚临床的炎症会被包括NFκB在内的几种促炎因子的增加所加速(Tong等人,2008;Ben-Neriah和Karin,2011年)。在体内糖尿病睾丸和体外高糖处理的Leydig细胞中发现上调的IκBβ,这使得进入细胞核的NFκB增加,从而导致炎症状态。OBRb的上调已经成为缓解生殖道功能障碍的目标(Polkowska等人,2006年)。糖尿病大鼠LH分泌减少的逆转可能源于抑制下丘脑-垂体神经连接中上调的OBRb。
IRS-1在睾丸中高度表达,特别是在支持细胞、精母细胞和肾小管周肌样细胞中,因此,由IRS-1介导的胰岛素信号通路在多细胞部位调节睾丸功能(Kokk等人,2007)。IRS-1中Ser/Thr磷酸化的改变与胰岛素抵抗有关(Lu等人,2009年)。氧化剂和炎症介质导致IRS-1途径失效(Archuleta等人,2009;Dali- Youcef等人,2012年)。通过p-Akt (Ser473)/Akt比值的增加激活Akt途径,表明在高葡萄糖培养基的Leydig细胞中存在炎症特征(丛等人,2012a),并伴有IκBβ上调,表明Leydig细胞中存在炎症特征。
PPAR家族PPARα和PPARγ的两种亚型在睾丸功能障碍中显著下调。PPARα激活可通过抑制脂肪毒性、炎症反应和活性氧生成来减弱糖尿病血管病变(Hiukka等人,2010年),已成为预防糖尿病睾丸病的新靶点。PPARα激动剂通过提高testoster- one合成基因StAR和P450scc的表达,有效缓解血清睾酮水平下降(Li等人,2011年)。PPARγ调节支持细胞脂质代谢基因的表达且在精子发生中起主要作用(Thomas等,2011)。吡格列酮是一种PPARγ配体,具有抗氧化特性,可显著改善二型糖尿病患者的精子异常(Rabbani等人,2010)。PPARγ上调可缓解糖尿病患者的胰岛素抵抗和β细胞功能障碍(Sharma等人,2011年)。PPARα和PPARγ的下调与组织中的炎症反应有关(Abcouwer,2013;Hwang等人,2012年)。
MMP2/9是调节细胞外基质(ECM)数量的关键酶,受ET受体调节(Peng等人,2010)。ET-1是NADPH氧化酶的刺激剂,NADPH氧化酶的激活会引起睾丸中的氧化应激。在糖尿病中,功能障碍睾丸存在MMP2/9异常,这影响精子发生和雄激素生物合成,与糖尿病和缺氧引起的功能障碍睾丸的结果一致(Zhang等人,2013,,2009)。细胞间间隙连接通讯通过ECM经Cx40/43传导。Cx40/43表达下降是导致睾丸衰竭的重要事件,Cx40/43表达上调为异常生殖系统的恢复提供了基础。Cx43作为一种调节剂,对支持细胞和生殖细胞维持精子发生和血睾丸屏障的功能至关重要(Weider等人,2011;Li等人,2010),并且是诊断和治疗睾丸疾病的靶点(Chevallier等人,2012)。
5.结论
HFD病和低STZ病引起的糖尿病睾丸病功能障碍的特征是STAR表达低,血清睾酮和LH水平低。2型糖尿病睾丸病中存在低度炎症实体,这与二型糖尿病病是炎症问题的事实一致(Calle和Fernandez,2012)。在ER应激伴侣上调的糖尿病睾丸病表现中,IκBβ、p-Akt、OBRb和MMP2/9与下调的IRS-1、PPARα/γ和Cx40/43显著相关。与这些促炎因素相关的睾丸功能低下也可能表明心血管疾病的风险因素增加(Hyde等人,2012年)。
尽管对二型糖尿病及其睾丸病的含义已达成共识,但该问题的处理仍是一个有争议的问题(Calle和Fernandez,2012)。这些变化分别通过抗炎症和抗氧化活性对大精酸和缬沙坦有很好的反应。大黄酸双醋瑞因的另一种衍生物在HFD小鼠中提供了纠正胰岛素敏感性和抑制促炎细胞因子和内质网应激的益处(Tobar等人,2011)。将L-精氨酸结合到大黄酸部分的大精酸可能更有意义,因为它能输送NO(一氧化氮)供体并具有抗炎症活性,还能延长t1/2(丛等人,2012a,2012b),这有利于糖尿病睾丸病的治疗。