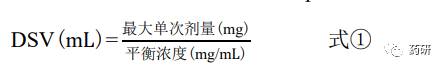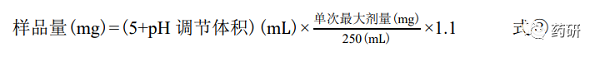摘要:测定了磷酸奥司他韦(2)和索非布韦(3)的平衡溶解度、油水分配系数和渗透性。采用 摇瓶法,分别测定了 2 和 3 在 pH 1.2、pH 4.5 及 pH 6.8 缓冲液中的平衡溶解度,判断药物的 溶解性;测定了 2 和 3 在不同 pH 条件下的正辛醇缓冲液体系中的油水分配系数;并通过平 行人工膜体外渗透技术,测定了 2 和 3 在 pH 5.0、pH 6.5 及 pH 7.4 缓冲液中的渗透性。结果 显示,2 为高溶解性、高渗透性药物,油水分配系数受油水体积比影响较大;3 为低溶解性、 高渗透性药物,具有较高的脂溶性。然而,用相同方法测定甲基多巴(1)时,由于样品稳定性 的问题,该药物的溶解性未得出结论。此外,本研究阐述并分析了研究过程中可能出现的问 题和影响因素,为 WHO 基本药物目录的建立提供了数据支持。
人体生物等效性试验豁免适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请 生物等效性(bioequivalence,BE)豁免[1—3],以国际公认的生物药剂学分类系统(BCS)为依据 [4]。而药物溶解性、肠道渗透性以及制剂溶出度是 BCS 系统的 3 个关键因素,其中高溶解性 药物可作为固体口服制剂 BE 豁免的重要指标[5]。
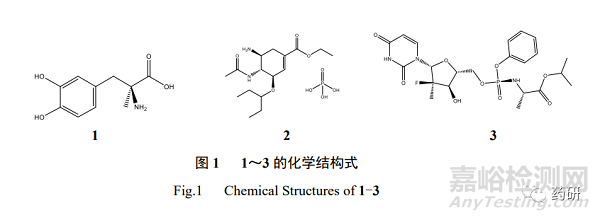
世界卫生组织(WHO)于 2009 年公布了基本药物目录中的 BCS 分类,2011 年美国 FDA 也总结归纳了一套 BCS 分类[6]。但是,由于 WHO 和美国 FDA 公布的 BCS 分类数据主要来 源于文献收集,未经过试验验证。因此,WHO 于 2016 年启动了 BCS 分类实验室验证项目 [7],由于化合物品种繁多,共分配给全球 9 个实验室(包括本研究单位)进行,本研究于 2019~ 2021 年完成了其中具有代表性的 3 个品种,即分别对甲基多巴(methyldopa,1)、磷酸奥司他 韦(oseltamivir phosphate,2)以及索非布韦(sofosbuvir,3)3 种药物的平衡溶解度、油水分配系 数以及渗透性进行了研究[8]。1~3 均被纳入 WHO 基本药物目录中,化合物结构式见图 1。
1 于 1960 年首次被发现,是一种2 受体机动型心血管药物,临床主要用于治疗高血压、 妊娠型高血压和先兆子痫。1 片最早由日本米诺源发制药株式会社研发并获批上市,单次最 大剂量为 250 mg。2 是神经氨酸酶抑制剂,即抗病毒类药物,2 胶囊(商品名为达菲)于 1999 年被美国 FDA 批准上市,并于 2004 年 7 月在中国上市,单次最大剂量为 75 mg。3 是美国吉 利德科学公司研发的治疗慢性丙肝的新药,该药物于 2013 年经美国 FDA 批准上市,于 2014 年经欧洲药品管理局(EMA)批准在欧盟各国上市,还未在中国上市,单次最大剂量为 400 mg。
目前平衡溶解度的测定方法主要有双指示剂滴定法、电位滴定法和酸碱滴定法等[9—10]。本研究采用摇瓶法和高效液相色谱法(HPLC)法测定药物的平衡溶解度,并通过药物溶解性与 渗透性评价系统(平行人工膜渗透技术,PAMPA[11] )对 3 种药物的油水分配系数及渗透性进 行了测定,同时对研究过程中发现的问题进行了分析与讨论,确定了药物的 BCS 分类,以期为基本药物目录的制定提供了数据支持。
一、仪器与试药
e2695 型高效液相色谱系统和 2489 型 UV/Vis 检测器(美国 Waters 公司);ME155DU 型电子天平和 S470-K 型 pH 计(瑞士 Mettler Toledo 公司);TURBISCAN TOWER 型多重光散射仪-稳定性分析仪(法国 Formulaction 公司);µDISS Profiler 药物溶解性与渗透性评价系统(美国 Pion 公司);聚四氟乙烯滤膜(美国 安捷伦公司,0.45 μm,13 mm);离心管(德国 Eppendorf 公司,聚丙烯,25 mL)。
1(匈牙利 Egis Pharmaceuticals PLC 公司,含量 99.8%,批号 600301217)、2(印度 Laurus Labs Limited 公司,含量 99.7%,批号 AOTV-2/VSP1/004/18)、3(印度 Solara Active Pharma Sciences Limited 公司,含量 99.5%,批号 PL40047113),以上样品均由 WHO 委托国外企业生产;2 对照品(含量 99.8%,批号 101096- 200901)和维生素 C(含量 100%,批号 100425-201103)(中国食品药品检定研究院);胃肠道模拟脂质体(批 号 520807)和 ASB 缓冲液(acceptor sink conditioned buffer,批号 520825)(美国 Pion 公司);无水乙酸钠(美 国 Sigma 公司,含量 99.0%,批号 BCCB2261);正辛醇、氯化钠、二水合磷酸二氢钠、磷酸钠、磷酸二氢 钾、氢氧化钾、氢氧化钠、盐酸、冰乙酸和磷酸均为分析纯,甲醇和乙腈为色谱纯,试验所用溶液均用电 阻率为 18.2 MΩ·cm 的去离子水配制。
二、方法与结果
2.1 HPLC 法测定药物的溶解性及方法学验证
2.1.1 色谱条件
1:色谱柱 Waters Symmetry® C18柱(4.6 mm×250 mm,5 μm);流动相 甲醇∶乙腈∶pH 6.0磷酸盐缓冲液(称取磷酸二氢钾6.8 g,加水980 mL使其溶解,用1 mol/L氢氧化钾溶液调至 pH 6.0)(245∶135∶620);流速1.2mL/min;柱温50 ℃;检测波长207 nm;进样量15μL。
2:色谱柱 Agilent XBridge C8柱(4.6 mm×250 mm,5 μm);流动相 甲醇∶0.1 mol/L pH 3.0磷酸钠缓冲液(称取磷酸钠16.4 g,加水1 L使其溶解,用磷酸溶液调至pH 3.0)(15∶85);流速1.0 mL/min;柱温35 ℃;检测波长280 nm;进样量20 μL。
3:色谱柱 Agilent XDB C18柱(4.6 mm×250 mm,5 μm);流动相 乙腈∶水(30∶70);流 速 1.0mL/min;柱温35 ℃;检测波长260 nm;进样量20 μL。
2.1.2 溶液配制
pH 5.0、pH 6.5及pH 7.4缓冲液:均参照《中华人民共和国药典》2020年版(ChP 2020)四 部通则8004缓冲液项下配制。
标准曲线溶液:精密称取1(由于WHO提供的样品量较大,且纯度较高,因此用样品配制 标准曲线溶液)100 mg,置50 mL量瓶中,加入0.1 mol/L盐酸溶液使其溶解并定容,作为1标准 曲线贮备液,精密量取1标准曲线贮备液适量,用0.1 mol/L盐酸溶液稀释成每1 mL中含1 0.2、 0.4、0.8、1.0、2.0 mg的1标准曲线溶液。精密称取2对照品1 g,置100 mL量瓶中,加入稀释剂 [水∶甲醇∶乙腈(620∶245∶135)]使其溶解并定容,作为2标准曲线贮备液,精密量取2标准曲线贮备液适量,用上述稀释剂制成每1 mL中含2 1、2、3、4、5 mg的2标准曲线溶液。精密 称取3 10 mg,置20 mL量瓶中,加入乙腈∶水(30∶70)使其溶解并定容,作为3标准曲线贮备 液,精密量取3标准曲线贮备液适量,用乙腈∶水(30∶70)制成每1 mL中含3 5.09、10.18、20.36、 40.72、50.90 μg的3标准曲线溶液。
质控样品溶液:取1,精密称定,加入0.1 mol/L盐酸溶液使其溶解并稀释成质量浓度约为 0.8 mg/mL的溶液,平行配制2份,其中1份经0.45 μm滤膜过滤,取续滤液及未过滤的溶液作为 1质控样品溶液。取2对照品,精密称定,加入稀释剂[水∶甲醇∶乙腈(620∶245∶135)]使其 溶解并稀释成质量浓度约为3.0 mg/mL的溶液,平行配制2份,其中1份经0.45 μm滤膜过滤,取 续滤液及未过滤的溶液作为2质控样品溶液。取3,精密称定,加入乙腈∶水(30∶70)使其溶 解并稀释成质量浓度约为0.2 mg/mL的溶液,平行配制2份,其中1份经0.45 μm滤膜过滤,取续 滤液及未过滤的溶液作为3质控样品溶液。
2.1.3 系统适用性试验
分别取“2.1.2”项下 1~3 标准曲线溶液,分别按“2.1.1”项下方法进样测定,结果见图 2。1~3 峰理论塔板数分别为 13 026、10 733、10 312,拖尾因子分别为 1.15、1.32、1.12;标 准曲线溶液(中间浓度点)连续进样 5 针的峰面积 RSD(n=5)分别为 0.05%、0.11%、0.17%。
2.1.4 线性试验
分别取“2.1.2”项下的 1~3 标准曲线溶液,分别按“2.1.1”项下色谱条件进样测定,以 质量浓度 c 为横坐标,峰面积 A 为纵坐标进行线性回归。结果显示,1~3 分别在 0.20~2.00 mg/mL、1.001~5.005 mg/mL、5.09~50.9 μg/mL 内线性关系良好,回归方程分别为 A=13 842 307c+231 497,r=0.999 9;A=13 609 650c+4 951 215,r=0.998 7;A=10 703c+3 554,r=0.999 7。
2.1.5 精密度试验
分别取“2.1.2”项下的 1~3 标准曲线溶液(中间浓度点),分别按“2.1.1”项下色谱条件进样 测定,连续进样 5 针。结果显示 1~3 峰面积的 RSD(n=5)均小于 0.2%,说明方法精密度较高。
2.1.6 准确度试验
分别取“2.1.2”项下的 1~3 质控样品溶液,分别按“2.1.1”项下色谱条件进样测定,以 标准曲线法计算过膜后的溶液溶度。结果显示,1~3 质控样品溶液过膜前后质量浓度的误差 均小于 1.0%,回收率在 99.1%~100.0%。
2.1.7 回收率试验
分别取“2.1.2”项下的 1~3 质控样品溶液,分别加入等体积“2.1.2”项下的 1~3 标准 曲线溶液,分别配制成低、中、高 3 个浓度水平的加标供试品溶液,按“2.1.1”项下色谱条 件进样测定并计算回收率。结果显示,1~3 的平均回收率(n=3)分别为 99.69%、99.90%、 99.46%,RSD 分别为 0.04%、0.04%、0.05%。
2.2 平衡溶解度的测定
2.2.1 缓冲液的配制
pH 1.2 缓冲液:称取氯化钠 2.52 g,加入水 900 mL 使其溶解,用 70 g/L 的盐酸溶液调至 pH 1.2,再用水定容至 1 000 mL。
pH 4.5 缓冲液:称取乙酸钠 2.99 g,加入水 900 mL 使其溶解,用 120 g/L 乙酸溶液调至 pH 4.5,再用水定容至 1 000 mL。
pH 4.5 缓冲液:称取乙酸钠 2.99 g,加入水 900 mL 使其溶解,用 120 g/L 乙酸溶液调至 pH 4.5,再用水定容至 1 000 mL。
2.2.2 测定方法及结果
平衡溶解度的测定采用摇瓶法,称取 1~3 样品适量,分别加入“2.2.1”项下的 3 种 pH 值的缓冲液适量,形成过饱和溶液(固体样品过量 10%~30%),并用 0.1 mol/L 盐酸溶液或 0.1 mol/L 氢氧化钠溶液调节 pH 值至初始值附近,每个 pH 值平行配制 3 份。置恒温摇床中, 转速 120 r/min,温度(37±0.5)℃,分别在 2、4、6、8、12、24、48、72 h 取样 1 mL,用 0.45 μm 滤膜过滤,弃去初滤液,取续滤液适量,用对应 pH 值缓冲液进行定量稀释,使质量浓度 在标准曲线范围内,若超出范围可进行再次稀释,并按“2.1.1”项下色谱条件进样测定。
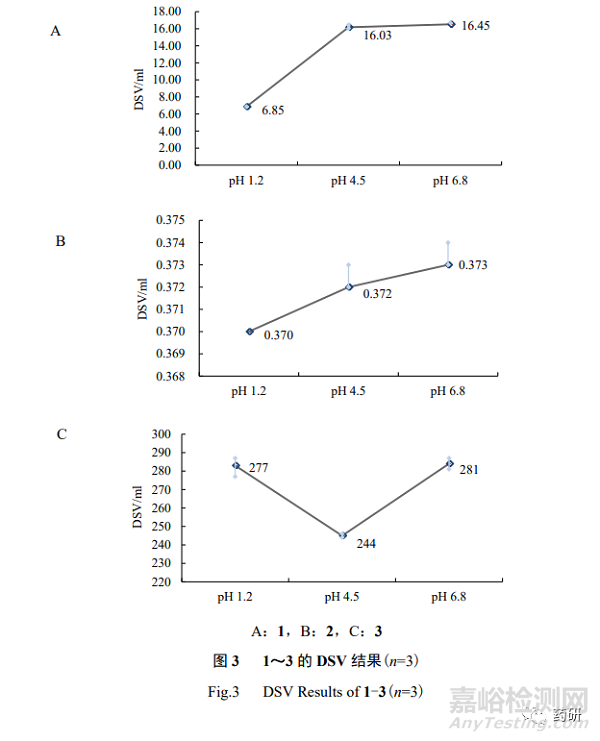
根据不同时间点取样的 HPLC 测定浓度值,绘制时间浓度曲线,平台浓度点(相邻 2 个取 样点浓度相近)即为“平衡时间”,该时间点取样的浓度即为“平衡溶解度”。此外,按式① 分别计算不同 pH 值缓冲液的溶解度体积(DSV,mL),当所有 pH 值条件下的 DSV 均低于 250 mL,则判断为高溶解性;若某 pH 值条件下的 DSV 高于 250 mL,则判断为低溶解性。
1~3 的 DSV 结果见图 3,综合 3 个 pH 值条件下的 DSV 结果,2 为高溶解性;3 为低 溶解性,而 1 的溶解性为无法判断(无法判断的原因详见本研究讨论部分“3.1”项下)。
2.3 油水分配系数的测定
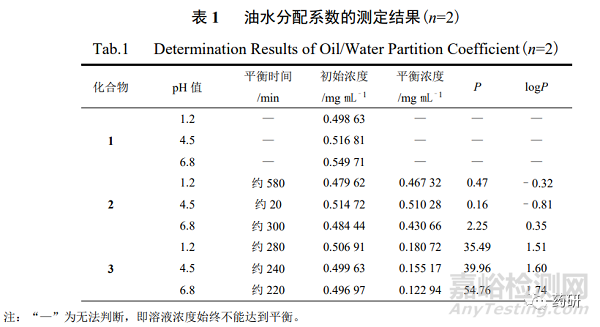
采用药物溶解性与渗透性评价系统测定油水分配系数,分别称取 1~3 样品适量,分别用 “2.2.1”项下不同 pH 缓冲液配制成 1~3 质量浓度各约为 0.5 mg/mL 的溶液,分别量取上述 溶液 18 mL,置 25 mL 水浴池中,分别加入由相应 pH 缓冲液饱和的正辛醇溶液 1 mL,内置 转子(150 r/min),于 37 ℃水浴锅中 24 h,光纤探头置于缓冲液层。1~3 的检测波长分别为 205~210 nm、275~285 nm、255~265 nm,每分钟采集 1 次,待溶质分配平衡时分别计算油 相(o)和水相(w)的质量浓度(co、cw),并计算油水分配系数(P,co/cw)及 logP,结果见表 1。
综合平衡溶解度与油水分配系数的测定结果可知,2 的水溶性较强,其表观分配系数受 水相组成、缓冲液 pH 值和油水体积比的影响不大;3 则具有较强的脂溶性,在 3 种不同的 pH 缓冲液中均得到较高的油水分配系数;在 3 种 pH 缓冲液中均无法测定 1 的油水分配系数, 24 h 内水相(w)中 1 浓度无明显变化。有研究表明,油水分配系数过低,药物不易透过脂质分 子膜,油水分配系数过高,药物因强脂溶性难以进入淋巴、血液系统中,无法发挥药效,为 了让药物得到充分吸收,使其发挥最佳药效,药物的油水分配系数最好在–2~3 内[12—14]。
2.4 渗透性的测定
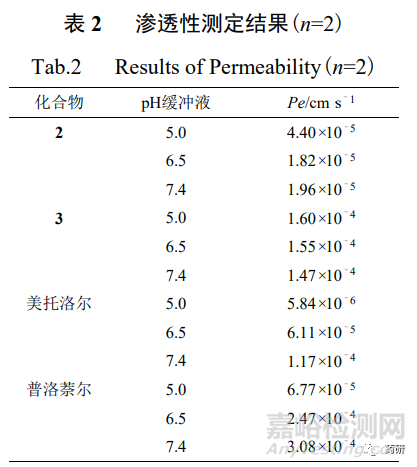
采用PAMPA技术测定1~3样品的渗透性,称取1~3样品约4 mg,置药物溶解性与渗透性 评价系统的供体室,精密量取“2.2.1”项下不同pH缓冲液和ASB缓冲液各20 mL,分别置供体 室和受体室中,两室间以面积为1.65 cm2的仿生膜(经脂质体22 μL浸润)隔离,温度为37 ℃, 搅拌速度为150 r/min,采集时间为8 h,采样间隔60 s,检测波长为220~320 nm,采用光纤探 头分别实时监测药物浓度,按照式②计算药物的有效渗透性(Pe,cm/s)。根据美国FDA发布 的《固体口服制剂的体内生物利用度和生物等效性研究》指导原则以及其给出的不同渗透性 药物[15],本研究分别选取了高渗透性药物,即美托洛尔和普洛萘尔,在同等条件下测定其Pe值以建立模型,通过对比结果来判断2和3的渗透性。
式中 Pe 为有效渗透性(cm/s);ct 为供体室中药物的初始质量浓度(μg/mL);dc/dt 为单位 时间内受体室中药物浓度的变化速率(μg·mL–1·min–1);V 为受体室缓冲液的体积(mL);A 为 膜面积(cm2)。
2 和 3 的渗透性测定结果见表 2(1 是主动转运机制[16],通过该系统测定其渗透性无实际 意义),2 和 3 在不同 pH 缓冲液体系中的 Pe 值基本均大于模型药物(2 在 pH 7.4 缓冲液体系 除外),可判断 2 种药物均为高渗透性药物。
三、 讨论
3.1 药物稳定性对溶解度判断结果的影响
在整个研究过程中发现,2 和 3 在 3 个不同 pH 值缓冲液中较稳定,1 在 pH 6.8 缓冲液中 会发生降解,在试验过程中溶液会由无色逐渐变为粉色,最终变为黑色,并伴有黑色沉淀产 生。由于整个试验过程中溶液始终保持过饱和状态,因此,通过 HPLC 测定仍然能够找到溶 解平衡点。通过多重光散射仪对溶液的透光率进行分析,发现 1 在 pH 6.8 缓冲液中溶液的透 光率在 16 h 内从 0 降至约 25%;在同样的条件下,适当加入维生素 C,发现溶液的透光率未 发生变化。通过稳定性研究以及查阅相关文献得知[17],1 在中性或碱性条件下会发生氧化反 应,产生黑色沉淀。从色谱分析数据以及计算结果来看,1 在 3 个 pH 缓冲液条件下的平均 DSV 值均小于 250 mL,应当判断为高溶解性。然而,此次研究是由国际多个实验室同时进行 比对分析,对于 1 药物,国内、国际 3 个实验室得出了不同的结论,因此对于该药物的溶解 性目前仍未给出结论。
3.2 调节 pH 对溶解度试验的影响
测定平衡溶解度时,在药物稳定的基础上,pH 值的调节也尤为重要。2 和 3 在 3 个缓冲 液中,pH 值均能调至初始 pH 值附近。1 在 pH 1.2 缓冲液条件下配制溶液时,依据 1 单次最 大剂量为 250 mg,试验时首先称取 1 约 300 mg,加入 pH 1.2 缓冲液 10 mL,振摇至全部溶 解,再次加入 1 100 mg,发现少量样品未溶解,测定 pH 值约为 1.8,采用 0.1 mol/L 盐酸溶液 调至 pH 1.2,发现所有样品全部溶解,再次加入样品 100 mg,再次发生上述现象。因此,本 次研究不再继续调节 pH 值,使供试品溶液始终保持过饱和状态。
3.3 样品量及缓冲液体积的确定
在整个研究过程中,供试品溶液始终维持在过饱和状态,对于高溶解性药物来说,对样 品量的要求较高。例如在本次研究中,WHO 提供的 3 仅为 0.640 g,这对试验设计提出了较 高的要求。本次研究采用不同 pH 值的缓冲液 5 mL,依据单次最高剂量分别计算每个 pH 值 条件下的所需样品量(见式③),从而保证试验结果的准确性。
3.4 渗透性测定中波长段的选择
以 3 在 pH 6.5 缓冲液体系中的渗透性测定为例,供体室中样品浓度从 4 h 起趋于平衡, 故本试验节选 4~8 h 的渗透数据进行统计计算,选取紫外吸收图谱中下坡段曲线,即 290~ 300 nm 波长段进行实时监测。
3.5 BCS 分类
基于上述研究结果可知,2 为高溶解性-高渗透性药物,BCS 分类应为 1 类;3 为低溶解 性-高渗透性药物,BCS 分类应为 2 类。
WHO 基本药物目录在不断地补充与更新,目前没有公认的方法对药物平衡溶解度进行 测定。此外,药物的 BCS 分类也急需试验数据作为支撑。本研究通过测定 3 种不同药物的平 衡溶解度、油水分配系数以及渗透性,阐述并分析了研究过程中可能出现的问题以及试验结 果的影响因素,为 WHO 基本药物目录的建立提供了数据支持。