单克隆抗体药物在上市批准之前要经过广泛的稳定性研究,以考察环境因素(包括温度、湿度、光照和氧化等)随时间变化如何影响产品的质量。其中的使用中稳定性研究是确保药物安全性和有效性的重要组成部分[1-2]。使用中稳定性研究是指为保证药物制剂在一定使用期间内的稳定而进行的试验[3]。不同的监管机构均对使用中稳定性研究作出要求,其中人用药品注册技术国际协调会议(International Conference on Harmonization,ICH)Q1A(R2)指出,必要时,对配制或稀释后使用的制剂应进行稳定性试验,可为标签上的配制、贮藏条件和配制或稀释后的使用期限提供依据。申报批次应在配制和稀释后的初始和建议的使用期末进行稳定性试验,作为正式稳定性试验的一部分[4]。世界卫生组织(World Health Organization,WHO)于2018年更新的《原料药及药品的稳定性测试》[5]要求药物使用中稳定性需要尽可能地模拟实际使用的过程,进行药品使用期间物理、化学、微生物特性等项目的检测;试验至少要2批中试规模样品,并建议其中至少1批在长期稳定性试验的货架期末进行试验。《中华人民共和国药典》(以下简称《中国药典》)2020年版[6]9402“生物制品稳定性试验指导原则”也指出“其他对于需要复溶、稀释的产品,应根据具体情况对使用过程中涉及的条件设计相应的稳定性试验。”
肿瘤免疫靶向治疗作为一种新型的治疗手段,改变了晚期恶性肿瘤的临床治疗方式,也极大地扭转了依赖放疗、化疗和手术等癌症治疗手段的现状。截至2022年3月,我国已批准上市10余种PD-1/PD-L1抗体药物,适应症包括黑色素瘤、尿路上皮癌、霍奇金淋巴瘤、肝细胞癌、非小细胞肺癌等多种肿瘤疾病[7-11]。本次研究用的药品为已上市的其中一种国产PD-1抗体药物,本品首次上市申报时采用了代表性时间点的样品进行使用中稳定性试验,为了更加全面评价本品的使用中稳定性开展此研究。
一、 材料与方法
1.1 样品
重组人源化抗PD-1单克隆抗体参比品及效期末样品均为本实验室留样。
1.2 研究方案
参考本品说明书中描述“静脉输注时配制成最终浓度为1 mg·mL-1至3 mg·mL-1的输注液;无菌操作下配制的输注液,室温下放置不超过6小时,在2~8 ℃下保存时间不超过24小时”,并模拟临床实际给药的情况,制备低浓度(1.0mg·mL-1)和高浓度(5.0 mg·mL-1)样品,考察在2~8 ℃和室温(25 ℃)条件下放置一定时间,以及经一次性使用无菌注射器输注后产品质量的变化。
1.2.1 低剂量/高剂量使用中稳定性样品的制备
1)从100 mL 0.9%氯化钠注射液袋中抽取出相应体积的0.9%氯化钠注射液;将相应体积的抗PD-1单克隆抗体注射液注入注射液袋中,轻轻混匀样品并避免产生气泡,制备低浓度和高浓度样品,各取样10 mL作为0 h样品。
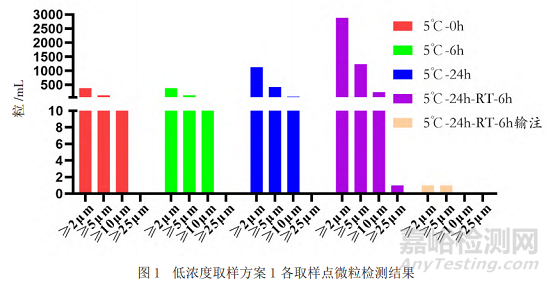
2)低浓度和高浓度样品在5 ℃条件下分别放置6、24 h制备5 ℃-6 h、5 ℃-24 h样品,再将5 ℃-24 h样品放置于室温(25±2)℃条件下6 h,作为5 ℃-24 h-25 ℃-6 h样品。将5 ℃-24 h-25 ℃-6 h条件样品连接输液器,重力输注至结束并收集流出液,混匀后作为5 ℃-24 h-25 ℃-6 h输注样品(取样方案1)。
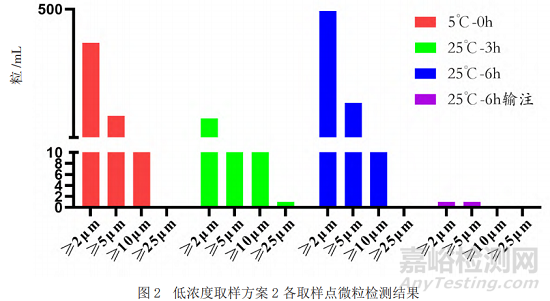
3)低浓度和高浓度样品,同时在室温(25±2)℃光照环境条件下放置3、6 h作为25 ℃-3 h、25 ℃-6 h样品;将25 ℃-6 h条件样品连接输液器,重力输注至结束并收集流出液,混匀后作为25 ℃-6 h输注样品(取样方案2)。
1.2.2 评价指标
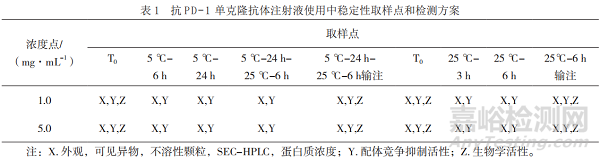
对模拟临床使用过程中不同取样点的低浓度和高浓度样品进行不溶性微粒和可见异物检查,对蛋白质浓度、分子排阻高效液相色谱、配体竞争抑制活性、生物学活性进行检测分析(表1)。
1.3 细胞
表达PD-L1的CHO-K1细胞系(CHO-K1/PDL1)、转染PD-L1与膜型抗CD3单链抗体的CHO细胞系(CHO/PD-L1-CD3L)、稳定转染PD-1与NFAT反应元件控制下的荧光素酶基因的Jurkat 细胞系(Jurkat/PD-1-NFAT)由中国食品药品检定研究院单克隆抗体产品室保存、传代。
1.4 试剂材料
TSK G3000SWXL 色谱柱(300 mm×7.8 mm,5μm)购自Tosoh 公司;胰蛋白酶购自Gibco公司;Biotin-PD-L1-Fc、PD-1抗原、辣根过氧化物酶标记链霉亲和素为中国食品药品检定研究院单克隆抗体产品室留存。潮霉素B购自Roche公司,遗传霉素购自Gibco公司;RPMI1640、F12培养基、PBS、NEAA均购自Gibco公司;ONE-Glo™荧光素酶检测试剂盒购自Promega公司;96孔板(白板)、96孔板(透明板)购自Costar公司;十二水合磷酸氢二钠、二水合磷酸二氢钠、无水硫酸钠购自国药集团化学试剂有限公司;一次性精密过滤输液器(0.2μm,PES filter)购自山东新华安得医疗用品有限公司,10、20 mL一次性使用无菌注射器购自碧迪医疗器械(上海)有限公司,0.9%氯化钠注射液购自上海百特医疗用品有限公司。
1.5 主要仪器
高效液相色谱仪配有紫外检测器及Empower数据处理系统(Waters公司);SPECTRAM5酶标仪(Molecular Device公司);紫外分光光度计;CO2培养箱;生物安全柜;细胞计数仪。
1.6 方法
1.6.1 不溶性微粒和可见异物检查
不溶性微粒采用光阻法分析,按2020年版《中国药典》通则0903检测并报告≥10 μm、≥25 μm的微粒数;可见异物按2020年版《中国药典》通则0904检查。
1.6.2 蛋白质浓度
采用紫外-可见分光光度法对样品蛋白含量进行检测,用样品稀释液将供试品稀释至约0.4mg·mL-1,检测280 nm处吸收度A,根据公式计算蛋白质浓度C(mg·mL-1),C=A/ε×DF,式中,ε为消光系数(1.42),DF为稀释倍数。
1.6.3 分子排阻高效液相色谱
用超纯水将检测样品稀释至2.0 mg·mL-1,采用Waters 2695 HPLC系统、2489紫外检测器、TSK G3000SWXL色谱柱进行检测。流动相:50mmol·L-1磷酸盐缓冲液(NaH2PO4-Na2HPO4),300 mmol·L-1硫酸钠溶液,pH 7.0±0.2;流速:0.5 mL·min-1;上样量:25μL(2.0 mg·mL-1);柱温:室温;样品池温度:4 ℃;检测波长:280nm;检测时间:30 min。利用WATERS 2695 HPLC系统工作站对实验结果进行数据处理,采用面积归一化法计算纯度。
1.6.4 配体竞争抑制活性
包被PD-1抗原37 ℃孵育1 h,洗板3次;用2%BSA置于37 ℃封闭1 h,洗板3次;用一定浓度的Biotin-PD-L1-Fc将样品及参比品以100 μg·mL-1为起始浓度3倍比稀释11个梯度,每孔加入100µL, 37 ℃孵育1 h;洗板3次,加入辣根过氧化物酶标记链霉亲和素置于37 ℃孵育1 h,洗板6次;TMB 显色;450 nm 读数,并以参比品为对照计算样品的相对活性。
1.6.5 生物学活性
用F-12培养基将CHO-PDL1细胞密度调整为5×105 cells·mL-1,每孔100 μL接种于96孔白板中;37 ℃、5% CO2培养18 h;将样品及参比品以120 µg·mL-1为起始浓度3倍比梯度稀释10个梯度,加入去除细胞上清的CHO-PDL1细胞板中;再将Jurkat效应细胞密度调整至2.5×106 cells·mL-1,每孔40 µL的细胞加入细胞板中,37 ℃、5% CO2培养6 h;每孔添加100 μL ONE-Glo™荧光素酶,并在SPECTRAM5 酶标仪上采用化学发光模式进行读数,利用四参数方程进行拟合,对生物学活性进行分析。
二、 结果
2.1 外观、可见异物和不溶性微粒
采用目视的方法对不同取样点的样品进行检测,结果显示均为无色澄清溶液且无明显可见异物。本研究采用光阻法对不同放置时间、不同稀释浓度的样品的不溶性微粒进行分析,除常规的质量标准中报告≥10 μm、≥25 μm的微粒数外,还检测了2 μm和5 μm的不溶性微粒。结果如图1和图2显示(高浓度和低浓度结果趋势一致,数据未呈现),随着放置时间的延长,不溶性微粒数呈增加趋势,但经输液器输注后样品的微粒数明显减少。
2.2 蛋白质浓度
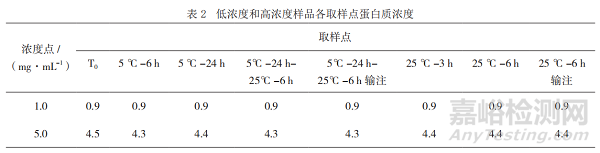
结果显示,低浓度和高浓度样品各取样点(含经过输液器流出的样品)的蛋白质浓度均符合拟定质量标准(目标浓度±15%)且未发生明显变化,见表2,表明本品临床采用的一次性输液器对产品未产生明显的吸附。
2.3 分子大小变异体
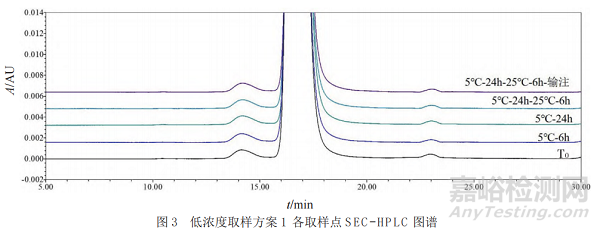
采用SEC-HPLC(方法精密度RSD为0.3%)对低浓度和高浓度样品每个时间点的分子大小变异体进行分析,代表性检测图谱见图3,所有取样点单体的含量均为99.3%,聚体含量为0.7%~0.8%,未检测出片段。
2.4 配体竞争抑制活性和细胞生物学活性
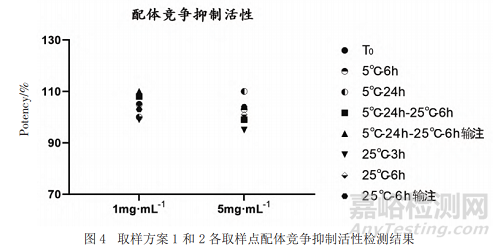
采用ELISA法评价的低浓度和高浓度样品每个时间点的配体竞争抑制活性,结果显示,不同时间点配体竞争抑制活性均满足拟定质量标准(70%~130%)且未见明显变化(见图4);
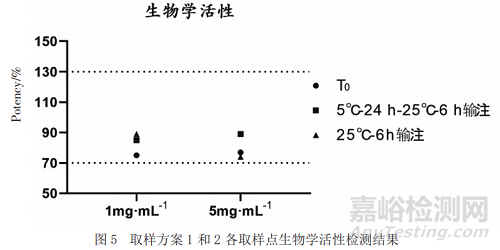
利用荧光素酶报告基因法检测低浓度和高浓度样品0 h以及不同条件下输注后样品的生物学活性,结果显示均满足拟定质量标准(70%~130%)且未见明显变化(见图5)。
三、 讨论
本研究主要通过理化活性手段评价效期末样品的高、低2个浓度的使用中稳定性。结果显示,不同浓度点在不同时间点竞争结合活性和生物学活性未见明显变化趋势;对于可能影响效价和免疫原性的抗体聚体和片段未见增加;不溶性微粒检测结果显示,随着放置时间的延长,不溶性微粒数呈增加趋势,但经输液器输注后样品的微粒数明显减少,这是由于参照本品说明书,输注时采用了连接0.2 µm过滤器的一次性精密过滤输液器所致;另外,其他的质量属性(外观、可见异物、蛋白质浓度)在所有研究条件下也保持较好的稳定性。上述研究结果支持本研究采用的近效期末抗PD-1单抗药物具有良好的使用中稳定性。
相对于小分子药物,单克隆抗体药物结构更复杂并且对外界环境更敏感,在配制和使用过程的多种因素均可能引起药物关键质量属性的变化,从而影响产品的稳定性[12-15];另外,药物在配制和使用过程中还可能受微生物、细菌内毒素等污染,影响药物的无菌保证水平,所以严格意义上,除评价使用稳定性样品的理化活性类质量属性以外,对于需要制备至输注超过4 h的,还应开展微生物挑战研究评估单抗注射液经稀释后的促微生物生长和/或抗菌活性,以支持稀释后注射前样品的贮存。此外,一般考虑到使用中稳定性研究试验应能够模拟最差条件,所以建议研究应选择货架期末的产品进行使用中稳定性研究。但是相关指导原则[5]中也指出,实际申报时常因稳定性数据有限,无法获得效期末的试验数据,此时可提供申报时长期稳定性的最后一个时间点用于使用稳定性研究的试验数据。