今日头条
贝达口服HIF-2α抑制剂获批临床。贝达药业口服HIF-2α抑制剂BPI-452080获国家药监局临床试验默示许可,拟开发用于单药治疗晚期恶性实体瘤患者。临床前研究显示,BPI-452080能够特异性阻断HIF-2α与HIF-1β异二聚化,从而抑制下游基因的转录表达,在多种缺氧或氧感知通路异常的肿瘤细胞和动物模型上展现出积极的体外活性和体内药效,并具有良好的药代动力学性质及安全性。
国内药讯
1.赛诺菲长效降糖复方在华获批上市。赛诺菲赛益宁® 【甘精胰岛素利司那肽注射液(I)、(II)】获国家药监局批准上市,在饮食和运动基础上联合其他口服降糖药物,用于血糖控制不佳的成人2型糖尿病患者(T2DM)。赛益宁®是甘精胰岛素(基础胰岛素类似物)与利司那肽(GLP-1RA*)复方制剂,一天一次有效帮助患者实现血糖达标,且低血糖发生风险小,不增加体重。
2.正大天晴PD-L1单抗报产。正大天晴1类生物制品TQB2450注射液联合盐酸安罗替尼胶囊一线治疗小细胞肺癌的上市申请获CDE受理。TQB2450是一款PD-L1单抗,正在多项临床中评估治疗肾细胞癌、三阴乳腺癌、非小细胞肺癌、小细胞肺癌和头颈部鳞状细胞癌等潜力。此前,该新药已被CDE纳入突破性治疗品种,用于治疗非微卫星高度不稳定(非MSI-H)或非DNA错配修复缺陷(非dMMR)的复发性或转移性子宫内膜癌。
3.艾美启动新冠mRNA疫苗III期临床。艾美疫苗在ClinicalTrials.gov上登记启动新冠mRNA疫苗LVRNA009的全球多中心III期临床,拟评估用于18岁及以上人群预防新冠肺炎的有效性、安全性和免疫原性。该项研究计划招募34000名健康受试者。在II期临床中,LVRNA009在全程免疫后14天时,中剂量组和高剂量组受试者中的活病毒中和抗体几何平均滴度GMT分别达到994.9和1405.7;与疫苗接种有关的不良反应以1级为主。
4.再鼎引进复方抗生素拟纳入优先审评。再鼎医药从Entasis公司(已被Innoviva收购)引进的注射用舒巴坦钠/注射用度洛巴坦钠(SUL-DUR)组合包装获CDE拟纳入优先审评,用于治疗成人鲍曼-醋酸钙不动杆菌复合体(ABC,包括多重耐药和碳青霉烯类耐药菌株)引起的感染。在III期ATTACK研究中,与多黏菌素相比,SUL-DUR治疗使碳青霉烯耐药ABC感染患者的28天全因死亡率更低(19%vs32.3%)。在美国,FDA已将SUL-DUR的上市申请纳入优先审评,PDUFA日期为明年5月29日。
5.和铂B7H7单抗在美获批临床。和铂医药自主研发的靶向B7H7的潜在“first-in-class”全人源单抗HBM1020获FDA批准开展I期临床,评估用于晚期实体瘤治疗的安全性、耐受性、药代动力学和抗肿瘤活性。HBM1020通过阻断免疫检查点靶点和配体的结合,增强抗肿瘤免疫。临床前数据已证实了该新药免疫激活和抗肿瘤的治疗潜力。目前尚无其他企业布局B7H7靶点。
国际药讯
1.诺和诺德口服司美格鲁肽获FDA扩展标签。诺和诺德口服GLP-1受体激动剂司美格鲁肽(Rybelsus,7mg和14mg)的标签更新获FDA批准,可作为2型糖尿病成人患者的一线疗法,去除了该药原先用于初期2型糖尿病患者的限制。在PIONEER研究中,与对照组相比,口服司美格鲁肽降低了患者的糖化血红蛋白水平(HbA1c)与体重,而且药物具有良好的耐受性与安全性。
2.TSLP单抗家用预充针获CHMP推荐批准。欧洲药品管理局人用药品委员会(CHMP)推荐批准阿斯利康Tezspire(tezepelumab)预充式注射笔上市,用于12岁及以上的重度哮喘患者居家使用。Tezspire是一款first in class的人源化TSLP靶向单抗,已于2021年12月获得FDA首批,用于作为12岁及以上的重度哮喘患者的附加维持治疗方案。TSLP是一种上皮细胞因子;气道中TSLP的表达水平上调与哮喘严重程度相关。
3.罗氏抗流感新药获欧盟批准用于低龄儿童。欧盟批准罗氏与盐野义制药开发的Xofluza(玛巴洛沙韦,baloxavir marboxil)扩大使用人群,用于1岁及以上人群的无并发症流感治疗以及流感暴露后预防。玛巴洛沙韦是一种First-in-Class的口服单剂抗病毒药物,可治疗对奥司他韦耐药的病毒株和禽流感病毒株。在III期研究中,玛巴洛沙韦相较于奥司他韦缩短了患者体内流感病毒清除所需时间(24.2小时vs75.8小时),单剂口服降低了86%的已接触感染的家庭成员患流感的风险。
4.THR-β激动剂NASH关键Ⅲ期临床积极。Madrigal公司口服选择性甲状腺激素受体(THR)-β激动剂resmetirom治疗非酒精性脂肪肝炎(NASH)的关键Ⅲ期临床最新数据积极。肝脏活检分析显示,两种剂量的resmetirom治疗均达到显著改善NASH肝脏组织学的终点;在活检分期为F2、F3和F2/F3亚组中,患者对于两种剂量resmetirom治疗的反应也具统计学意义。Madrigal计划明年上半年提交新药申请,并寻求加速批准。
5.抑郁症靶向新药Ⅱa期临床结果积极。Alto Neuroscience公司针对治疗抑郁症(MDD)与创伤后应激障碍(PTSD)所开发的口服BDNF靶向新药ALTO-100在Ⅱa临床中获积极结果。在治疗第6周时,带有生物标志物的MDD患者(n=59)与不带有生物标志物的患者(n=64)相比,患者MADRS评分下降幅度更高(15.5分vs10.6分,p=0.001),达成临床应答的患者比例更高(81%vs38%,p=0.01)。该结果支持ALTO-100于2023年1月进入Ⅱb临床试验。
6.拜耳子公司与基因药物公司达成研发合作。拜耳子公司Asklepios BioPharmaceutical(AskBio)与ReCode公司将利用后者的选择性器官靶向脂质纳米颗粒技术,针对AskBio所选的合成DNA和基因编辑核酸酶,合作开发精准基因治疗候选药物。这项合作可以扩大基因编辑对肝脏和肺部疾病靶点的影响。根据协议,ReCode将获得一笔预付款,里程碑后期付款以及合作产品的特许权使用费。
医药热点
1.武汉大学人民医院先进医学研究院揭牌。1月12日,武汉大学人民医院与武汉大学高等研究院签署战略合作框架协议,共同成立“武汉大学人民医院先进医学研究院”并揭牌。武汉大学人民医院先进医学研究院旨在搭建医学与生命科学、化学、物理学、材料科学及相关研究领域交叉创新研究与转化平台,集合跨学科人才与资源,大力推动医院高质量发展。中国科学院院士朱玉贤受聘担任研究院院长。武汉大学高等研究院阴国印教授、武汉大学人民医院刘忠纯教授受聘担任研究院执行院长。
2.全国新冠相关死亡约6万例。国务院联防联控机制14日就重点人群健康保障有关情况举行新闻发布会。国家卫健委医政司司长焦雅辉披露,通过分析显示,2022年12月8日至2023年1月12日,全国医疗机构累计发生在院新冠病毒感染相关死亡病例59938例,其中基础疾病合并新冠病毒感染死亡病例54435例。死亡病例平均年龄80.3岁,65岁及以上约占90.1%,其中80岁及以上约占56.5%,死亡病例中90%以上合并有基础疾病。
3.广东建立预防接种异常反应补偿新机制。近日,广东省卫健委等多部门联合印发新版《广东省预防接种异常反应补偿保险实施方案》。新版《方案》明确,免疫规划疫苗预防接种异常反应补偿保险由政府统一购买,省级财政安排专项资金支付保险费;非免疫规划疫苗预防接种异常反应补偿保险,由在广东省销售非免疫规划疫苗的疫苗企业自主自愿购买、支付保险费。
评审动态
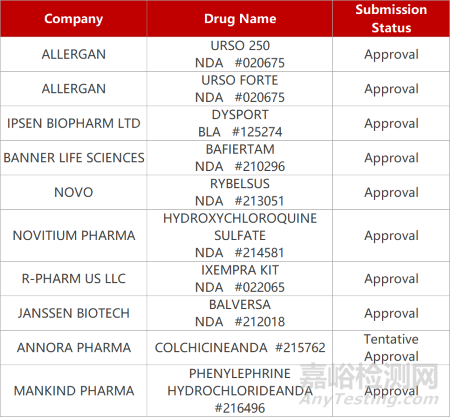
1. CDE新药受理情况(01月15日)
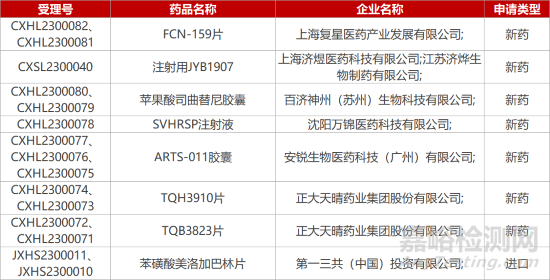
2. FDA新药获批情况(北美01月12日)