FDA器械与辐射健康中心(CDRH)发布2022年年度报告,以突出该中心截至2022年12月31日的成就,其中包括:应对突发传染病大流行、医疗器械用户费用修正案(Medical Device User Fee Amendment MDUFA)、器械创新(DEVICE INNOVATION)、OTC助听器最终规则和器械安全(Device Safety)。1
截至到2022年12月31日,CDRH已将 135 台设备纳入了“突破性设备计划”(自2015年计划成立以来,总共 752 个设备被纳入“突破性设备计划”),并授予19个“突破性设备”的市场授权。
什么是“突破性设备计划”?
突破性设备计划(Breakthrough Devices Program) 是美国食品药品监督管理局(FDA)于2015年4月启动的一种加快医疗器械开发和审查过程的“绿色通道”,让患者能尽快获得有效诊断或可治疗危及生命疾病的医疗器械。
被FDA纳入“突破性设备计划”有什么好处?
FDA将被授予“突破性医疗器械”称号的产品提供有关设备开发、临床试验方案的优先权审查、FDA审核团队支持以及产品商业化决策的交流服务。此举可以大大推动创新医疗器械的上市过程。
FDA是否会公布设备何时被授予突破性设备称号?
在获得上市许可证之前,除非申办者决定向公众提供该信息,否则FDA不能公开披露申办者是否已提交器械突破性器械请求。此外,FDA计划在官网上定期更新获得突破性设备称号的设备列表,一旦设备获得营销授权,就会将设备添加到列表中。
图 获得突破性设备的类别
FDA目前公布了哪些获得营销授权的突破性产品?
下表为截至到2022年9月30日,已获得上市许可的CDRH和CBER突破性设备列表。(此表为截至发文时间,FDA官网所公布的突破性设备列表,文末已附突破性设备列表原文链接)
产品1:Phagenyx System
制造商:Phagenesis Limited

产品介绍:
Phagenyx System是一种先进的治疗系统,通过咽部电刺激(PES)对吞咽协调的神经组分进行刺激,来治疗由神经系统的破坏而产生的神经源性吞咽困难。该系统适用于治疗常常会遇到吞咽难题的中风病人、老年病人以及那些在加护病房内需要依靠机械通气设备的病人。
产品2:MAGNUS NEUROMODULATION SYSTEM (MNS) WITH SAINT TECHNOLOGY, MODEL NUMBER 1001K
制造商:MAGNUS MEDICAL, INC.
产品介绍:
SAINT神经调节系统可以用于治疗重度抑郁症。SAINT具有作用快速、非侵入性等特点。它结合了先进的成像技术、个性化瞄准和新颖的神经刺激模式,通过使用突破性算法,SAINT可以对脑神经进行结构定位和功能性层面的MRI成像,从而确定重度抑郁症患者接收神经刺激的最佳靶点。
产品3:Leva Pelvic Health system
制造商:RENOVIA, INC.
产品介绍:
leva骨盆健康系统是一种非侵入性数字疗法,旨在康复和训练弱骨盆底肌肉。它允许患者通过专用的移动应用程序无线实时性能数据来监控他们在盆底肌肉训练期间的进展。
产品4:EARLIPOINT SYSTEM
制造商:EARLITEC DIAGNOSTICS, INC.
产品介绍:
EARLIPOINT SYSTEM是一种帮助临床医生诊断和评估儿童自闭症谱系障碍(ASD)的客观测量工具。 EarliPoint评估可以帮助早期识别ASD,并提供与社会残疾水平、语言和非语言能力相关的服务EarliPoint严重指数。
产品5:IFUSE BEDROCK GRANITE IMPLANT SYSTEM
制造商:SI-BONE, INC.
产品介绍:
IFUSE BEDROCK GRANITE IMPLANT SYSTEM旨在提供骶髂融合术和骶骨固定,作为节段性脊柱融合的基础要素。
产品6:QUELL-FM
制造商:NEUROMETRIX, INC.
产品介绍:
Quell-FM装置是一种经皮神经电刺激器,用于治疗纤维肌痛症状。Quell产品是一种完全自动化的可穿戴神经刺激技术,可与智能手机或Apple Watch无线协作。
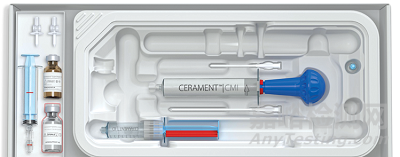
产品7:CERAMENT G
制造商:BONESUPPORT AB
产品介绍:
Cerament G是全身性抗生素治疗和清创手术的辅助手段,可作为骨髓炎手术治疗的一部分,旨在促进骨愈合并降低再感染和截肢的风险。
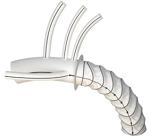
产品8:GORE TAG THORACIC BRANCH ENDOPROSTHESIS (TBE DEVICE)
制造商:W. L. GORE & ASSOCIATES, INC.
产品介绍:
GORE TAG胸支内假体旨在修复位于胸部最大动脉(降主动脉)的损伤。胸支内假体由三根镍钛诺骨架(支架移植物)支撑的植入式织物管组成。每个支架移植物都有一个基于导管的输送系统。
产品9:LUMIPULSE G ß-AMYLOID RATIO (1-42/1-40)
制造商:FUJIREBIO DIAGNOSTICS, INC.
产品介绍:
Lumipulse G β-淀粉样蛋白比值 (1-42/1-40) 测试适用于 55 岁及以上、患有认知障碍的成年患者。Lumipulse测试旨在测量人脑脊液(CSF)中发现的β-淀粉样蛋白1-42和β-淀粉样蛋白1-40(可以积聚并形成斑块的特定蛋白质)浓度的比例,这可以帮助医生确定患者是否有阿尔茨海默病的标志即淀粉样斑块。
产品10:ORGAN CARE SYSTEM (OCS) HEART SYSTEM
制造商:TRANSMEDICS, INC.
产品介绍:
TransMedics器官护理系统(OCS)心脏系统旨在移植前保存供体心脏。该系统包括一个便携式外壳,可以保温供体心脏,为其提供氧气和营养,以及提供心脏保存解决方案。
产品11:GYROSTIM
制造商:ULTRATHERA TECHNOLOGIES, INC.
产品介绍:
GyroStim是一款计算机控制的自动化多轴旋转椅,它能够通过预先编程的动作使患者在空中移动身体,从而对感觉运动系统造成刺激。GyroStim已被FDA批准为用于治疗平衡障碍和前庭功能障碍的突破性医疗设备。
产品12:THORAFLEX HYBRID
制造商:VASCUTEK, LTD.
产品介绍:
Thoraflex Hybrid是一种一次性医疗设备,结合了Gelweave聚酯移植物和镍钛自膨胀支架移植物,适用于主动脉弓和降主动脉受损或病变血管的开放式手术修复或置换。
产品13:AGILI-C
制造商:CARTIHEAL, LTD.
产品介绍:
Agili-C是一种植入物,旨在治疗膝关节骨骼周围软骨中发生的缺陷或病变。植入物是多孔的,生物相容的和可吸收的双相支架,由相互连接的天然无机碳酸钙组成。
怎么才能被纳入突破性项目计划?
申请上市前批准(PMA)、上市前通告 (510(k)) 或 De Novo指定的器械产品,需同时符合以下两个条件:一是该器械可治疗或诊断危害生命的疾病。二是该器械应满足以下至少一项:a.代表突破性技术b.无已批上市替代产品c.与现有或已批准的替代产品相比具有显著优势d.器械可及性符合患者最大利益。
图 符合突破性器械项目的条件
除此之外,FDA认为一些不符合“突破性设备计划“,但在治疗或诊断不太严重疾病方面具有显著安全优势的医疗器械也能够提供公共卫生利益。因此,FDA建立了医疗器械安全技术计划(Safer Technologies Program,STeP)以鼓励医疗器械厂商开发创新的、比现有产品更安全的替代品设备。根据FDA2022年年报指出,2022年收到了30多项纳入该计划的请求,并通过了14项目批准。
FDA网页原文及产品介绍原文:
[1] CDRH2022年年报
https://www.fda.gov/about-fda/cdrh-reports/cdrh-2022-annual-report
[2] 产品1 Phagenyx System详细介绍原文
https://www.fdanews.com/articles/209517-fda-authorizes-phagenesis-phagenyx-system
[3]产品2 Magnus Medical Receives FDA Clearance for the SAINT Neuromodulation System for Non-Invasive, Individualized and Precise Treatment of Severe Depression. 详细介绍原文
https://www.magnusmed.com/press-releases/magnus-medical-receives-fda-clearance-for-the-saint-neuromodulation-system/
[4] 产品3 Leva Pelvic Health system详细介绍原文
https://www.urologytimes.com/view/fda-grants-clearance-to-leva-pelvic-health-system-for-chronic-fecal-incontinence
[5] 产品4 EARLIPOINT SYSTEM 详细介绍原文
https://www.earlitecdx.com/solutions/
[6] 产品5 IFUSE BEDROCK GRANITE IMPLANT SYSTEM详细介绍原文
https://www.nsmedicaldevices.com/news/si-bone-secures-fda-approval-for-ifuse-bedrock-granite-implant-system/
[7] 产品6 QUELL-FM详细介绍原文
https://www.myhealthyapple.com/nuerometrix-clears-denovo-on-its-quell-fm-wearable-that-works-with-apple-watch/
[8] 产品7 CERAMENT G 详细介绍原文
https://www.ceramentgusa.com/#join
[9] 产品8 GORE TAG THORACIC BRANCH ENDOPROSTHESIS (TBE DEVICE) 详细介绍原文
https://www.fda.gov/medical-devices/recently-approved-devices/gore-tag-thoracic-branch-endoprosthesis-p210032
[10] 产品9 LUMIPULSE G ß-AMYLOID RATIO (1-42/1-40) 详细介绍原文
https://www.fda.gov/news-events/press-announcements/fda-permits-marketing-new-test-improve-diagnosis-alzheimers-disease
[11] 产品10 ORGAN CARE SYSTEM (OCS) HEART SYSTEM详细介绍原文
https://www.fda.gov/medical-devices/recently-approved-devices/organ-care-system-ocs-heart-system-p180051
[12] 产品11 GYROSTIM详细介绍原文
https://www.gyrostim.com/gyrostim-about
[13] 产品12 THORAFLEX HYBRID详细介绍原文
https://www.fda.gov/medical-devices/recently-approved-devices/agili-c-p210034
[14] 产品13 AGILI-C详细介绍原文
https://www.fda.gov/medical-devices/recently-approved-devices/agili-c-p210034
[15] 突破性器械项目的原则和优势,FDA原文
https://www.fda.gov/media/108135/download