糖化修饰(Glycation)是蛋白质在葡萄糖、果糖、半乳糖等还原性糖存在的情况下,还原性糖共价结合到蛋白质氨基酸残基上(主要为赖氨酸)的一种非酶促反应,这与通常提到的酶促反应形成的糖基化修饰(Glycosylation)有所不同。糖化修饰可以对蛋白的异质性、稳定性和功能活性等方面产生影响,而其晚期糖化终末产物(AdvancedGlycation End Product,AGE)[1-2]则与常见的糖尿病、骨关节炎、衰老、血管并发症等[1]密切相关。
对于单抗制品,由于葡萄糖在单抗发酵时被普遍使用,同时在一些单抗制剂配方中也会添加还原性的糖,或者配方中常见的蔗糖会水解成为还原性的糖,因此,糖化修饰也是单抗常见的一种翻译后修饰。单抗的糖化受多种因素影响,发酵时培养基的pH、葡萄糖浓度、培养基温度和时间等因素均会影响单抗糖化的程度和糖化速率[3-4],而单抗在存贮阶段的制剂配方组成、存贮温度和时间也会影响其糖化[5]。即使在通常认为比较稳定的冻干剂型中也会发生糖化。
单抗的糖化修饰会影响电荷异质性和聚集体的产生,某些关键位点如互补决定区(Complementarity Determining Region,CDR)上的糖化还可能会影响其生物学功能和活性[6-7],对单抗药物的批间一致性和用药安全性造成潜在的影响。因此,基于QbD理念,在单抗研发阶段对单抗糖化进行表征研究并对特定单抗分子在生产过程中进行有效控制是十分必要的,然而针对糖化的研究和评价通常被忽视。目前,国外研发机构对于单抗的糖化开展了相关研究,包括糖化在单抗生产储存阶段的形成和影响因素、单抗糖化的定量定性检测以及糖化对单抗功能活性和异质性的影响,而国内对单抗糖化的研究不足,本文通过对单抗糖化的形成、影响因素、糖化分析方法和糖化对单抗质量属性的影响进行综述,旨在提高研发机构对糖化修饰的重视,并在单抗研发和生产过程中进行评价和控制。
一、 单抗糖化的形成
1.1 糖化形成过程
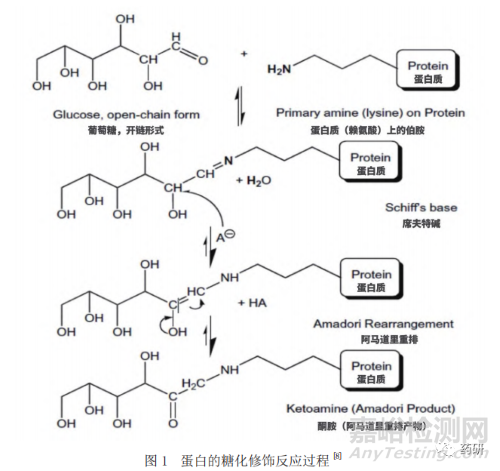
蛋白质的糖化通常主要发生在赖氨酸的α氨基和ε氨基末端上,当蛋白质与还原型的糖孵育时,通过非酶促反应,还原型的糖会共价结合至赖氨酸上,这一反应最初由Maillard于1912年提出,因此被称为Maillard反应(图1)。该反应首先由蛋白质赖氨酸上的氨基与还原性糖的醛基发生可逆的缩合反应,形成一种不稳定的席夫碱(SchiffBase)中间体,这一中间体可通过自发的Amadori重排生成更加稳定的共价结合的酮胺,从而完成了蛋白质的糖化过程[8]。与此同时,糖化修饰在特定的情况下是可逆的,研究发现将高度糖化的单抗在pH 7.0的磷酸盐缓冲液中37 ℃孵育100小时后,其糖化水平由42%下降至20%,表明了糖化的可逆性[9]。
对于单抗而言,其序列上存在多个赖氨酸位点,仅在重链恒定区上就存在约24~28个赖氨酸,kappa和lamda轻链恒定区上各存在8个赖氨酸,而在可变区也存在一定数量的赖氨酸。研究发现尽管赖氨酸位点较多,但通常单抗整体的糖化比例不高,而糖化修饰也主要发生在个别赖氨酸位点上,这些热点赖氨酸主要与其空间分布有关,通常分布在抗体分子表面的赖氨酸容易与还原性的糖结合。除此之外,糖化位点附近的氨基酸残基也会影响糖化的产生。研究表明,赖氨酸附近的羧酸可以通过促进Schiff Base转化为Amadori 产物,从而加速糖化[10],而临近的天冬氨酸也会促进糖化的发生[11]。
1.2 单抗糖化的产生及其影响因素
单抗制品生产工艺复杂,而葡萄糖在单抗发酵生产时的细胞培养基中被普遍使用,同时在一些单抗终产品的制剂配方中也会添加还原型的糖或者常见的蔗糖通过水解成为还原型的糖,因此糖化修饰在单抗中较为常见。单抗的糖化最早发生于细胞培养发酵时,研究表明培养基的葡萄糖浓度、pH、离子强度,以及培养温度和培养时间等因素均会影响单抗糖化的程度和糖化速率,其中葡萄糖浓度对糖化的产生影响最为直接。Boyan Zhang等人发现在发酵早期使用高浓度的糖,而在发酵后期降低糖浓度可有效降低产物的糖化水平[11]。CynthiaQuan等研究发现,通过调整培养基中半乳糖和葡萄糖的比例,可以改变单抗的糖化比例,且糖化比例随着培养基中半乳糖比例的增加而显著提高[8]。此外,细胞发酵时,细胞生长温度和pH也是影响糖化的两大重要因素。施贵宝公司的一项研究表明,细胞发酵时的温度、培养基的离子强度和培养基存放时间,以及抗氧化剂的浓度均会影响单抗的糖化修饰比例,从而使单抗酸性组分增加[12]。进一步研究表明,这些培养条件的改变会增加发酵上清中的过氧化氢的浓度和细胞内活性氧的活性,而糖化比例的升高也与发酵时的氧化压力密切相关。
在单抗生产完成后的存储阶段,如果制剂配方中存在还原性糖,同样会发生糖化反应。尽管还原性糖在单抗制剂配方中不常使用,但单抗制剂配方中常用的蔗糖在酸性条件和高温下也会降解为还原性的单糖,因此单抗存储阶段也会发生糖化。单抗在存贮阶段的制剂配方组成、缓冲盐种类,以及存贮温度、湿度和存储时间会影响其糖化程度[5]。Alex W研究发现,特定缓冲盐的类型可以明显地改变单抗的糖化速率。HEPES和柠檬酸盐中糖化速率相对较低,而磷酸盐中糖化速率明显升高,碳酸盐缓冲液最高[4]。即使在通常认为比较稳定的冻干剂型中也会发生糖化,另一项研究表明,较高的储存温度(如25 ℃)对冻干和液体制剂两种剂型均会导致更高水平的糖化修饰水平[10,13]。因此,对于功能活性易受糖化影响的单抗,也应对其制剂配方进行研究优化,以降低糖化的发生。
单抗在人体内同样会发生糖化。研究发现健康人体中内
源性IgG的糖化比例在14%~500%,即平均一个IgG分子上有0.14~5个糖化修饰,糖化的单抗药物在注射入人体后,还可以进一步氧化生成AGE形式[14],而研究发现一些AGE产物与人类慢性疾病的发生相关。在单抗临床给药时,如果需要提前与葡萄糖注射液混合,则应在混合后尽快完成注射,研究发现单抗糖化比例会随着混合后药物放置时间的增加而显著上升[15]。
二、 单抗糖化修饰分析方法
由于糖化对单抗的活性、异质性等方面可能产生潜在的影响,因此需要对其进行充分的表征和测定。目前,糖化分析方法主要有硼酸亲和色谱(BAC)、基于电荷差异分离的方法(如离子交换色谱、毛细管等电聚焦电泳等)、硝基四氮唑蓝还原试验(NBT Reduction Assay)和液质联用(LCMS)等[16]。
2.1 硼酸亲和色谱法(BAC)
BAC是一种用于分离糖上顺式二醇结构的方法,该方法因操作简便、无需样品前处理等特点,成为单抗糖化比例测定中最常用的定量分析方法,可应用于单抗的批放行检验中对糖化比例进行质控;同时,也可用于单抗中糖化组分的收集纯化,以评价糖化组分对单抗功能活性的影响。其原理是在碱性条件下色谱柱上的硼酸基团可以形成四面体结构的阴离子,该阴离子可以特异性地结合单抗糖化修饰中的顺式二醇[17],然后通过降低流动相的pH或者在流动相中加入山梨醇等羟基群来洗脱结合在色谱柱上的糖化单抗,从而分离单抗糖化和未糖化的组分并对糖化比例进行定量。对于该方法,由于抗体分子和色谱柱固定相会发生一定程度的非特异性结合,可以通过在流动相中加入Tris等试剂进行封闭,以消除非特异性结合。同时,目前对于单抗糖基化修饰中的糖链是否会影响糖化比例的定量存在一定的争议,在针对特定单抗分子进行方法开发时应对糖基化修饰的影响进行评价,并对流动相的盐组成、pH以及封闭试剂进行优化,使之能够对糖化比例进行准确定量。本实验室也通过方法学优化和验证建立了针对利妥昔单抗的BAC方法,并对利妥昔单抗原研药和生物类似药的糖化比例进行了分析,结果显示利妥昔单抗整体上糖化比例较低,且同一厂家糖化比例批间较为一致,但原研药和生物类似药之间存在一定的差异。由于不同单抗分子在氨基酸序列、高级结构、表面电荷分布等方面均存在差异,而这些差异也会影响基于BAC测定的糖化比例,因此不同的单抗不能用相同条件的BAC方法进行检测,应有针对性地开发分子特异的BAC方法,即对流动相中的盐组分和浓度,以及封闭试剂的浓度分别进行优化。
2.2 基于电荷差异进行分离的方法
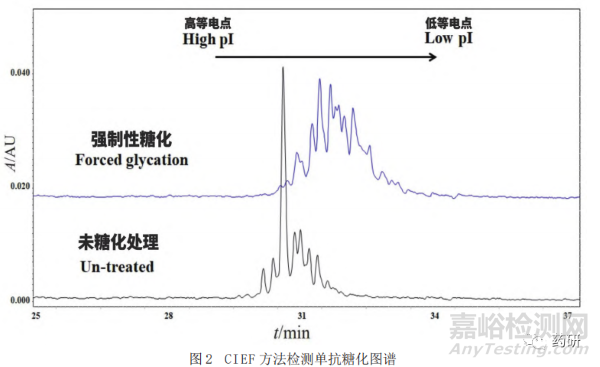
发生在赖氨酸等带正电氨基酸上的糖化修饰会使其正电荷丢失,从而使单抗的电荷分布整体上向酸区移动(图2),因而可以通过基于电荷分离的分析方法对糖化进行检测。然而由于单抗的电荷异质性较强,其他翻译后修饰也可以影响单抗电荷的改变,因此此类方法通常用于单抗糖化的定性分析,尤其是用于糖化比例存在差异的同一单抗样品间比对。常用的方法如毛细管等电聚焦电泳(Capillary Isoelectric Focusing, CIEF)[18-19]和离子交换色谱(Ion Exchange Chromatography,IEX)[20-21]都可以对糖化修饰进行检测。由于单抗电荷异质性较为复杂,氧化、脱酰胺、唾液酸修饰以及C末端赖氨酸等翻译后修饰和单抗的降解/聚集均会引起单抗电荷的改变,单抗整体的电荷分布是这些修饰叠加后的结果,因此基于电荷分离的分析方法(CIEF、IEC等)通常用来比较同一单抗完全糖化和未糖化、高度糖化和低糖化单抗的电荷差异,间接对糖化修饰进行确认,并不能对糖化比例进行定量(图2)。
2.3 基于质谱的分析方法
单抗分子上一个赖氨酸位点发生糖化修饰后其分子量会增加162 Da,因此可以通过液质联用等方法在完整蛋白或者亚基水平对单抗的糖化比例进行定量检测。同时结合酶切等手段,也可以在肽段水平对单抗的糖化位点、各位点的糖化比例进行分析。由于基于质谱的分析方法可以在肽段、亚单位和完整分子水平获得较为全面的糖化修饰数据,因此常用于单抗糖化的表征,该方法同样也可用于糖化比例放行检验中。需要注意的是,在完整蛋白或亚基水平进行糖化比例检测时,需要对单抗Fc上糖基化修饰引入的糖链进行切除,使质谱定量结果更为准确;而对于C末端的赖氨酸修饰同样会影响糖化比例检测结果的准确性,因增加1个赖氨酸会使单抗分子量变化128 Da,增加1个糖化修饰分子量增加162 Da,含有1个赖氨酸修饰(+128 Da)的单抗与1个糖化修饰(+162 Da)的单抗会产生34 Da的差异,二者的同位素峰有叠加,分离度不能满足准确定量分析的要求,例如含有1个C末端赖氨酸的未糖化组分(K1)与不含C末端赖氨酸但含有1个糖化修饰的单抗之间无法有效分离进而定量计算,尤其对于C末端赖氨酸比例较高而糖化比例较低的单抗影响更大。对于这种情况,可考虑用CpB酶对C末端赖氨酸进行切除后再进行质谱检测,但由于C末端赖氨酸同样也是潜在的糖化位点,CpB酶切处理后检测的糖化比例较实际比例偏低,因此,应结合BAC方法、亚单位/肽段水平的质谱检测等正交方法综合评价单抗的糖化修饰。
2.4 比色法
单抗糖化形成的酮胺结构可以通过硝基四氮唑蓝还原试验(NBT Reduction Assay)进行定量。NBT可以被糖化单抗中的酮胺还原,引起在525nm波长处吸光度的改变,进而对糖化比例进行定量。该方法最早由Johnson在1983年用于蛋白糖化比例的检测,随后在单抗的糖化比例检测中也有所应用[17]。
三、 糖化修饰对单抗质量属性的影响
3.1 糖化对单抗异质性的影响
糖化修饰会直接影响单抗的电荷分布,糖化会使修饰位点上的正电荷丢失,从而影响单抗的电荷异质性,使其整体上向酸性区域移动;除此之外,一些研究发现,糖化也会增加单抗聚集体的产生,进而影响单抗的批间一致性以及功能活性。安进公司在对IgG1和IgG2单抗进行加速稳定性研究时发现,两种单抗在含有蔗糖的制剂配方中聚集体产生的速率显著高于含有山梨醇的制剂配方单抗,进一步的研究提示,聚集体的产生主要由单抗上的糖化引起,而糖化促进单抗聚集体产生的机制,可能主要由于糖化的产生改变了抗体分子表面的电荷以及疏水性而引起[22]。由于在高温等加速条件下,制剂配方中非还原性的蔗糖会水解成为葡萄糖和果糖等还原性的单糖,从而增加糖化的产生,因此对于制剂配方中含有蔗糖等辅料的单抗,通过加速稳定性数据来预测其在2~8 ℃下的长期稳定性是不适用的。
糖化不仅会影响单抗的电荷和分子大小异质性,糖化修饰后期产生的AGE形式同样还会影响单抗制剂溶液的颜色。CHO细胞表达的单抗制品通常表现出轻微的黄棕色,普遍认为氧化会对单抗溶液的颜色产生影响。基因泰克公司对多个CHO细胞表达的IgG1单抗的颜色产生机制进行研究发现,单抗的颜色与其氧化程度和糖化水平呈弱相关,但与糖化后期AGE形式的比例高度相关,尤其与羟甲基赖氨酸(Carboxymethyllysine,CML)这种形式的AGE相关性最强(R2=0.99),CML本身不产生颜色,但其可以进一步修饰成为其他带颜色的AGE形式[23]。
3.2 糖化对生物学活性的影响
糖化对不同抗体分子活性的影响不尽相同,对某些抗体活性无影响,但对部分抗体可以使其活性完全消失,这主要取决于糖化位点的数量和空间分布。如果在抗体CDR区域上的糖化位点数量较多,其活性可能更容易受到影响。杨森公司研究糖化对一株IgG1单抗生物学活性的影响,通过分别收集糖化修饰和未糖化的抗体,评价了两种形式的抗体在抗原结合、补体依赖的细胞毒作用(CDC)/抗体依赖细胞介导的细胞毒作用(ADCC),以及Fc受体亲和力等方面的差异。研究结果显示,糖化形式的抗体与抗原的结合能力显著降低,而其他活性则不受影响。进一步研究发现,该抗体重链CDR区第100位的赖氨酸高度糖化,且该位点的糖化程度与抗原结合活性高度相关,表明该位点的糖化会直接影响单抗与抗原之间的结合,氢氘交换质谱的结果也表明该位点在与抗原结合时的重要性[6]。在3个鼠源单抗上也发现了类似的结果,糖化可以显著降低抗体与抗原的亲和力,显著增加抗原抗体之间的解离速率[24]。也有研究发现,糖化修饰并不会影响特定抗体的生物学活性。由此可见,糖化修饰对不同单抗活性的影响不同,主要取决于糖化修饰位点的位置,因此在研发阶段应充分评估糖化的影响。对于活性易受影响的抗体,应通过工艺优化、过程控制等手段保证糖化比例的批间一致性。
3.3 糖化对单抗免疫原性的影响
糖化对单抗免疫原性的潜在影响主要由糖化晚期终末端产物AGE引起。研究发现AGE形式单抗的免疫原性显著强于正常抗体,相比于正常抗体,可在动物体内产生针对AGE的高滴度特异性抗体[25],而在类风湿关节炎患者体内也能检测到针对AGE的高滴度IgM抗体[26-27]。尽管在优化的抗体生产工艺下,单抗发生AGE形式的糖化修饰比例较低,但糖化的单抗在进入体内循环过程中,在高血糖及氧化等环境下,仍能产生AGE形式的糖化修饰。另一方面,糖化引起的抗体聚集也会增加免疫原性。除此之外,AGE形式的蛋白还会在体内诱导AGE特异性细胞受体的表达,同时还会引发蛋白的交联和聚集,而这种非天然形式的蛋白也会对多种细胞产生毒性并引发疾病。
四、 单抗糖化修饰的控制策略
糖化修饰不仅会影响单抗的异质性,同时还可能会影响单抗的功能活性以及免疫原性,因此在分子开发时应对糖化进行充分的表征研究,对于易受影响的单抗分子,应在分子设计和生产工艺开发时尽可能减少其糖化修饰的影响,并在生产时对其糖化比例进行有效控制以保证批间一致性。目前控制单抗糖化修饰的策略主要集中在分子设计和生产工艺条件优化两方面。阿斯利康公司发现多个单抗的细胞发酵后的澄清收获液在放置一段时间后,其酸性电荷变异体比例显著增加,研究发现这主要由单抗的糖化所引起,电荷异质性的改变影响了单抗生产过程的稳定性,对该抗体生产工艺和批间一致性造成了挑战。通过将单抗上容易形成糖化修饰的赖氨酸突变为精氨酸后,电荷分布稳定,同时氨基酸突变也未影响该抗体的活性,这一突变策略可应用于降低/消除抗体糖化修饰的影响[28]。
重组单抗的糖化主要发生在细胞培养发酵过程中,培养基的组成、离子强度、葡萄糖的加入量、氧含量、培养温度和培养时间等因素均会影响单抗糖化。通过建立糖化动力学模型等方式,对发酵培养条件进行优化,在保证单抗质量和表达量的情况下,可以有效控制发酵培养阶段糖化的形成。另外,由于糖化修饰的单抗组分主要集中在电荷分布中的酸性区域,也可以在离子交换层析步骤中适当去除酸性组分,使糖化单抗的比例降低。对于在单抗存贮阶段形成的糖化修饰,应对制剂配方进行评估和优化,对于易受糖化影响的单抗,其制剂配方中应避免使用葡萄糖等还原性糖。
五、小结
质量研究和评价是保障药品安全有效的重要手段。单抗由于结构功能复杂且存在多种翻译后修饰类型,具有复杂的关键质量属性(CQA),根据先验知识、风险评估和实验分析,常见的翻译后修饰(如糖基化、末端赖氨酸截除等)对单抗影响比较明确[29-31],分析手段比较成熟,易于进行质量属性评估,并结合抗体自身特点,通过药效学等评价,确定其是否为CQA。明确药品的关键质量属性及其影响程度,一方面对产品质量有影响的产品特性得以研究和控制,另一方面,明确在工艺验证以及商业化生产中需要持续关注的项目,以保持工艺的稳定性。
糖化作为单抗常见的翻译后修饰,在单抗生产、储存、临床使用以及注射入人体后均会发生,同时糖化不仅会影响单抗的电荷异质性,也可能影响聚集体的产生,并对单抗的功能活性、免疫原性等产生影响,然而目前在单抗质量研究及可比性评价中通常缺乏对糖化的研究评价。由于糖化对单抗的影响取决于单抗序列、结构等因素,对不同单抗的影响存在差异,因此在单抗研发时应充分评估糖化的影响并确定是否为关键质量属性,对于生物类似药也应根据单抗分子特性按照ICH Q9风险评估原则开展相应的糖化可比性评价。根据风险评估和质控需求,可以选择对单抗的糖化比例(完整分子水平、亚单位水平或肽段水平)、糖化位点以及分布等进行质控评价,也可以在充分表征后在电荷水平上控制糖化的批间一致性。对于糖化是CQA的单抗品种,应结合分子设计、生产工艺优化、质控检测等手段对其进行有效的控制和监测,保证批间一致性。