口腔膜剂是将一定剂量的药物载入膜材后制成的可速溶于水的薄膜制剂,具有携带方便、释药迅速、给药方便、剂量准确、患者顺应性好等优势,尤其适用于吞咽不便的患者,可避免窒息的风险或减轻吞咽的痛苦。口腔膜剂作为口服递药系统,经过多年发展,在一些疾病领域,比如精神分裂症、阿尔茨海默病、抗菌消炎和过敏、高血压和抗血栓等领域有其独特的优势。
1、制备工艺
口腔速溶膜的制备方法有溶液浇铸法、热熔挤出法(HME)、半固体浇铸法、固体分散挤压法和碾压法等,其中最常用的方法是溶液浇铸法和热熔挤出法。除此以外,3D 打印、静电纺丝等新技术在过去几年中得到了较好的发展。
1.1、溶液浇铸法
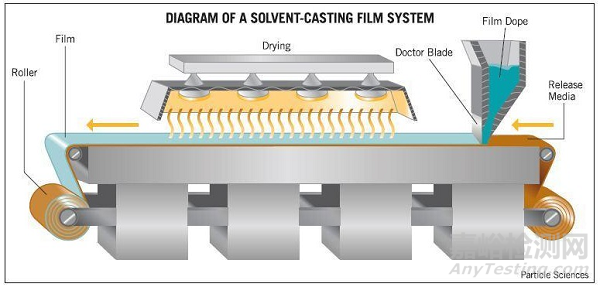
溶液浇铸法是将成膜聚合物、辅料完全溶解在适当的溶剂中,制成均匀黏稠液体,脱气泡,将形成的溶液倾倒于浇铸模上,干燥、切割、分包装的制备过程。通过溶液浇铸法制备的聚合物薄膜可能由于膜中残留溶剂随时间的损失而易变脆,且药物也比较容易变质,故而制备后需尽快地切割分装以保证药物和膜剂的质量。由于其简单方便,所得的膜剂厚度均一、物理性能好,依然是人们现在制备膜剂最受青睐的方法。溶剂浇铸法存在溶剂不能完全挥干、膜表面粗糙、膜剂厚度不一致及成品稳定性差等问题。
图源:Sapna, Kure & Renuka, Deshpande & Gholve, Sachin. (2017). Challenges Face by Pharmaceutical Industry for the Development of Oral Film Dosages Form. 10. 118-131.
1.2、热熔挤出法
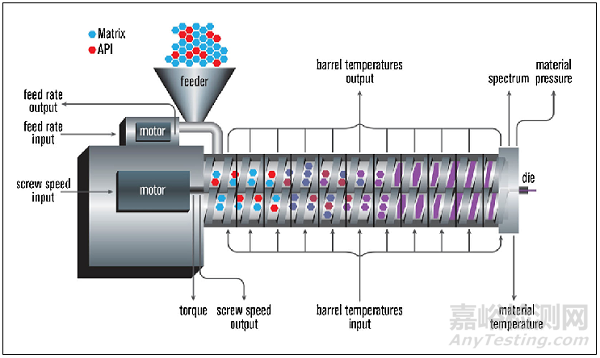
热熔挤出法在生产过程中不需要使用溶剂,通过熔化所有组分将聚合物、药物和其他赋形剂的混合物成形为膜。在该方法中,需通过高温使含药物的混合物熔化,所以该方法不适合于热不稳定的药物。热熔挤出以产生固体分散体或溶液形式制备膜剂,可以提高溶解性差的药物的溶解性。但是在升高的温度下,随着温度下降,在聚合物共混物中 API 重结晶的机会很高,可以通过使用高黏度的聚合物或增加增塑剂的量解决。与溶液浇铸相比,该方法无溶剂、不需要干燥过程,但是对所使用的 API 以及其他成分有耐高温的性质要求,热熔挤压法中的熔化过程可能会对原料药的稳定性、味觉、高聚物的稳定性等产生影响。
图源:Patil, H., Tiwari, R.V., & Repka, M.A. (2016). Hot-Melt Extrusion: from Theory to Application in Pharmaceutical Formulation. AAPS PharmSciTech, 17, 20-42.
1.3、静电纺丝技术
静电纺丝技术中药物通过溶解弥散于聚合物溶液,再以高压静电将聚合物溶液雾化拉伸得纳米纤维。此方法简单、快速,制备的纤维比表面积大,易于工业化。目前为止,对于溶解度较低的药物,如 BCS II 药物,除了喷雾干燥技术和热熔出,静电纺丝技术可极大地提高难溶药物的溶解度,将其应用于制备口腔膜剂制得的产品中,可以使难溶性药物以无定形形式存在,提高溶出速率,适用于需快速溶解的口腔膜剂。以静电纺丝技术制备固体分散体膜剂,制备时静电纺丝产品可以很好的保持药物的无定型状态,而不会像溶液浇铸法那样由于需要较长时间的干燥致使药物重结晶。同时,静电纺丝技术中高速纺丝技术制备的产品具有较好的稳定性,适合工艺放大和大生产。
1.4、3D 打印技术
3D 打印技术可分为喷墨打印和柔性打印。其制备方法结合了打印和溶液浇铸法的优点,将含药溶液或混悬液喷涂在溶液浇铸法制备的空白膜上,其优点为稳定性好、载药量准确、较灵活,有利于个性化给药等。与其他技术相比,喷墨打印不适用于高通量工业生产 ,而柔性打印也由于分辨率相对较低、污染机会较高、需要准备不同的印刷辊,不适用于大生产。
在口腔膜剂的生产中,应根据药物本身的性质选择适合的成膜材料,并对生产工艺进行筛选,以制备符合要求的口腔膜剂。
2、口腔速溶膜剂的评价
2.1、感官评价:
外观:参照《中国药典》中规定,膜剂外观上应完整光洁、无明显气泡、韧性良好。因此,外观是对膜剂考察指标之一。
口感评价:口腔是味觉感受器官,口腔膜剂的剂型特点便决定了其在制备过程中需要考虑药物的味道。
2.2、机械性能
平均厚度和平均重量:膜剂的厚度会影响膜剂的均匀性及薄膜的质量,因厚度偏小、偏大都会对膜剂的脱膜产生影响。薄膜厚度的均匀性至关重要,因为这直接关系到膜剂中剂量的准确性。其重量差异限度根据膜剂平均重量不同,规定在±7.5%、±10%、±15%三个限度内。
折叠耐力:在膜剂相同位置重复折叠和展开数次直到薄膜破裂,通过记录折叠和展开的次数来确定其折叠耐力。
拉伸性能:在制备口腔膜剂的时候需要进行拉伸性能的测试,一般情况下,随着增塑剂含量的增加,带材的伸长率也随之增加。
2.3、含量均匀度:
可参考《中国药典》2020版 第四部 通则0941 含量均匀度检查法,检查膜剂中含量均匀度是否符合标示量的程度。
2.4、物相分析:
对物质中各组成成分(如 API)的存在的状态、形态进行确定的分析方法。膜剂中药物结晶的形成会降低制剂中药物经黏膜透过量,影响药物溶出、降低吸收效率,物相分析通过差示扫描量热技术(DSC)、X 射线粉末衍射技术(PXRD)、扫描电镜等化学手段研究。在制备膜剂中应抑制药物的结晶,以无定型固态存在的药物生物利用度更高,吸收更好。
2.5、体外崩解时间:
崩解时间是速溶膜剂的重要特征,一般通常控制在 30~120s。
2.6、体外溶出:
根据中国药典测定口腔速溶膜的溶出时间方法。
此外,根据产品自身特性及应用,还可能会考察含水量、表面 pH 值、粘性试验、抗撕裂性、膨胀性能等。新阳唯康配备了海内外一流仪器设备,包括 X 射线粉末衍射仪、拉曼光谱仪、热重-差热测定仪、气体吸附检测仪、质构仪、流变仪、高效液相色谱、真空乳化罐、静电纺丝仪、涂布机和分切机等。
新阳唯康制剂团队拥有丰富的口膜制剂开发经验,在制剂设计过程中,我们将结合固态研究核心技术(多晶型、固体分散体、共晶、共无定型等),基于QbD理念进行制剂开发、商业化生产以保证质量,帮助您驾驭整个过程并降低风险,为您的药物开发计划提供进入市场所需的竞争优势。
3、质量评价具体案例分析
富马酸福莫特罗口腔速溶膜剂质量评价。对制备膜剂的厚度、含量均匀度、含水量、折叠耐力、表面 pH 值、体外崩解时间和体外溶出等指标进行评价。研究表明膜剂厚度为(65.37±0.61) μm,厚度相对标准偏差<5%;活性成分含量为 (44.33±2.01) μg,含量均匀度符合规定;含水量为(5.73±0.27)%;测得折叠耐力为 (236.70±7.09) 次,膜剂具有良好的柔韧性;表面 pH 值为 6.83±0.11;崩解总时长为(57.60±3.01) s。体外溶出试验表明在 3 min 左右药物的累积释放度达 99.24%,具有速释效果,表明口服富马酸福莫特罗口腔速溶膜剂可能具备快速缓解哮喘症状的潜力,针对膜剂的物相研究,膜剂表面无原料药颗粒,无微观损伤,富马酸福莫特罗在膜剂中以分子形式存在。
案例来自于参考文献:周烨,金怡兰,顾悦,宗亚玲,陈勇.富马酸福莫特罗口腔速溶膜剂的制备和评价[J].南通大学学报(医学版),2021,41(01):15-19.DOI:10.16424/j.cnki.cn32-1807/r.2021.01.004.
4、结语
国内外已将多种药物用于新型口腔速溶膜剂的研究。对于半衰期短、给药频次高、口服生物利用度差的药物,口腔膜剂是具有极大开发前景的剂型。聚合物材料是口膜制剂的关键组分,其性质直接影响到膜剂的载药率、脱膜性、崩解时间、机械强度等。如果您想了解更多膜剂配方设计可阅读《制剂开发与生产 | 口膜制剂的处方与工艺选择(一)》
参考文献
[1]周烨,金怡兰,顾悦,宗亚玲,陈勇.富马酸福莫特罗口腔速溶膜剂的制备和评价[J].南通大学学报(医学版),2021,41(01):15-19.DOI:10.16424/j.cnki.cn32-1807/r.2021.01.004.
[2]杨慧,何东升,李亚楠,涂家生.口腔膜剂制备工艺的研究进展[J].药学研究,2018,37(07):413-415.DOI:10.13506/j.cnki.jpr.2018.07.012.
[3] 何智斌.口腔速溶膜剂的研究进展[J].中国民康医学,2018,30(17):86-87.
[4] Fast Dissolving Films: An Innovative Drug Delivery System.Kaur Mandeep*,A.C. Rana, Seth Nimrata .Department of Pharmaceutics, Rayat Institute of Pharmacy, S.B.S.Nagar-144533(Punjab) India
[5] 魏婷,王丹丹,赵雅.口腔速溶膜剂改良药物剂型的研究方法[J].甘肃科技,2020,36(24):129-133.
[6] Sapna, Kure & Renuka, Deshpande & Gholve, Sachin. (2017). Challenges Face by Pharmaceutical Industry for the Development of Oral Film Dosages Form. 10. 118-131.
[7] Patil, H., Tiwari, R.V., & Repka, M.A. (2016). Hot-Melt Extrusion: from Theory to Application in Pharmaceutical Formulation. AAPS PharmSciTech, 17, 20-42.