前言:药物警戒风险管理中的风险分为已识别风险和潜在风险,本文从个人的理解角度对药物警戒风险管理过程中的风险识别、风险评估、风险沟通的方法,粗略表达一些自己的见解。
一、目的
制定药物警戒风险管理规程,通过对药品的风险进行有效管理,对药品风险进行识别与分析,最大限度地降低药品安全风险,保护和促进公众健康。
二、依据
《药品管理法》(2019年)
《药物警戒质量管理规范》(2021年第65号公告)
三、适用范围
适用于药物警戒系统中的药品风险管理。
四、职责
1、 药物警戒部负责本规程的建立。
2、 药物警戒部及各相关部门负责本规程的实施。
五、内容
1、定义
1.1 风险:危害发生的可能性及其严重程度。
1.2 风险分析:和被确定的危害源有关的风险的分析。
1.3风险评价:用定性或定量的方法,将被评估的风险与既定的风险标准进行比较,以确定风险的显著性。
1.4 风险控制:实施风险管理决策的行为。
1.5风险降低:采取措施减少危害发生的可能性和严重程度。
2、风险管理的目的
按照一个完整有效的风险管理流程,使风险发生的可能性和危害降低到可接受的程度或者提高风险发生的可预测性。
3、风险管理采取PDCA原则:PDCA原则(P计划、D实施、C检查、A总结)。
4、风险管理流程
风险管理流程分为五个部分:风险评估、风险控制、风险沟通、风险评审和风险回顾。
4.1 确定事件并启动风险管理流程:由药物警戒负责人及药物警戒专员与风险相关的部门,收集与所评估的风险相关的可能性危险、危害或对人体健康影响的有关背景资料和数据。
4.2 风险评估:包括风险识别、风险分析和风险评估。
4.2.1 风险识别:成立风险管理小组,对收集到的不良反应信息(报告)进行分析、识别。判断其是否有效,有效的报告应包括以下四个元素(简称四要素):可识别的患者、可识别的报告者、怀疑药品、不良反应。如果四要素不全,视为无效报告。
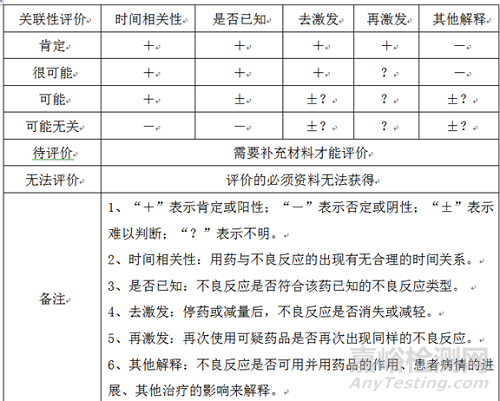
4.2.2 风险分析:对已确认有效的不良反应信息(报告)的风险,从预期(非预期)、严重(非严重)、药品与不良反应的关联性(因果关系)三方面进行分析。
(1)预期(非预期)
预期:说明书不良反应一项中对此种药品不良反应已经有记载
非预期:说明书不良反应一项中对此种药品不良反应没有记载;药品不良反应的性质/严重程度/特性结果与说明书中所描述的不同
(2)严重(非严重)
一般:没有给患者造成严重的损害,不良事件很快得到改善,也未造成其他医学事件。
严重:导致死亡、危及生命;先天性异常或出生缺陷;导致显著的或者永久的残疾或者器官功能的丧失;导致住院或者住院时间延长;导致其他重要医学事件,如不进行治疗可能出现上述所列情况。
(3)关联性
关联性分为肯定、很可能、可能、可能无关、待评价、无法评价,分析方法如下图:
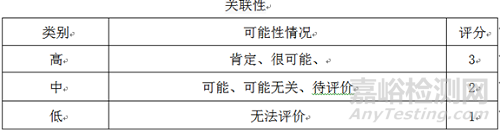
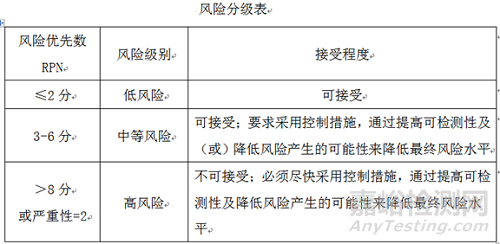
4.2.3 风险评估:根据预先确定的风险标准对已经确认并分析的风险进行评价,确认风险发生的关联性,风险发生的严重性,风险发生的预期性,三项的乘积为风险等级评估的依据,对风险进行排序,确定风险等级。
4.2.4 风险优先数(RPN)
风险优先数(RPN)=严重性(S)×关联性(O)×预期性(D)
4.3 风险控制
对于已识别的安全风险,药品上市持有人应当综合考虑药品风险特征、药品的可替代性、社会经济因素等,采取适宜的风险控制措施。
风险控制措施分为常规风险控制措施、特殊风险控制措施、紧急控制措施:
常规风险控制措施:修订药品说明书、标签、包装,改变药品包装规格,改变药品管理状态;
特殊风险控制措施:开展医务人员和患者的沟通和教育、药品使用环节的限制、患者登记;
紧急控制措施:暂停药品生产、销售及召回产品。
4.4 风险沟通
4.4.1 持有人应当向医务人员、患者、公众传递药品安全性信息,沟通药品风险。
4.4.2 持有人应当根据不同的沟通目的,采用不同的风险沟通方式和渠道,制定有针对性的沟通内容,确保沟通及时、准确、有效。
4.4.3 沟通方式包括发送致医务人员的函、患者安全用药提示以及发布公告、召开发布会等。
(1)致医务人员的函可通过正式信函发送至医务人员,或可通过相关医疗机构、药品生产企业、药品经营企业或行业协会发送,必要时可同时通过医药学专业期刊或报纸、具有互联网医药服务资质的网站等专业媒体发布。
(2)患者安全用药提示可随药品发送至患者,或通过大众媒体进行发布,其内容应当简洁、清晰、通俗易懂。
4.4.4 沟通工作应当符合相关法律法规要求,不得包含任何广告或产品推广性质的内容。一般情况下,沟通内容应当基于当前获批的信息。
4.4.5 出现下列情况的,应当紧急开展沟通工作
(1)药品存在需要紧急告知医务人员和患者的安全风险,但正在流通的产品不能及时更新说明书的;
(2)存在无法通过修订说明书纠正的不合理用药行为,且可能导致严重后果的;
其他可能对患者或公众健康造成重大影响的情况。
4.5 风险评审
4.5.1药物警戒专员对评估结果与纠正措施进行审核,确认风险分析与评估正确,采取措施与风险水平相适应,实施风险降低措施过程中,是否有可能将新的风险引入系统,或增加了其他风险发生的可能。
4.5.2 药物警戒专员对评估结果与纠正措施审核后须有药物警戒负责人批准。否则,应重新进行风险分析评估,并采取控制措施。
4.6 风险回顾
风险管理是持续性的质量管理过程,需要对风险进行回顾。措施实施后,通过一段时间的运行,需重新进行风险评估,以确认和评价风险是否发生新变化,行动计划是否有效,风险是否已被正确管理。