近期,复旦大学附属中山医院董健教授、周晓岗副教授和江立波副研究员在科爱出版创办的期刊Bioactive Materials上发表论著文章:压阻式MXene/丝蛋白复合水凝胶通过重建电微环境加速骨再生。研究者设计了一种负载MXene纳米片的丝蛋白(RSF)复合水凝胶。证明ES可通过激活Ca2+/CALM信号通路并诱导M2型巨噬细胞的极化促进骨再生与血管重建。
研究内容简介
电活动是人体主要的生理活动之一,电微环境被认为与组织再生、肌肉收缩以及胚胎生成等多项生理活动密切相关。外源性电刺激(ES)可影响骨电微环境,因此被认为可调节成骨相关细胞的功能。既往研究已成功将ES用于难治性骨折以及骨不连等骨组织再生工程的辅助组织治疗中。然而,受限于骨微环境的复杂性,ES促进骨再生的机制尚不明确。水凝胶是兼具各项生物特性的柔性支架,丝蛋白水凝胶除了具有以上特性之外,还具有机械强度高、天然抗菌和促进成骨的优点。MXene是一种新颖的二维(2D)过渡金属配合物纳米材料,其具有良好的压电效应、亲水性和丰富的化学性质。相较于碳纳米管、PVDF等其他导电纳米材料具有更容易被分散到聚合物网络中和在体内环境下不易因降解和受潮导致电导率下降的优点。基于以上观点,研究者设计了由辣根过氧化物酶(HRP)/过氧化氢(H2O2)催化交联的RSF水凝胶生物封装MXene纳米片,合成一种具有压电效应的生物电活性复合水凝胶MXene/RSF。在体外评估其细胞相容性、电导率、成骨诱导特性、骨免疫调节能力、血管生成能力并探索ES刺激成骨分化的机制。在动物体内评估其促进骨再生能力、血管重建能力与骨免疫调节能力,证明该导电水凝胶在临床成骨修复中的应用潜力。
图1:多功能电活性复合水凝胶的制备与应用于骨缺损多样化治疗的示意图。(I)合成MXene/RSF的工艺流程。(II)MXene/RSF重建骨电微环境加速骨再生的概念图与机制。
1. MXene/RSF的合成与表征结果
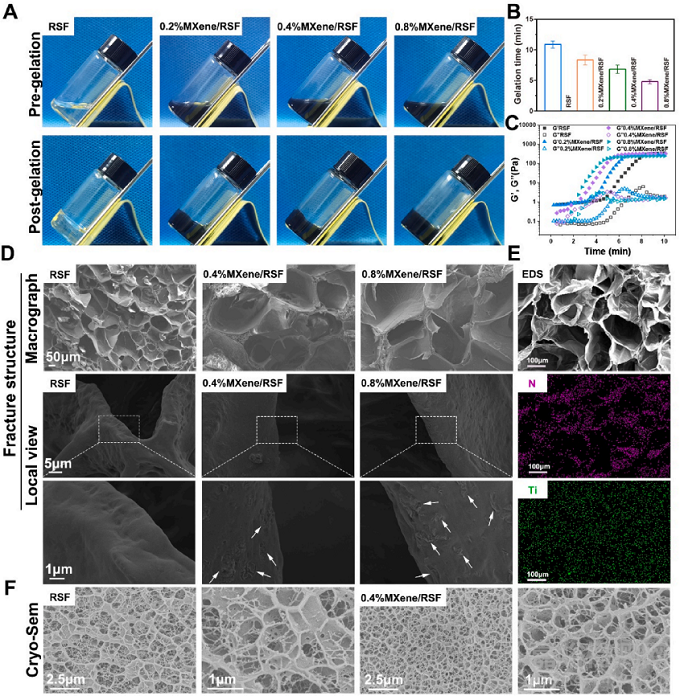
研究者合成具有高机械强度的双交联复合水凝胶MXene/RSF,MXene表面富含羟基,与RSF之间可形成广泛的氢键。在图2C中可以看到随着MXene浓度升高,样品的存储模量G’和损耗模量G’’迅速提升并达到平台期,溶液更早地发生溶胶-凝胶转换。SEM表征结果显示随着MXene的加入,水凝胶表面的孔洞分布更加密集且排列更加规律,见图2D。以上结构有利于细胞在水凝胶表面的黏附与迁移。对MXene/RSF水凝胶的冷冻SEM表征与前文结果一致。(见图2E)
图2:MXene/RSF的成胶过程与形态学表征结果。(A)MXene/RSF溶液和MXene/RSF水凝胶的数码照片。(B)随MXene浓度变化不同水凝胶组别的成胶时间。(C)不同水凝胶组别成胶过程中的流体力学变化结果。(D)不同水凝胶组别的断面SEM图像。(E)MXene/RSF水凝胶的SEM-EDS结果。(F)RSF和0.4&MXene/RSF水凝胶的冷冻SEM结果。
对MXene/RSF水凝胶的FTIR表征结果如图3A所示。1640cm-1处的特征峰对应了其内部所含的β折叠结构,且随着MXene浓度提升,峰值不断增加,与前文实验结果相符。图3C,D,E,F展示MXene/RSF的机械强度随MXene浓度变化的结果。随着MXene浓度升高,水凝胶的弹性下降。
水凝胶的导电性是刺激成骨相关细胞活性的关键,因此研究者表征了MXene/RSF的导电性。图3G,H展示随着MXene浓度提升,水凝胶的电导率提升至4×10-4S/cm点亮LED二极管。图3I,J显示水凝胶内部MXene均匀分布,使其拥有良好的导电性且具有实时电阻响应性。最后,研究者探索了MXene/RSF应用于穿戴式动态传感器的潜力。图3K,L,M展示MXene/RSF贴附到人体皮肤表面后,检测到的包括手指弯曲、握拳和按压在内的细微动作。
图3:MXene/RSF水凝胶的化学结构和多功能特性。(A)MXene/RSF其结构、组份的FTIR结果。(B)不同对照组的XRD结果。(C,D)不同对照组的拉伸应力-应变曲线和弹性模量。(E,F)不同对照组的压缩应力-应变曲线和压缩模量。(G)RSF和MXene/RSF水凝胶通电点亮LED二极管的数码图像。(H)不同浓度MXene的水凝胶电导率。(I,J) MXene/RSF的分离-接触电导实验过程中的电阻变化。(K,L,M) MXene/RSF水凝胶用于动态传感器的验证实验结果。
2. MXene/RSF的体外生物特性
2.1 MXene/RSF水凝胶联合ES促进BMSCs向成骨细胞分化与诱导巨噬细胞极化
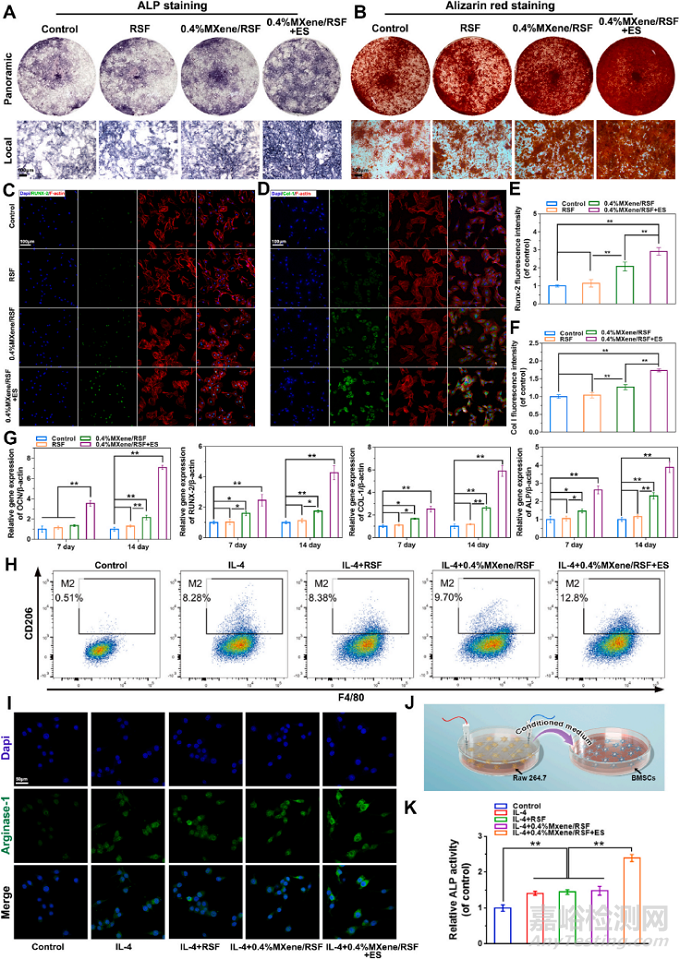
图4A,B分别说明0.4%MXene/RSF和ES均可通过上调BMSCs内碱性磷酸(ALP)的表达和胞内外钙颗粒的沉积促进BMSCs各阶段向成骨相关细胞分化。图4C,D,E,F说明ES和0.4%MXene/RSF可通过上调BMSCs内RUNX-2和Col-1的蛋白表达以促进其向成骨相关细胞分化,PCR结果与之相互印证。(见图4G)
巨噬细胞不同表型的极化调控了骨免疫微环境,并最终调节骨组织再生与重塑。其中M1型巨噬细胞促进局部炎症,而M2型巨噬细胞则促进局部伤口愈合。M2型巨噬细胞极化的标志物为Arginase-1和CD206。作者利用流式细胞检测发现0.4%MXene/RSF+ES组中巨噬细胞内M2表型占比显著提升,而单纯MXene组的M2表型巨噬细胞占比未出现显著改变,说明主要是ES促进了巨噬细胞向M2表型极化,见图4H。图4I中对Arginase-1的免疫荧光染色结果也印证了这一点。另外,研究者还设计了M2型巨噬细胞与BMSCs共培养的实验,用于评估M2巨噬细胞对BMSCs的作用。如图4J,K所示,M2型巨噬细胞显著促进了BMSCs中的ALP表达。
图4:各对照组水凝胶对BMSCs向成骨细胞分化的作用以及ES对RAW264.7巨噬细胞极化的免疫调节作用。(A,B)第7天的ALP染色和第21天的ARS染色结果。(C,D,E,F)第7天BMSCs内RUNX-2和Col-1的蛋白免疫荧光染色和定量分析结果。(G)OCN,RUNX-2,Col-1和ALP的PCR结果。(H)各对照组巨噬细胞的CD206+F4/80流式细胞计数结果。(I)巨噬细胞内Arginase-1的免疫荧光染色结果。(J)M2型巨噬细胞和BMSCs共培养的示意图。(K)使用RAW264.7细胞的条件培养基孵育BMSCs7天后的ALP染色结果。
3. MXene/RSF联合ES用于体内骨修复
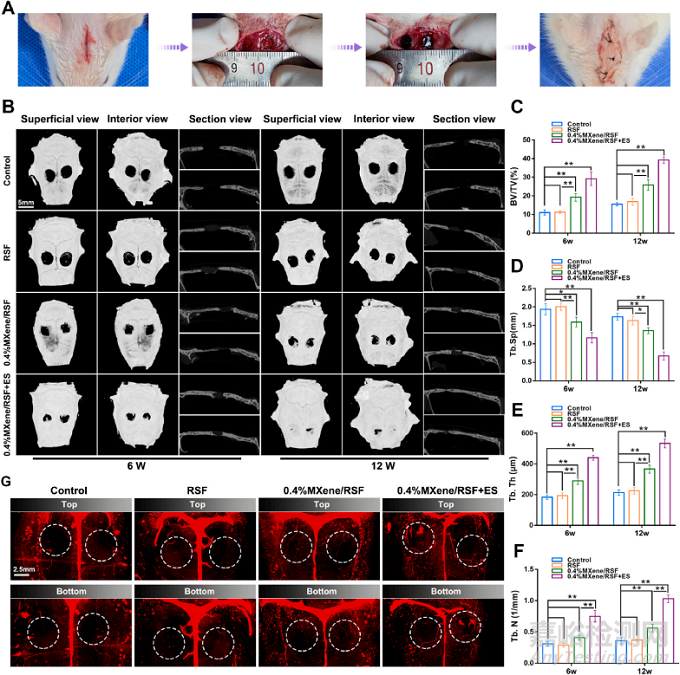
研究者构建了SD大鼠的颅骨骨缺损模型以评估电活性复合水凝胶MXene/RSF促进体内骨再生和血管重建的作用,见图5A。图5B,C,D,E,F显示0.4%MXene/RSF+ES组在实验期间骨缺损边缘新生骨的形成最为显著,松质骨修复指标亦与之相符。同时,其血管重建情况最为理想,见图5G。
图5:MXene/RSF水凝胶联合ES加速骨再生与血管重建的影像学结果。(A)SD大鼠颅骨骨缺损模型的建立过程与结果。(B)术后第6周与第12周各对照组颅骨缺损的Micro-CT图像结果。(C,D,E,F)基于Micro-CT的各对照组松质骨骨小梁分析结果。(D)术后第12周各对照组血管的三维重建结果图像。
综上,作者设计了一种基于丝蛋白负载MXene纳米颗粒的的生物电活性复合水凝胶,其可以通过联合外部电刺激激活Ca2+/CALM信号通路促进BMSCs分化并诱导巨噬细胞向M2型极化调节局部免疫微环境,从而有利于骨再生。该材料为难治性骨缺损提供了一种潜在的临床治疗策略。