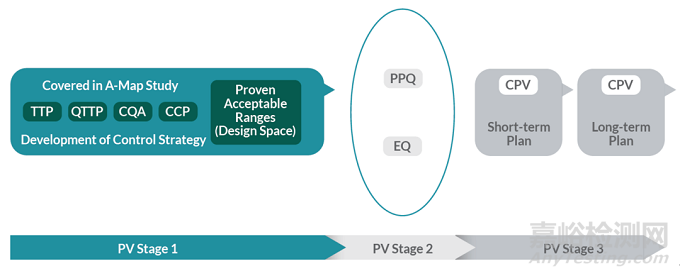
FDA在2011年颁布“工艺验证的一般原则与实践”,将工艺验证划分为三个阶段。
阶段1为“工艺设计”,基于从开发和工艺放大过程中得到的经验来定义商业化生产工艺。
阶段2为“工艺确认”,对已设计的工艺进行评估,证明该工艺能够进行重复性的商业化生产。[1]
这两个阶段的完成,也就意味着工艺验证进入了阶段3“持续工艺确认”,在这一阶段,将在日常的商业化生产中持续确认工艺的受控状态。至今为止,持续工艺确认已经在行业内达成基本共识,也在逐渐的受到重视。
由此可见,持续工艺确认很重要的一个目的是确保正常生产过程中的生产工艺能够持续的维持在已验证的受控状态。持续工艺确认的结果可以显示工艺和产品的趋势,同时发现工艺监控中不可预期的事件和趋势,提示工艺控制问题或者工艺改进的机会。持续工艺确认的数据还可以支持年度产品回顾分析。
二、持续工艺确认的计划
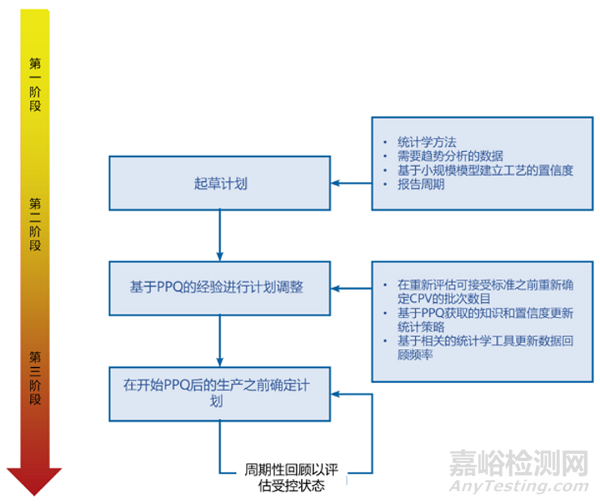
持续工艺确认的开始是制定一个持续工艺确认计划,而持续工艺确认计划的设计可能要更早,可能开始于工艺验证的阶段1,即开始建立商业化工艺的控制策略时。阶段2通过工艺性能确认(PPQ)会调整和确认控制策略,因此也需要通过调整持续工艺确认计划。最终的持续工艺确认计划则会在PPQ之后,在正式的商业化生产之前确定。
图2. 持续工艺确认计划的制定。[3]
一个完整的持续工艺确认计划可包含以下要素:
1. 不同职能部门的角色和职责
比如将由哪个部门来制定方案或计划,哪个部门来收集数据,哪个部门来进行数据的分析和生成报告,以及哪个部门来负责产生的行动的追踪等。
2. 取样和检测策略
持续工艺确认中应至少包含对原材料、中间体、原液和制剂的取样,检测的项目应至少包含中间体和成品的关键质量属性(CQAs),以及关键工艺参数(CPPs)和关键物料属性(CMAs)。
除此之外,也可以考虑非常规取样,一个增强的取样计划可以保证收集到足够的数据。不过,当数据分析进行到一定的程度时,比如已有足够的数据证明工艺的受控性,则可以终止取样。取样批次和取样频率可以在制定工艺控制策略时来设定,并在持续工艺确认计划明确说明。
3. 数据分析和趋势分析
不同的数据类型应制定不同的分析方法。比如定性的结果则不需要统计分析。定量的结果,比如纯度数据、活性数据等,则可以采用统计方法进行分析。应在持续工艺确认计划中指定统计学分析的方法和规则。
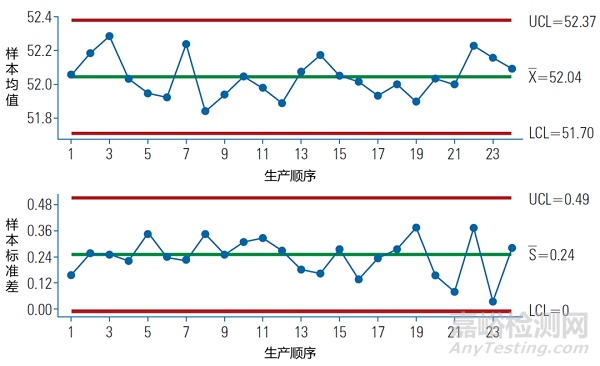
统计过程控制图和工艺能力指数分析是常用的统计分析方法。对于统计过程控制图应进一步明确判异规则。
图3. 统计过程控制图(均值-标准差图)示意。[4]
4. OOT和OOS的处理策略
应在持续工艺确认计划中制定一个超出控制范围的结果,比如超标准(OOS)或超趋势(OOT),将触发质量系统的何种行动,比如调查、对验证状态的影响分析等。采取的行动会因具体的情况而有所不同,但是应在持续工艺确认计划中进行说明。
5. 判断返回阶段1或阶段2的机制
需要制定依据来决定哪种工艺变更/工艺趋势需要返回到工艺验证的阶段1(工艺设计)或阶段2(工艺确认)。
如果通过微小变更即可降低工艺变异,则可以实施该变更,收集数据,证明变更的有效性。如果需要通过重大变更调整才能保证工艺受控,则实施该变更,重新进行阶段2工艺确认,改进后再进行持续工艺确认。如果重大变更也不能保证工艺受控,则需要重新进行阶段1工艺设计,再进行阶段2工艺确认,改进后再进行持续工艺确认。
三、持续工艺确认的阶段
可以通过风险评估来建立持续工艺确认的阶段策略。如果需要可以将持续工艺确认分为两个阶段:初始阶段 和长期阶段。
初始阶段被认为是 SPC 之前的阶段,它提供了基于有限数据集分析过程性能的能力,以了解商业设施中的正常过程可变性。此阶段应包括足够的批次以提供数据以反映潜在可变性的范围并允许建立统计过程范围。初始阶段将持续到至少生产 30 批次。在初始阶段结束时,应在适用的情况下为监测参数建立警报限值或证明已设置的警报限值是合理的。
长期 CPV 阶段是统计过程控制阶段,该阶段有以下目标:
1、在产品生命周期内对过程进行持续验证,以证明过程仍处于受控状态;
2、识别可能在正常过程可变性范围内但表明趋势可能超出警报限制的趋势;
3、继续加深对过程可变性来源及其影响的理解;
四、持续工艺确认的案例
BPOG在2020年发表了一个基于A-Mab工艺的持续工艺确认案例,原文为“Continued process verification an industry position paper with example plan”。本案例延续了“A-Mab case Study”的故事,假设A-Mab经过工艺设计和工艺确认,进入了工艺验证的阶段3,即持续工艺确认阶段。
A-Mab案例的开发基于质量源于设计的理念。工艺开发和工艺表征中确定了该产品的关键质量属性(CQAs)和关键工艺参数(CPPs),并且建立了良好的控制策略(CS)。BOPG的案例展示则是在该基础上展示一个持续工艺确认计划是如何设计和执行的。
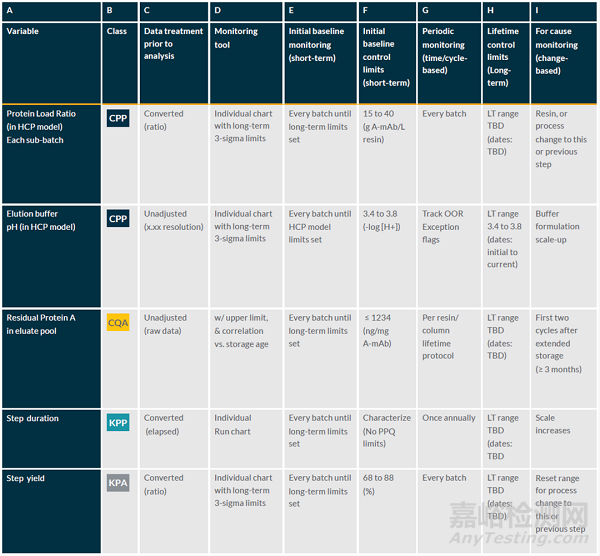
本案例包含了一个典型单抗药物(A-Mab)的全部工艺流程(从上游到下游的所有单元操作),限于本文的章节,我们只展示一个特定的工艺步骤,即蛋白A亲和层析步骤。
蛋白A亲和层析步骤的监控项目
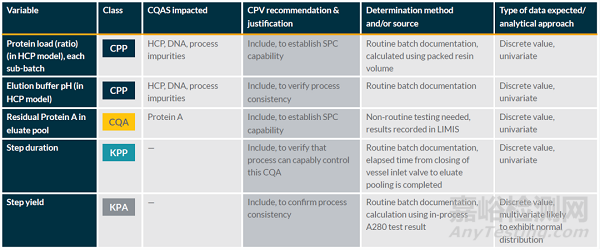
基于A-Mab的工艺设计和工艺确认,确认在蛋白A亲和层析步骤中,残留的蛋白A水平为关键质量属性(CQA),上样载量和洗脱缓冲液的pH为关键工艺参数(CPP)。这些需要包含在持续工艺确认计划中。
同时,持续工艺确认计划还包含了步骤收率(重要工艺性能属性)以显示工艺的一致性,以及工艺步骤时间(重要工艺参数)来监控此步骤的处理时间,间接反映该步骤的处理能力。
这些项目的监控和分析频率以及产生的数据类型也相应的列在下表中。
表1. 蛋白A亲和层析步骤的持续工艺确认的监控项目
蛋白A亲和层析步骤持续工艺确认执行
针对上述监控项目,制定所需检测的数据、数据处理和分析工具、初始控制限和长期控制限的设定,以及可能涉及到的变更的风险。
表2. 蛋白A亲和层析步骤的持续工艺确认执行
总结
持续工艺确认的核心价值是通过数据发现工艺改进的机会,并通过工艺变更控制策略来实施,让工艺一直处于受控状态。现在为止持续工艺确认已是法规的明确要求,已经成为行业共识。从现实角度来讲,工艺设计和工艺确认中的极少量的批次是难以确保工艺的稳健性,因此持续工艺确认是有其现实价值的。
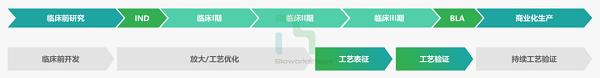
工艺表征和工艺验证是新药上市前研发的重要一环,也是产品通过注册获得上市许可的前提条件。工艺表征研究通常在临床II期后开展,在临床III期时结束;工艺验证一般在临床III期时开展,商业化生产前结束。康日百奥作为一家专业的生物药CDMO服务供应商,拥有强大的工艺开发、生产以及验证团队,在工艺表征和工艺验证的项目上都拥有强大的知识积累及充足的实战经验,保证客户项目的顺利交付。
团队成员已经帮助多家国内外知名公司成功转移、放大和生产2000 L的临床和商业化产品,同时具有丰富的药品申报上市经验,其中包含多批具有较高技术难度的从3 L直接放大至2000 L的生产项目,成功率100%。
参考文献
1 FDA Guidance for Industry, Process Validation: General Principles and Practices” 2011.
2 BPOG Continued process verification an industry position paper with example plan 2020
3 PDA Technical Report NO 60:Process Validation: A Lifecycle Approach, 2013
4 PDA Technical Report NO 60-3: Process Validation: A Lifecycle Approach Annex 2: Biopharmaceutical Drug Substances Manufacturing 2021