目的:针对国际医疗器械监管机构论坛(IMDRF)更新的《用于分类不良事件报告的术语》5.0版本,本文旨在分析原因调查术语集(附件B、C、D)应用于有源医疗器械不良事件报告调查和分析评价的可行性和必要性。
方法:结合原因调查术语集梳理有源医疗器械不良事件调查类型,对447 份造成严重伤害的有源医疗器械不良事件报告调查结果进行统计,并归纳有源医疗器械不良事件发生原因的调查结论。结果:对于有源医疗器械,不良事件调查类型以产品检测、相关人员访谈和生产记录分析为主,病人监护仪、电子针疗仪、中药熏蒸机相关严重不良事件数量最多,力学(磨损)问题、电子元件问题、退化问题是大多数不良事件的主要调查结果,追溯到的主要原因涉及常见组件故障、用户问题、维护不当等。
结论:IMDRF 原因调查术语集对我国有源医疗器械不良事件监测工作具有一定的借鉴意义,可为各相关单位开展有源医疗器械不良事件报告调查评价和监督检查提供技术参考。
Objective: International Medical Device Regulators Forum (IMDRF) has updated version 5.0 of Terminologies for categorized Adverse Event Reporting (AER): terms, terminology and codes. The purpose of this study is to analyze the feasibility and necessity of the cause investigation terms (Annex B, C, D) applied to the investigation, analysis and evaluation of adverse events of active medical devices. Methods: Using the terms to sort out the investigation type of adverse events of medical devices, the investigation results of 447 reports of adverse events of medical devices causing serious damage were statistically analyzed, and the investigation conclusions of the events were summarized. Results: The investigation types mainly include product testing, interview and production record analysis. The top three active medical devices with serious adverse events were patient monitor, electronic needle therapy instrument and traditional Chinese medicine fumigation machine. The main investigation results of adverse events were mechanical problems dominated by wear, electronic component problems and degradation problems. The main causes traced to common component failures, incorrect maintenance and user problems.Conclusion: IMDRF cause investigation terms has certain reference significance for the monitoring of adverse events of active medical devices in China, and provides technical reference for the relevant units to carry out the investigation, evaluation, supervision and inspection of adverse events reports of active medical devices.
一、研究背景
国家药品不良反应监测中心发布的《国家医疗器械不良事件监测年度报告(2020 年)》显示,2020 年我国共收到536 055 份医疗器械不良事件报告,其中有118 730 份涉及有源医疗器械。2019 年1 月,国家药品不良反应监测中心在国家医疗器械不良事件监测信息系统中内嵌了《医疗器械伤害(表现)术语集》,包含不良事件故障表现和伤害表现术语共1562 个。随着医疗器械不良事件监测相关培训的大力推广,部分医疗机构和医疗器械上市许可持有人(以下简称持有人)已经开始尝试使用《医疗器械伤害(表现)术语集》对不良事件表现进行规范。但需要注意的是,在我国医疗器械不良事件监测机构、持有人和使用单位公开发表的学术论文中,针对不良事件原因调查术语集使用情况的研究仍较少。
2021 年3 月2 日,国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF) 更新了《用于分类不良事件报告的术语》[Terminologies for Categorized Adverse Event Reporting (AER):terms, terminology and codes]5.0 版本,对医疗器械的组件名称、故障术语、事件原因和健康影响使用定义的术语以及相关代码进行区别分类,有效提高了收集、上报医疗器械相关不良事件的准确性,以及评估过程的有效性。其中,与事件原因相关的术语集有调查类型术语集(附件B)、调查结果术语集(附件C)和调查结论术语集(附件D)。鉴于有源医疗器械的安全性评价工作日益受到关注,本文利用IMDRF 原因调查术语集对收集到的有源医疗器械不良事件报告进行回顾性分析,旨在研究该术语集被应用于有源医疗器械不良事件报告评价和产品风险监测的可行性和必要性。
二、材料与方法
2.1 数据来源
本文通过统计2019 年以来江苏省药品不良反应监测中心在国家医疗器械不良事件监测信息系统收集的报告发现,产品类型为“有源”且经持有人评价为“严重伤害”的报告共有1543 份;按产品名称排序,严重不良事件数量排名前10 位的有源医疗器械的报告共有447 份。
2.2 研究方法
结合调查类型术语集,梳理有源医疗器械不良事件的调查方法;运用调查结果术语集, 对447 份有源医疗器械不良事件报告调查结果进行统计;按调查结论术语集,归纳有源医疗器械不良事件根本原因。
2.2.1 调查类型术语集归纳与简化
调查类型术语集罗列了如何开展调查的所有情形,分为检测手段和非检测手段。本文针对有源医疗器械不良事件调查中的常见问题进行了归纳和简化,分为以下几个方面。
(1)基于最新相关标准中描述的用于评估安全性和性能的检测方法,对以下产品进行检测:①已发生不良事件的医疗器械,从用户退回的和持有人留样的同批号产品;②从用户退回的和持有人留样的其他批号产品;③产品的模型变体或构成产品的原材料。
(2)利用非检测手段分析不良事件:①对涉及相同或不同批号的产品进行不良事件历史数据分析和趋势分析;②与涉及不良事件的人员通过电话或电子邮件进行访谈;③调查分析相关批次或邻近批次产品的生产记录;④对临床工程师或第三方维修机构提供的数据进行分析。
2.2.2 调查结果术语集归纳与简化
调查结果术语集将可能的调查结果分为22 个一级目录、90个二级目录、36 个三级目录。然而,在实际开展工作时,不良事件现场调查难以面面俱到。根据有源医疗器械设计开发和临床使用特点,在上市前风险管理过程中,针对生物学、灭菌、材料性能和化学反应等方面问题已充分进行了风险识别与纠正预防,因此将调查结果术语集简化为10大类,使之更加方便监测人员使用,具体分类如下。
(1)电气问题:包括电源问题(如储能系统故障、中断、功率波动)、电子元件问题、阻抗问题、绝缘问题、开路、短路、电流泄漏。
(2)互操性问题:包括通讯问题(涉及有线通信、无线通信、网络通信)、组件附件不兼容、设备间不兼容。
(3)物理化学问题:包括退化问题(如老化、渗透、腐蚀)、材料问题(如成分不当、结构不当)、理化性质不稳定、设备迁移、密封泄漏、力学问题(如变形、疲劳、断裂、机械冲击、振动、磨损)、尺寸错误、光学问题。
(4)软件有关问题:包括设计错误(涉及数据压缩、算法、数据定义、接口设计、软件时序)、软件维护问题、软件安装问题、存在安全漏洞、数据存储问题或数据丢失、数据传输错误。
(5)散热问题:包括过热及其识别问题、冷却过度、冷却不充分。
(6)报警系统问题:包括故障安全问题、识别警报系统问题、自检问题、自动停止问题、重置问题、屏蔽问题。
(7)操作问题:包括重新处理不正确(涉及清洁、消毒、组装环节)、校准问题、操作难度大、分析前处理问题。
(8)环境问题:包括静电、电磁干扰、射频干扰、梯度感应场、磁感应等问题,以及温度、湿度、光、污染等环境条件问题。
(9)其他问题:包括维护问题、运输问题、标签或使用说明不充分或不正确、确定的生产环节问题、组装问题、安装问题。
(10)其他调查结果术语:包括未发现问题、调查未完成、没有可用的发现、术语不可用、错报误报事件等。
2.2.3 调查结论术语集归纳与简化
调查结论术语集将调查结论分为17 个一级目录和18 个二级目录,旨在根据不良事件的调查结果来追溯导致问题发生的根本原因。本文结合有源医疗器械不良事件常见的调查结论,归纳出设计开发(如设计不足、人因工程学问题、安全措施缺失、设计变更验证不充分)、常见组件故障、生产环节控制不当、运输存储控制不当、受使用单位的规定影响、受环境影响、维护不当、缺乏培训、标签或说明书问题、用户问题(如超范围使用、超期使用、患者因素)、可接受的已知风险、伪造产品12 类结论术语,以及未发现问题、与医疗器械无关、原因不明、调查未完成、调查结论术语不可用5 类其他术语。
三、结果
3.1 有源医疗器械调查关注点
医疗器械不良事件调查的最终目的是确定不良事件的根本原因,调查类型术语集提供了调查的主要方向。本文通过结合有源医疗器械通常包含多个功能模块或多个适应症的特点,以及实际监测工作经验,总结了利用非检测手段调查不良事件时需要重点关注的9 个问题,并结合持有人需要内部自查的内容,绘制了有源医疗器械不良事件调查程序流程图,如图1 所示,以供相关单位参考。
9 个有源医疗器械调查关注点分别为:
①“问题产品在哪”主要了解怀疑产品是否已被丢弃,手术过程记录是否有影像资料保存,目的是追溯和还原不良事件发生过程;
②“产品问题在哪”包括了解不良事件发生时间、伤害表现、故障表现和事件后果;
③“产品在哪问题”主要掌握医疗设备存放的环境因素,包括所在科室、环境温度和湿度, 以及是否存在电磁干扰的可能性;
④“产品影响哪个”主要汇总不良事件可能涉及的患者、医护人员和合并用药/ 械(如一次性使用电极片、医用耦合剂等)相关情况;
⑤“哪个影响产品”包括使用人员资质、仪器具体操作过程、维护和保养情况(如设备部件定期清洁、除尘频率,外部常用清洁液成分)、设备使用年限等;
⑥“产品哪个影响”主要了解出现问题的是易损耗材(如线、接头或袖带)还是易损部件(如风扇、探头或蓄电池);
⑦“还有问题产品”指的是对同型号、相邻编号的设备进行追踪,针对不良事件发生情况对客户进行回访;
⑧“还有产品问题”指的是同使用单位深入了解既往是否有类似的不良事件,便于开展历史不良事件数据分析和趋势分析;
⑨“产品还有问题”指的是与医护人员、设备管理人员或患者沟通,征集设备改进意见和建议。
3.2 监测数据分析
3.2.1 有源医疗器械严重不良事件数量的排名情况
将1543 份严重程度为“严重伤害”的不良事件报告按产品名称排序,其中严重不良事件数量排名前10 位的有源医疗器械(以下简称排名前10 位医疗器械)的报告共计447 份,排名前5 位的有源医疗器械分别为病人监护仪、电子针疗仪、中药熏蒸机、输液泵和血液透析机,具体见表1。
3.2.2 调查类型术语归纳情况
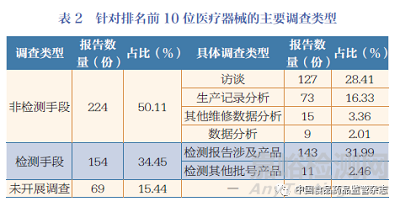
运用“2.2.1”中归纳简化的调查类型术语集,对447 份报告中持有人的调查结果进行归类,列出排名前10 位医疗器械的主要调查类型,具体见表2。结果发现,使用非检测手段开展调查的报告数量较多(占比50.11%),使用检测手段开展调查的报告数量次之(占比34.45%),其余报告未开展调查;排名前3 位的具体调查类型依次为检测报告涉及产品、访谈、生产记录分析。
3.2.3 调查结果术语归纳情况
运用“2.2.2”中归纳简化的调查结果术语集,对447 份报告中持有人的调查结果进行归类,列出排名前10 位医疗器械的前3位问题的调查结果,如图2 所示。结果发现,病人监护仪、电子针疗仪出现数量最多的不良事件是力学(磨损)问题,电子元件问题在血液透析机、红外耳温计和病人监护仪中均较为突出,退化问题(如老化、渗透、腐蚀)是大多数有源医疗器械不良事件的主要调查结果,通讯(有线)问题仅出现在病人监护仪的主要调查结果中。
3.2.4 调查结论术语归纳情况
运用“2.2.3”中归纳简化的调查结论术语集,对447 份报告中持有人的评价结果进行归类,列出排名前10 位医疗器械的调查结论,如图3 所示。结果发现,原因追溯到常见组件故障的不良事件数量最多,追溯到用户问题的次之。
四、讨 论
4.1 原因调查术语集使用的必要性
IMDRF 原因调查术语集对所有调查类型、调查可能出现的结果及调查结论进行了系统分类和命名,为全球持有人开展上市后监测提供了指南性文件。国家药监局发布的《医疗器械注册人开展不良事件监测工作指南》 要求相关单位在填报医疗器械不良事件时,尽可能使用国家医疗器械不良事件监测信息系统提供的术语集。但现场调查作为个例报告处置的部分内容,若对相关要求仅以一段话进行阐述,对具体分析实际情况的指导作用有限。
本文将有源医疗器械作为研究对象,将术语代码提示内容简化为普遍适用的调查方法,便于对从事医疗器械不良事件调查的工作人员进行培训,提高其与临床工程师、医护人员及患者之间的沟通效率。原因调查术语集能将不良事件报告中的持有人评价结果按统一标准进行转化,有效解决监测机构数据利用难题,可为持有人开展历史不良事件风险监测提供技术支持,也可为医疗机构医疗器械临床使用管理委员会全面落实《医疗器械临床使用管理办法》等相关法律法规要求、监测识别医疗器械临床使用安全风险提供参考。
4.2 原因调查术语集使用的可行性
《医疗器械不良事件监测和再评价管理办法》要求持有人对医疗器械不良事件及时开展调查、分析、评价,采取措施控制风险;要求省级监测机构对本行政区域内注册或者备案的医疗器械不良事件报告进行综合分析,对发现的风险提出监管措施建议。本文在运用调查类型术语集的过程中,发现大部分持有人都会主动开展调查,调查方式以检测报告涉及产品、访谈和生产记录分析为主。本文在运用调查结果术语集的过程中,发现调查结果能较好地对应产品特点,如病人监护仪、电子针疗仪在临床上经常被超负荷使用,这两个品种出现次数最多的调查结果术语均为力学(磨损)问题,指的是产品材料因使用、变质或更换等因素过早或在预期时间内发生腐蚀,由此导致的机械问题 ;中药熏蒸机和输液泵出现次数最多的调查结果术语均为维护问题,临床上,这两个品种的常见使用问题包括由未清理药渣、残留药液导致的器械故障 ;退化是指设备老化而削弱、腐蚀或损坏,在本文纳入的10 类有源医疗器械调查结果术语中位居前3,反映了当前有源医疗器械存在的使用期限与安全有效性问题。因此,原因调查术语集能较好地反映医疗器械不良事件调查结果和产品问题,其使用具有可行性。
4.3 原因调查术语集使用存在的问题
IMDRF 发布的《用于分类不良事件报告的术语》涵盖伤害表现、器械故障、调查类型、调查结果和调查结论。我国持有人对不良事件原因调查术语集的了解程度有限,处于认知起步阶段,特别是管理类别为第一类和第二类医疗器械产品的持有人众多,不良事件监测人员多为质量部门人员兼任,缺乏医学专业教育背景和临床调查经验,不利于掌握和应用原因调查术语集。省级医疗器械不良事件监测技术机构是负责开展对持有人提交的不良事件报告评价进行审核的主要单位。目前,部分机构的相关工作人员未曾了解和重视原因调查术语集,同时,受限于专业课程和教材的缺失,很难对相关术语的选择是否准确、贴切作出正确判断。
4.4 原因调查术语集使用前景展望
笔者认为,原因调查术语集的推广和使用前景十分广阔。一是便于持有人开展风险趋势分析。目前,大部分持有人主要沿用在注册审评阶段制定的失效模式分析表对医疗器械上市后风险进行研究,未结合不良事件报告进行风险分析,与真实世界数据脱钩;而借助原因调查术语集,能更好地对暴露的产品问题进行分类,进一步开展风险受益分析,从而更快找出关键风险点,做出风险控制决策。二是便于医疗器械不良事件监测技术机构开展风险信号检测工作。目前,相关机构主要基于不良事件问题术语频数和严重程度开展风险信号检测,设计开发、生产流通、临床使用等因素往往会影响工作效率;而借助原因调查术语集,能够使持有人的调查分析结论语义明确且表述一致,便于进行数据可视化、高级查询和对风险趋势建模分析,避免信号干扰和信号稀释,这是对现有预警条件的升级,可以更好地满足监测工作需要。
五、结 语
当前,推广和应用不良事件相关术语是提升我国医疗器械上市后监测技术、开展医疗器械风险信号挖掘,以及深入开展医疗器械循证研究的重要手段,也是亟待解决的重要问题。同时,基于医疗器械行业性质以及新材料、新技术和新设计不断涌现,不良事件相关术语将会不断更新。建议国家药品监管部门适当投入行政力量、技术人才和项目经费,推进我国医疗器械不良事件相关术语集体系化建设和深入研究,便于各相关单位使用,推进国家监管机构不良事件报告信息交换,促进医疗器械监管科学进一步发展。