目的
通过中国临床试验注册中心(ChiCTR)的临床试验注册信息,分析已注册的真实世界研究(RWS)现状。
方法
以“真实世界”为检索词检索ChiCTR网站,搜集真实世界研究相关注册项目,检索时限从建库至2022年5月4日,采用描述性分析方法进行汇总。
结果
共纳入642个研究注册项目。单个研究样本量中位数为482例;RWS以观察性研究为主,干预性研究数量逐年增加。研究所处阶段为上市后药物监测或Ⅳ期临床试验阶段的研究共267项(41.59%)。主要测量指标以临床结局指标居多(56.23%),其中使用最多的为总生存期/总生存率(15.79%)。62.15%的注册项目符合注册最低要求。
结论
ChiCTR注册RWS数量呈递增趋势,但目前存在RWS概念不清、注册内容填写不规范、数据共享方式混乱的问题,注册研究完整度和内容质量有待提升。
真实世界研究(real world study,RWS)是指在真实临床、社区或家庭环境下获取多种数据,评价某种治疗措施对患者健康的影响,是当前医药领域的研究热点。2018 年中国首个 RWS 指南问世,次年中国真实世界数据与研究联盟发表了 RWS 系列技术规范。随着 RWS 方法学和技术规范的制定,RWS 的可靠性和可行性大幅提升,也为促进真实世界证据的生产和使用提供更多参考依据。相比于传统临床试验,RWS 更适用于在普通人群中评价上市后药物和疗法的安全性与有效性。RWS 具有外部效度强、样本量大、研究过程中可调整方案、数据来源多样、结局指标临床意义明确等优点, 但同时存在概念混淆、注册信息缺失等问题。
临床试验注册作为促进临床研究透明化的重大举措,已被研究者熟知并接受。中国临床试验注册中心(Chinese clinical trial registry,ChiCTR)由四川大学华西医院建立,是世界卫生组织(world health organization,WHO)国际临床试验注册平台一级注册机构。其目的在于公开临床试验信息、追溯试验结果、避免不必要的重复研究。ChiCTR 是国内唯一被 WHO 认证的临床试验一级注册平台。临床试验注册不仅可推动临床试验透明化,更可减少设计和实施过程中潜在的偏倚风险,节约研究资源,WHO 推荐所有的临床试验都应进行注册。为分析 RWS 注册现状,改善 RWS 注册中的不规范行为,本研究基于 ChiCTR 网站,对涉及真实世界研究的注册临床试验进行特征分析,以此了解 RWS 注册现状,探讨相应问题。
1、资料与方法
1.1 纳入与排除标准
纳入标准:所有题目中带有“真实世界”的临床试验项目,无论采用何种研究类型和研究设计。排除标准:重复注册项目和研究者撤消项目。
1.2 项目检索策略
以“真实世界”为检索词,在 ChiCTR 网站 (http://www.chictr.org.cn/)的注册题目中检索,检索时限从建库至 2022 年 5 月 4 日。
1.3 项目筛选与资料提取
2名研究者对纳入的临床试验注册项目进行独立筛选、提取资料后交叉核对,如有分歧,则通过讨论或与第三方共同协商解决。
资料提取内容包括:
① 注册研究的基本信息:注册题目、研究课题的正式学科名称、注册时间、申请人所在单位;
② 研究的设计信息:研究目的、研究疾病、研究所处阶段、研究类型、研究设计、干预措施、样本量、主要测量指标、研究实施负责单位、研究实施地点。其中本研究将主要测量指标分为临床结局指标和替代指标。在研究所处阶段、研究类型、研究设计方面,均采用 ChiCTR 注册时相应条目下拉框中的内容,不做其它分类;
③ 其他内容:注册号状态、伦理审查、数据采集和管理、原始数据共享等。
根据 WHO 国际临床试验注册协作网(international clinical trials registry platform,ICTRP)的最低注册条目判定注册项目的完整度。最低注册条目共 20 条,均在 ChiCTR 中体现。未提取数据的条目直接在提取数据过程中判定是否符合完整度要求。
1.4 统计分析
定量数据如样本量采用中位数与四分位数进行描述分析,定性数据采用频数和百分比描述分析。采用 Excel 软件录入、整理数据,采用 GraphPad Prism 8 分析数据。
2、 结果
2.1 项目筛选结果
共检索“真实世界”注册项目 643 项,排除 1 项研究者撤消项目,共纳入 642 项注册项目。
2.2 纳入项目的基本特征
注册项目数量 从 2015 年开始,RWS 注册项目数量逐年递增,2021 年达到 212 项,2022 年截至 5 月 4 日注册数量达到 72 项。结果见图1。
图 1 2011~2022 年 ChiCTR 注册 RWS 临床试验
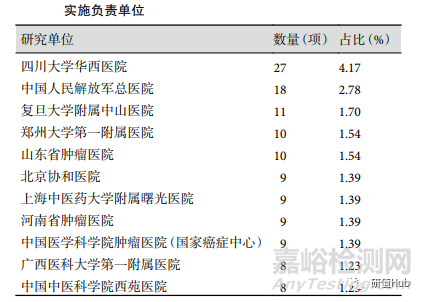
研究实施负责单位和实施地点 所有项目涉及的研究实施负责单位共 269 家,注册项目数量最多的 11 家单位见表 1,注册项目数量≥5 项的单位共 34 家。199 项注册项目为两个及以上医院合作, 其中与韩国进行国际合作的项目 2 项,省内医院合作项目 97 项,跨省(市)医院合作的项目 99 项。研究实施地点数量前 3 位的省(市)分别为北京(65 项)、 江苏(51 项)和河南(48 项)。实施地点最多的项目为华中科技大学附属协和医院作为主办单位实施负责的一项促动力药维持治疗功能性消化不良的临床疗效与安全性研究,由 98 家医院共同合作。
表 1 ChiCTR 注册RWS临床试验项目数量
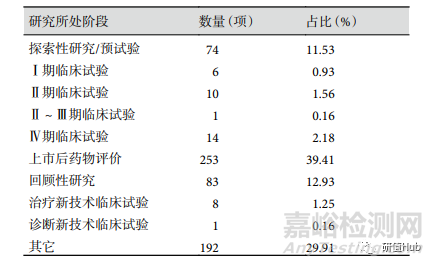
研究所处阶段 注册信息中明确研究所处阶段的项目有 450 项(70.09%),最多的为上市后药物评价 253 项(39.41%),其次为回顾性研究 83 项(12.93%),Ⅱ、Ⅲ期临床试验共有 11 项(1.72%)。各阶段研究项目数量见表2。
表 2 ChiCTR 注册RWS临床试验研究所处阶段
注册项目样本量 642 项注册项目的总样本量为 7,815,542 例,其中样本量超过 1 万例的共 53 项,小于 50 例的共 59 项;除样本量为 0 的注册项目外,样本量最小的为 10 例,最大的为 133 万 例;所有项目样本量的中位数及四分位数为 482(150,1500)例,样本量分布见图2。
图 2 ChiCTR注册RWS临床试验样本量分布
研究类型与研究设计 根据 ChiCTR 设置的研究类型分类,RWS 以观察性研究为主,共 481 项 (74.92%),其次为干预性研究127 项(19.78%),诊断试验 9 项(1.40%),治疗新技术临床研究 8 项(1.25%),其他类型如流行病学研究、病因学/相关因素研究、预后研究、预防性研究、基础科学研究和卫生服务研究等共 17 项(2.65%)。
研究设计数量排名前五位的分别是单臂 178 项 (27.73%),连续入组 154 项(23.99%),非随机对照试验 107 项(16.67%),队列研究 79 项(12.31%)和析因分组 49 项(7.63%)。干预性研究中,实效性随机对照试验(pragmatic randomized controlled trial, pRCT)共 38 项(29.92%),其对照组采取阳性对照措施居多(84.21%),且样本量除一项研究外均大于 50 例。
主要测量指标 将主要测量指标分为临床结局指标和替代指标两类,分别有 361 项和 278 项, 另外 3 项注册项目无测量指标。临床结局指标使用最多的为总生存期/总生存率(15.79%),其次为不良反应/不良事件/不良事件发生率(13.57%);替代指标使用最多的为无进展生存期/中位无进展生存期(37.77%)。
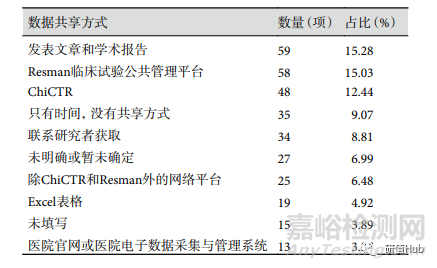
原始数据共享 纳入研究中,256 项(39.88%) 注册项目未进行数据共享,其中不进行数据共享但却填入共享方式的项目共 162 项;386 项(60.12%) 注册项目同意数据共享,但共享方式为不公开的项目有 7 项。同意数据共享的项目中,共享方式以采用发表文章和学术报告进行数据共享最多,其次为通过 Resman 临床试验公共管理平台和 ChiCTR, 数据共享方式见表3。
表 3 ChiCTR注册RWS临床试验同意数据共享项目共享方式排名前10位
研究疾病分布 在 642 项研究中,除 5 项药物评价和 7 项器械或技术作用效果研究外,630 项研究共涉及 19 个疾病类型和 8 个中医证候。其中,肿瘤(261 项)、心脑血管疾病(67 项)和消化系 统疾病(46 项)研究相对较多,各研究疾病类型详见表 4。研究最多的疾病为肺癌(共 56 项研究,其 中非小细胞肺癌占 43 项),其次为乳腺癌(50 项) 和肝癌(39 项,其中肝癌为 22 项,肝细胞癌为 15 项,肝内胆管细胞癌为 2 项)。
2.3 纳入项目整体分析
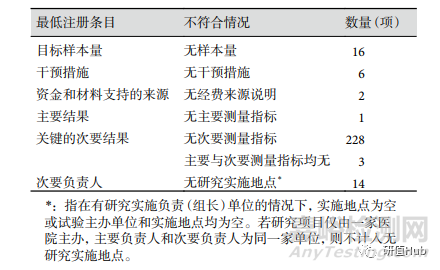
注册项目完整度 642 项研究中,共 399 项 (62.15%)注册项目符合最低要求条目。自 2019 年开始,临床试验注册项目完整度逐年增加,从 19 年 58.33% 增加到 2022 年 65.28%。不符合的条目集中在样本量为 0(16 项)、无干预措施(6 项)、 无主要测量指标(4 项)和无研究实施地点(14 项), 见表5。
表 5 ChiCTR注册RWS临床试验项目不符合最低注册要求情况
注册项目内容质量评估 在最低注册条目中,干预措施、患者入选情况、主要结果和关键次要结果四个条目的内容不完善是导致注册项目内容质量较低的主要原因。干预措施要求标明其持续时间,而干预性研究中仅有 10 项(7.81%)研究标明;患者入选情况应该包括该信息是否可得,若可得,则点击具体链接,而 ChiCTR 注册条目中仅有征募研究对象的时间及征募进展,且通常未得到及时更新;主要和关键次要结果描述内容应包括测量该结果的时间,仅有 69 项(10.75%)研究描述了主要测量指标的测量时间点。
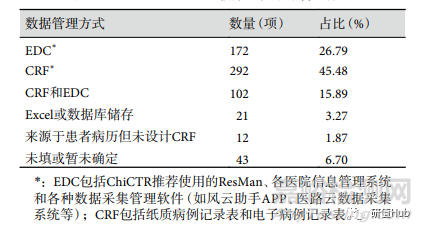
除最低注册条目外,数据管理系统同样存在内容不符合要求的问题。注册结果中仅有 102 项(15.89%)同时包含病例记录表 (case record form, CRF) 和电子数据采集与管理系统 (electronic data capture,EDC),其余为仅使用 CRF 或 EDC, Excel 或数据库储存,来源于患者病历但没有设计 CRF,暂未确定或未填。结果见表6。
表 6 ChiCTR注册RWS临床试验数据管理方式
3、讨论
本研究通过对 ChiCTR 注册的 RWS 临床试验特征进行分析,发现目前 RWS 热点聚焦在肿瘤治疗领域,尤其是针对非小细胞肺癌和乳腺癌的治疗,并且该类研究在实施地点、样本量、研究类型和主要测量指标方面均符合 RWS 的特点。目前 RWS 与其他研究的区别在于获取数据的环境,而非研究方法和试验设计。RWS 数据来源于真实医疗环境且医院间合作项目数量较多,样本量常为千例左右;RWS 以观察性研究为主,但干预性研究的数量逐年增加;不同于传统临床试验中因随访时间短而无法观察到终点结局,RWS 通常强调以患者为导向的临床结局指标。同时本研究发现 RWS 在注册中存在概念不清、数据共享方式混乱、 注册内容填写不规范的问题。
RWS 在研究目的方面注重在真实环境下是否有效,即效果(effectiveness),通常处于上市后药物监测或Ⅳ期临床试验阶段。但本研究中 RWS 注册项目处于上市后药物监测或Ⅳ期临床试验阶段的项目仅占 41.59%,更有注重效能的Ⅱ、Ⅲ期临床试验出现。将 11 项Ⅱ、Ⅲ期临床试验项目再度核对后发现其均属于 RWS,但因研究类型、研究设计的选择和评价药物安全性与有效性的目的,导致研究者无法正确选择试验分期。这反映出研究者将 RWS 与传统临床试验的概念混淆,在理解 RWS 的 真实含义方面存在不足。
数据共享是实现临床试验透明化的关键点,更是 RWS 的关键问题之一。ChiCTR 和国际医学杂志编辑委员会均要求临床试验在注册时必须包含数据共享声明。本研究中仅 379 项(59.03%)研究愿意共享数据,明显低于 2018 年公布的数据结果。不完全理解原始数据共享的定义及过程阻碍了注册者选择数据共享。ChiCTR 推荐使用 ResMan 并共享试验数据,但同意数据共享的项目中仅 58 项(15.30%)研究使用 ResMan,更多的注册项目填写了不正确的共享方式,如发表文章和学术报告,利用 Excel 表及标明时间却没有具体方式等。此处,169 项研究在是否共享原始数据与共享方式中填入相反的选择。缺乏共享数据的知情同意,也缺少防止数据用于误导性的二次分析等都导致研究者最终放弃数据共享。
项目注册时,除题目中标明真实世界外,部分项目在研究目的、药物成份和治疗方案详述中进行说明,但更多项目未做任何 RWS 说明,无法分辨出该注册项目是否真的属于 RWS。另外,临床试验注册项目存在样本量填 0;试验实施地点为空或不适用;已明确超过研究实施时间和招募观察对象时间,但招募研究对象情况为正在进行或尚未开始等填写不规范的情况。ChiCTR 注册指南明确标识完整的数据管理系统组成部分后,注册结果仅 15.89% 符合网站要求,这一数据明显低于全部临床试验注册调查中的数据采集与管理结果。这都显示了 RWS 大部分研究者在注册项目时未仔细阅读 ChiCTR 注册指南。
由于 RWS 可随访到临床结局指标,替代指标的使用已逐渐减少,而本文使用的 WHO ICTRP 最低注册条目里包含关键的次要结果条目,因此其并不完全适用于 RWS,是否要求 RWS 具有次要测量指标还有待商讨,故 RWS 注册项目的完整度应高于本研究统计结果。
综上所述,基于 ChiCTR 注册项目提取的信息,RWS 注册项目整体完整度较好,但临床试验注册质量仍有待进一步完善。研究者在设计 RWS 时要清晰认识和理解 RWS 的概念与实质,在研究的相应时间截点后及时更新注册内容。注册平台可针对 RWS 规定填写位置或设计填写条目,使 RWS 更加清晰明确。由于 RWS 的特点为获取真实医疗环境下的数据,在不更改网站现有注册条目的情况下,注册平台可规定注册者在研究目的条目填写时标明真实世界数据来源,建议重点增加数据获取环境(数据来源)条目,填写如电子档案,疾病登记表,健康设备收集信息等内容;将网站提供的注册指南放在醒目的位置将更有利于注册者获取标准的注册过程促进注册内容的规范化,同时建议提供专门的 RWS 注册指南。