【提要】
随着消化内镜微创治疗技术的迅速发展,内镜黏膜下剥离术已成为胃肠道早期癌的标准治疗方式,但由于操作难度大、学习曲线长、术中出血及穿孔风险相对较高,限制了其在世界范围内的推广。目前出现的多种牵引技术仍存在不同程度的不足,为此,消化内镜手术机器人应运而生。根据内镜搭载平台的可获得性,消化内镜手术机器人分为专用型内镜机器人和普通内镜整合型机器人。在内镜黏膜下剥离术中,已有多项研究显示出消化内镜手术机器人较普通内镜的优势。本文就目前常见的消化内镜手术机器人的结构特点及临床操作性能进行介绍,以期为消化内镜手术机器人的发展及临床应用提供参考。
内镜黏膜下剥离术(ESD)与内镜黏膜切除术(EMR)相比,具有更高的完整切除率和更低的原位复发率,与外科手术相比,具有更小的创伤性、更低的手术相关死亡率以及更低的医疗成本,目前已成为消化道早期癌的标准治疗方式。然而,ESD对内镜操作技术要求高,学习曲线长,术中多缺乏有效牵引,黏膜下剥离视野受限,在现有设备条件下术中难以形成类似外科腹腔镜手术中的操作三角(triangulation),导致手术出血及穿孔风险较高,因此在部分西方国家中的应用并不广泛,也在一定程度上限制了其在我国基层医院的推广应用。临床医师尝试了多种牵引方法来解决这些困难,包括体位牵引、重物牵引、止血夹联合弹力圈牵引、S‑O金属夹牵引、磁力牵引、经皮牵引等,它们在ESD过程中可在一定程度上改善手术剥离视野,但这些方法在牵引力方向控制、黏膜下层张力调整、牵引区组织重新抓取等方面仍存在局限性,且其中部分方法为有创性操作,限制了其在ESD中更广泛的应用。因此,多种消化内镜手术机器人被开发出来用于解决上述问题。
手术机器人是集医学、人体工程学、计算机科学、机械学等多学科于一体的医疗器械产品,可从视觉、听觉、触觉等多维度为医师手术操作提供支持,被用于超出人类能力范围的微创手术领域。传统外科手术机器人按临床操控方式可分为被动支撑型、主动驱动型、协同操作型、主从遥控型等。其中主从遥控型为目前最常见的机器人类型,即主端由手术医师控制,从端由机械臂控制,主端通过从端上的视频成像系统获得术中视野图像。
消化内镜手术机器人大多数属于主从遥控型,但由于消化内镜手术经狭窄腔道进行,手术视野不易显露,且载体为柔性内镜,因此其设计特点与达芬奇等腹腔镜手术机器人有所不同。我们根据内镜搭载平台的可获得性,将消化内镜手术机器人分为专用型内镜机器人(需专用设计生产的内镜机器人)和普通内镜整合型机器人(可与普通内镜组装使用的内镜机器人)(表1)。
表1 目前常见的消化内镜手术机器人汇总
|
机器人名称 |
国家 |
分类 |
研究进展 |
|
STRAS系统 |
法国 |
专用型消化 |
活体动物实验 |
|
内镜机器人 |
|
仿生柔性机器人系统 |
中国 |
专用型消化 |
离体动物实验 |
|
内镜机器人 |
|
Flex系统 |
美国 |
专用型消化 |
离体动物实验 |
|
内镜机器人 |
|
MASTER系统 |
新加坡 |
普通消化内镜 |
临床试验 |
|
整合型机器人 |
|
TASER系统 |
英国 |
普通消化内镜 |
临床试验 |
|
整合型机器人 |
|
PETH系统 |
韩国 |
普通消化内镜 |
离体动物实验 |
|
整合型机器人 |
|
REXTER系统 |
韩国 |
普通消化内镜 |
离体动物实验 |
|
整合型机器人 |
|
EndoPicasso系统 |
中国 |
普通消化内镜 |
活体动物实验 |
|
整合型机器人 |
一、专用型消化内镜机器人
(一)STRAS(subperichondrial transseptal)系统
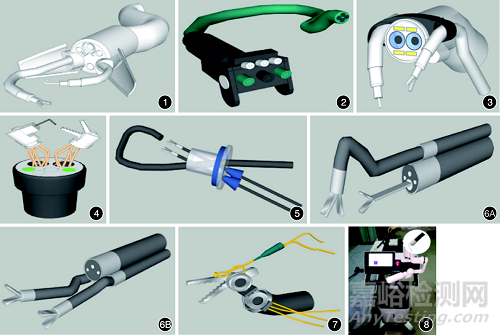
该系统的第一代(STRAS V1)是由法国研究人员基于Anubiscope平台在2013年报道的一种柔性消化内镜机器人。2017年Zorn等在第1代基础上改进为STRAS V2。该系统内镜模块主要包括1条主镜和2个操作臂。主镜的远端同标准内镜配置类似,包括摄像头、照明系统和气水通道;2个柔性操作臂由主镜头端两侧的专用通道伸出,外缘有流线型保护壳,可避免进镜过程中损伤周围组织。2个操作臂伸出后可向内弯曲形成环形,构成手术需要的操作三角,各系统协同,共可提供10个自由度的精细操作(图1)。该团队进行的12只动物ESD实验结果表明,STRAS V2系统的平均剥离时间为34.25 min(4~93 min),剥离速度[(64.44±34.88)mm2/min]明显高于传统内镜[(35.95±18.93)mm2/min],且上述实验过程中STRAS V2系统组出现了上升式学习曲线,但尚未观察到峰值,手术穿孔率(1/12)与使用标准内镜(8/16)相比显著降低。
该系统相较传统消化内镜在进行ESD时可实现操作三角,灵活性好,安全性高,且组装简便快捷,两人合作安装仅需约10 min;在准备阶段中的内镜固定需由一名助手辅助放置于托架上,之后的手术操作由单人即可完成;操作过程中可提供3个末端执行器,实现抓取、切割和创面缝合功能,可有效节约手术时间,充分满足手术所需的灵巧性及精确性。但是该系统也存在不少局限性:第一,虽然该系统各结构可拆分重复使用,但需要完全重新生产特殊的内镜,无法与传统内镜灵活组装,使得制造成本较高;第二,该系统原型机柔性部分的长度为65 cm,经肛仅能到达降结肠或经口到达近端胃,无法完成更远部位病变的切除;第三,该系统目前应用仅为临床前试验阶段,尚无临床研究数据。
(二)仿生柔性机器人(A Bio‑inspired Flexible Robot)系统
仿生柔性机器人系统由中国香港Yeung等在2014年设计发明,其主系统为美国USGI医疗公司的“Transport”内镜平台及2条仿人手腕的机械臂。“Transport”内镜平台具有2个自由度,可使末端固定在任何方向;具有4条工作通道,其中2条直径为6 mm,供手术所需的机械臂通过,另两条直径为4 mm,允许手术所需的视频光源通过(图2)。该团队在离体猪胃组织上进行的一项实验研究显示,参加实验的2名内镜医师可顺利切除75%~85%的标记黏膜病变,并均在30 min内完成。
该系统与STRAS系统相比,首先,机械臂均位于“Transport”内镜平台套管内,可有效防止进镜过程中的组织损伤;其次,执行器末端可被套管有效固定,增加机械臂稳定性,从而提高手术安全性。但该系统无法用于常规胃肠道检查,应用该系统进行ESD前需先使用普通内镜进行检查,发现病变后再更换该机器人系统进行病变切除;且受通道内径限制,该系统所用的视频内镜较小,无法观察到机器人手臂以外的视野,影响手术医师对病变及其周围环境的整体认知,增加手术风险。目前该系统仅有用于体外动物的观察实验操作数据,缺乏对照试验研究,实用性尚有待于证实。
(三)Flex手术机器人系统(Medrobotics Flex System)
Flex手术机器人系统起源于美国卡耐基梅隆大学Amir等人设计的应用于心脏外科微创手术的一种蛇形手术机器人系统,之后改进为Medrobotics Flex系统,应用于头颈部手术,主要适用于口咽、下咽和喉的经口微创外科手术。第3次系统改进后增加了注气系统,应用范围随之也扩大到消化道,于2017年获得美国食品药品监督管理局(FDA)批准应用于消化系统ESD。该系统的内镜模块包含1条主镜和2个直径4 mm的外挂通道,柔性操作臂通过外挂通道到达操作部位,机械臂可以活动近180°(图3),并可在3D高清可视化下进行抓取、切割和缝合。2019年在无ESD经验的医师中进行的一项随机对照研究初步显示了Flex手术机器人系统较传统ESD的优势:机器人组完全切除率达到了100%,常规ESD组为50%(P<0.001);传统ESD组较机器人组穿孔率有上升趋势(60%比30%),但差异无统计学意义(P=0.18),不除外与样本量少有关;Flex组总手术时间显著减少[(34.1±19.14)min比(88.6±31.40)min,P=0.001],黏膜切开时间也有加快的趋势[(6.3±2.72)min比(9.2±3.42)min,P=0.06],黏膜下剥离时间明显缩短[(27.8±18.38)min比(79.4±30.70)min,P=0.002];Flex的优势也体现在操作者主观满意度评分上,表现为身体疲劳度、时间需求以及挫败感的减少。
该系统相较STRAS,同样为需重新生产的特殊内镜,但与STRAS不同的是,Flex仅由一名操作者即可控制完成操作,且Flex的机械臂更靠外侧,未设置保护壳,从专用外化套管中伸出,其活动不再受末端壳的限制,灵活度更高。但Flex系统仍存在局限性。首先,它仍然需要使用特制直肠端口进行适当的密封,以维持充气,且机器人内窥镜的工作长度相对较短,仅允许切除距离肛门边缘25 cm及以内的病变;其次,该系统虽已获得FDA批准,但目前暂无活体动物及临床研究数据。
二、普通消化内镜整合型机器人
(一)主从式腔道内窥镜机器人(Master and Slave Transluminal Endoscopic Robot,MASTER)系统
MASTER是2008年由新加坡Phee等设计发明的一种消化内镜机器人系统,其主系统安装在双通道治疗内镜上。由于第1代MASTER从属机械臂为多关节铰链式,自由度受限,为增加灵活度,仿人体前臂改进的二代MASTER操作臂由串联式改为并联式,自由度显著增加。其末端执行器包括一个 “L”型钩刀和一个抓钳(图4),抓钳臂负责提起病变组织,辅助暴露手术视野,钩刀操作臂完成黏膜下病变剥离。该系统需2名操作员操作,一名内镜医师负责在操作台通过手柄控制机械臂,另一名助手医师负责抓持内镜。Ho等于2010年进行的一项动物实验显示,MASTER可有效提高ESD的可行性和安全性。Phee等在2012年进行的一项多中心前瞻性研究显示,MASTER可有效提高复杂内镜手术的可行性和安全性。该研究纳入了3例来自印度中心、2例来自香港中心的早期胃癌患者,结果显示,研究中所有患者成功完成MASTER辅助下ESD,平均黏膜下剥离时间为18.6 min;术中仅出现1例出血,经止血治疗于术后第3天好转出院;病变切缘均阴性;术后为期30 d的随访均未观察到任何并发症,内镜复查未发现残留或复发的肿瘤。
首先,MASTER与前文中提及的3种内镜机器人系统不同,它可与普通内镜组装使用,无需重新生产新型内镜;其次,MASTER二代系统在柔性内镜检查中模仿人手臂改进了机械臂,提高了术中操作的自由度,能更加充分地暴露手术视野,有效降低出血、穿孔等常见并发症的发生率。但该系统也存在部分局限性,术中需要机械臂提拉、切割功能以外的操作时,需从患者身上取出机器人镜身,更换普通内镜进行操作。
(二)经肛内镜黏膜下切除(Trans‑Anal Submucosal Endoscopic Resection,TASER)系统
TAESR技术起源于经肛门内镜微创手术 (trans‑anal endoscopic micro‑surgery,TEMS), 于2013年由英国Saunders等报道,并应用于临床。该系统由GelPoint平台、1条治疗内镜(GIFH260)、2个腹腔镜器械组成(图5)。平台提供3个密封的直肠入口,内镜提供手术视野、气体注入和切除或止血设备,腹腔镜器械负责进行组织回收、缝合、夹闭或切割。Tsiamoulos等进行的一项单中心观察队列研究中,该平台应用于17例常规内镜治疗失败的复杂直肠息肉样病变患者(平均直径88 mm),16例(94%)患者完全切除,平均切除时间为185 min(65~480 min),术后均无明显穿孔,仅有1例患者术后有轻微出血。
该系统组装简单,设备轻巧,易于移动,实用性强。根据上述试验研究结果,TASER在未来有可能成为普通内镜下难以治疗的复杂直肠息肉的新型治疗方式;但该系统目前的应用仅限于直肠,一定程度上限制了它的应用及推广。
(三)便携式内镜机器人(Portable Endoscopic Tool Handler,PETH)系统
PETH系统于2019年由韩国Hwang等设计提出。PETH主系统由普通内镜与1条或2条机械臂构成,机械臂为外挂式,可以实现两个独立的每个方向超过100°的弯曲,使机械臂末端能够到达内镜可视范围内的任何点,实现多方向牵引和抓取(图6)。每个机械臂的运动都由操作主手控制,主手操作方向与机械臂运动方向同步。该团队进行的一项在离体猪胃模型上的体外实验证实,PETH在牵引、张力控制和抓取方面均具有明显优势;同时该实验数据显示,PETH‑ESD的黏膜下剥离时间及总手术时间均明显短于传统ESD(前者P=0.003,后者P=0.011);传统剥离中视野不佳的时间比率为20%,PETH组为0%,充分显示出PETH对手术视野暴露的优势;PETH‑ESD的解剖速度明显比传统ESD快2.5倍以上(P<0.001);PETH‑ESD中病例均实现整块切除且无穿孔发生。
PETH系统与传统内镜相比,具有与MASTER类似的优点。PETH与MASTER相比,也存在诸多优势:其一,PETH可与普通单通道内镜组装使用,且组装更容易,仅需约5 min,而MASTER机械臂与内镜的组装需2 h;其二,PETH可以根据内镜手术类型,灵活调整连接到标准内镜上的机械臂数量和方向;其三,PETH机械臂的转动角度与控制其运动的拇指棒主手的倾斜度成正比,增加了内镜医师对机械臂的操控性及操作灵活性;其四,PETH开发了图形模拟器,可显示机器人臂在胃肠道中的位置,这对辅助完成机器人臂在内镜视野之外的操作非常有帮助。
但PETH系统由于附加机械臂,使得内镜直径增大,约为15 mm,而传统内镜直径为9~13 mm,降低了患者内镜下治疗的耐受性。Hwang等进行的离体实验数据显示,与传统ESD相比,在PETH‑ESD中,标本的切除面积较大(P=0.022);切除标本的总黏膜下厚度稍大(总厚度P=0.448,黏膜下厚度P=0.118)。笔者认为,这可能与手术医师操纵机械臂时缺乏压力感受有关,换言之,可能与机械臂尖端缺乏压力监测有关。另外,该系统目前仅有体外猪胃模型研究数据,进入临床使用支持证据尚不足。
(四)基于旋转关节的辅助内镜机器人(Revolute Joint‑Based Auxiliary Transluminal Endoscopic Robot,REXTER)系统
REXTER是一种基于旋转关节的、可拆卸的辅助内镜机器人系统,2019年由韩国Kim等设计发明。该系统机械臂呈串联式安装在通用内镜(GIF‑2T240)上(图7)。该系统的机械臂有2个连杆(每个连杆15 mm),并有4个自由度来完成手术所需的复杂操作。Kim等进行的一项体外实验证实,ESD操作经验丰富组中,使用传统方法及机器人辅助方法的平均手术时间差异无统计学意义,ESD操作新手组亦如此;但两组参加实验人员均显示,使用机器人辅助的方法,操作时间均随着实验的进行而缩短,且在ESD操作新手组中,手术穿孔率明显降低(1/10比6/10),手术安全性明显提高。
REXTER与TASER、PETH类似,均可根据手术需要,灵活地与普通内镜进行组装或拆卸,系统组装简单,使用便捷。但与MASTER、TASER及PETH相比,该系统存在一定的不足,其仅能在术中进行组织牵拉,无法实现切开、缝合、术中止血等操作,不利于术中并发症的处理。且该系统目前仅在离体动物模型中显示出ESD操作经验丰富者与ESD操作新手在手术安全性和效率方面的差异,仍需更多的实验数据支持该系统的临床推广。
三、国内消化内镜手术机器人
目前我国消化内镜手术机器人的发展尚处于起步阶段。2002年王党校等设计出一款用于纤维内镜的机器人系统,但该系统主要用于控制胃镜手柄,较难应用于ESD等治疗操作。2016年杨云生教授团队自主研发出软式内镜机器人YunSRobot系统,该系统可与普通消化内镜整合使用,且为主从式操控型,内镜医师通过主端手柄实现对从端镜体输送机械臂及镜体操作机械臂的控制。2018年进行的一项研究显示,YunSRobot系统可在视野清晰度符合操作要求的前提下实现对人体胃镜检查的全部操作,虽然操作时间较普通内镜有所延长,但数据显示出机器人系统良好的学习曲线,且由于样本量较小,尚未观察到峰值。2018年,山东大学齐鲁医院李延青教授团队联合深圳罗伯医疗公司(ROBO Medical)研发的EndoPicasso机器人系统(图8)首次在第三届世界医疗机器人大会上亮相,其同样为可与普通消化内镜整合使用的主从式操控型系统,该系统为外挂式机械臂,可与普通内镜整合使用,手术柔性臂直径为2.5 mm,具有4个自由度,目前已完成离体和活体动物ESD实验,均显示其可以显著缩短剥离时间,减少肌层损伤等并发症。
图1 STRAS机器人系统模型图 图2 仿生柔性机器人系统模型图 图3 Flex手术机器人系统模型图 图4 主从式腔道内窥镜机器人(MASTER)系统模型图 图5 经肛内镜黏膜下切除(TASER)系统模型图 图6 便携式内镜机器人(PETH)系统模型图 6A:单臂;6B:双臂图7基于旋转关节的辅助内镜机器人(REXTER)系统模型图 图8EndoPicasso机器人系统实物图
四、小结
随着我国消化道早期癌检出率逐年提高,未来对ESD的需求将进一步增加。目前上述的诸多实验研究数据均表明,消化内镜机器人技术的引入,能够大幅提升ESD手术操作的精确度与稳定性,降低操作难度,改善学习曲线,提高手术质量,引领微创内镜手术技术的变革。未来在物联网技术、智能医疗、基于人工智能的视频分析、远程监测技术的综合应用下,人机交互反馈信息得以丰富,内镜医师对手术机器人的操作精度和临场感将会进一步提升,从而加速ESD技术在世界范围内的推广应用并造福广大患者。