他达拉非(Tadalafil)是一种选择性、可逆性的磷酸二酯酶 5(PDE5)抑制剂,用于治疗男性勃起功能障碍(ED),该药具有诸多优点如选择性高、不良反应小、半衰期较长等[1~2]。他达拉非片原研品为美国礼来公司生产的 Cialis。他达拉非的生物药剂学分类(BCS)为Ⅱ类[3~4],即低溶解性-高渗透性药物,原料粒径对产品溶出和体内生物等效具有关键影响。目前国内有针对他达拉非片的制备和体内外评价进行研究[5~6],上述主要研究了处方组成、溶出曲线和 Beagle 犬体内药动学特征,抑或仅对人体生物等效性试验开展研究[7~8],未见对处方工艺、溶出曲线和人体生物等效性的综合研究。因此本研究以 Cialis(规格:20 mg)为参比制剂,对自制品处方工艺进行筛选,并考察二者溶出曲线相似性,最终通过人体内生物等效性研究确定自制品的处方工艺。
1、仪器与材料
1.1 仪器
GF-300A2X 型高效万能粉碎机(上海天祥·健台);J-50 型气流粉碎机(意大利马西姆公司);LHS300 型湿法混合制粒机(浙江迦南科技);ZL450 型门式整粒机(浙江迦南科技);FZG-5 低温真空烘箱(南京飞龙制药);HZD-1000 型自动提升料斗混合机(浙江迦南科技);S250-SMART型 32 冲压片机(山东新马制药);BG-150E 型高效智能包衣机(浙江江南制药);DPR-320G 热带型泡罩包装机(瑞安市江华机械);YD-Ⅱ型片剂硬度测试仪(天津光学仪器);Mastersizer-3000型马尔文粒度仪(英国 Malvern 公司);RC12A 型溶出度仪(天津天大天发);LC-20A 型、LC30AD型高效液相色谱仪(日本 Shimadzu 公司);Quad 6500 型三重四极杆质谱仪(加拿大 Sciex 公司)。
1.2 材料
他达拉非片(Lilly USA,商品名 Cialis,规格 20 mg,批号 C949202),他达拉非(珠海联邦制药),一水乳糖 200M(DMV-Fonterra);微晶纤维素(山东聊城阿华);交联羧甲纤维素钠(德国瑞登梅尔);十二烷基硫酸钠(葛店人福);羟丙纤维素-L(日本曹达,取代度 65%);硬脂酸镁(山东聊城);薄膜包衣预混剂(上海卡乐康);异丙醇、乙腈、正己烷均为色谱纯;其他试剂均为分析纯。
2、方法与结果
2.1他达拉非片的制备
参考俄罗斯药监局公布的礼来公司产品 Cialis(规格:20 mg)药品说明书[9],选择与 Cialis 相同的辅料种类和用量进行样品制备。称取粉碎后原料 70.00 g、交联羧甲纤维素钠 44.10 g、十二烷基硫酸钠 3.43 g 和一水乳糖 858.18 g,混合均匀,另取羟丙纤维素 28.18 g 溶于纯化水中配制成黏合剂溶液,加入至上述完成预混的物料中,湿法制粒,干燥,整粒,再将微晶纤维素 183.75 g、交联羧甲纤维素钠 34.30 kg 和硬脂酸镁 3.08 g 加入干颗粒中,混合 10 min,压片,包衣,即得自制品。
2.2溶出曲线方法
2.2.1溶出条件
参考他达拉非片进口药品注册标准[10],溶出方法选择桨法;转速 50 r·min-1;溶出介质为 0.5%十二烷基硫酸钠溶液,体积 1 000 mL,温度 37.0 ℃。
2.2.2色谱条件
色谱柱填充剂为辛烷基硅烷键合硅胶(250 mm×4.60 mm,5 μm);流动相为 0.1%三氟乙酸溶液:乙腈=55:45(V/V);检测波长为 285 nm;流速为 1.2 mL·min-1;柱温 40 ℃;进样体积 50 μL。
2.2.3 对照品溶液
精密称定他达拉非对照品约 20 mg,置 100 mL 量瓶中,用乙腈 20 mL 超声溶解,用溶出介质稀释成 0.20 g·L-1 的贮备液,摇匀,精密量取 5 mL 置 50 mL 量瓶中,用溶出介质稀释成 20 mg·L-1 的对照品溶液,摇匀。
2.2.4 供试品溶液
取他达拉非片 6 片,按溶出条件进行操作,在各取样点时间分别取溶液 10 mL,滤过,取续滤液作为供试品溶液,并及时补充溶出介质 10 mL。
2.2.5 方法学验证
本色谱条件下他达拉非进样量(X)在 0.105~2.090 μg 范围内与峰面积(Y)线性关系良好,回归方程为 Y=1.689×106X+798,r=1.000 0。取 10、30 min 溶出液配制供试品溶液,分别测定室温放置 0、1、2、3、4、6、8、10、12 h 后样品的峰面积,测定结果 RSD 值分别为 0.10%、0.10%,表明该方法稳定性良好。选择四个浓度(100%、80%、40%、20%)考察回收率(n=3),均值为 100.3%,RSD 值为 0.50%,表明该方法准确度和精密度良好。
2.3 处方工艺考察
他达拉非片为普通薄膜包衣片剂,其活性成分他达拉非的生物药剂学分类(BCS)为Ⅱ类(低溶解性、高渗透性)[3~4],结合欧盟 EMEA 关于他达拉非片科学性论述内容[11],在制备片剂前需对原料进行微粉化处理,再采用湿法制粒工艺进行样品制备。试验初期选择高效万能粉碎(100 目筛)对原料进行前处理。为保证自制品与参比制剂的质量一致性,自制品的辅料种类和用量主要参考俄罗斯公布的 Cialis 药品说明书(20 mg),选择一水乳糖(70.05%)和微晶纤维素(15.0%)为填充剂、交联羧甲纤维素钠(6.4%)为崩解剂、羟丙纤维素(2.3%)为黏合剂、十二烷基硫酸钠(0.28%)为助流剂和硬脂酸镁(0.25%)为润滑剂。本研究在此基础上,以溶出曲线相似性为评价指标,对处方工艺中的黏合剂浓度、片芯硬度、湿法制粒时间和原料前处理方式分别进行考察。
2.3.1黏合剂浓度考察
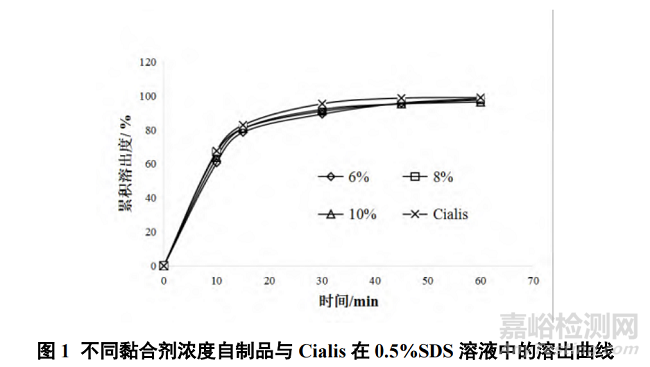
取羟丙纤维素3 份(每份 28.18 g),分别溶于 3 份纯化水(441.49 g、324.07g、253.62 g),配制 6%、8%和 10% 3 个浓度的溶液,参照“2.1”项下方法,将上述 3 份溶液全部用于制备片剂,再按照“2.2”项下方法进行溶出曲线考察,结果见图 1。
在湿法制粒过程中发现,黏合剂浓度为 6%时,水量最多,所制颗粒有部分呈条状;浓度 10%时,水量最少,所制颗粒较少、细粉较多;浓度 8%时,水量居中,制得颗粒外观较为理想,颗粒较多,物料流动性和可压性均良好。3 个浓度(6%、8%、10%)所制片剂与 Cialis 的溶出曲线相似因子 f2 值分别是 61、76、74,均符合溶出相似的要求。综合考虑,选择黏合剂浓度为 8%。
2.3.2片芯硬度考察
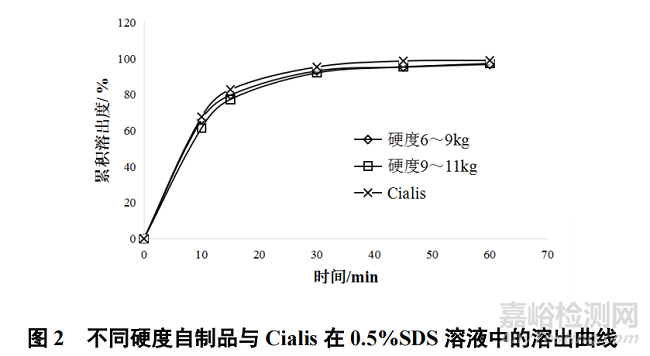
片芯的硬度对片芯的脆碎度、包衣的磨损情况、产品的崩解和溶出行为具有直接影响,为了确定硬度对本品的影响,筛选合理的硬度范围,故对硬度进行了考察,分别按照4~6 kg、6~9 kg 和 9~11 kg 3 个硬度范围进行样品制备,对不同硬度对应的压片情况、脆碎度、包衣情况和溶出曲线进行考察,结果见图 2。
由考察结果可知,硬度 4~6 kg 时,片芯脆碎度相对较高,包衣情况磨损较大,不符合制备要求;硬度 6~9 kg 和 9~11 kg 均符合制备要求,且两硬度范围自制品与 Cialis 的溶出曲线相似因子f2 值分别是 80 和 64,选择与 Cialis 溶出相似度更高的 6~9 kg 作为自制品的硬度控制范围。
2.3.3 湿法制粒时间考察
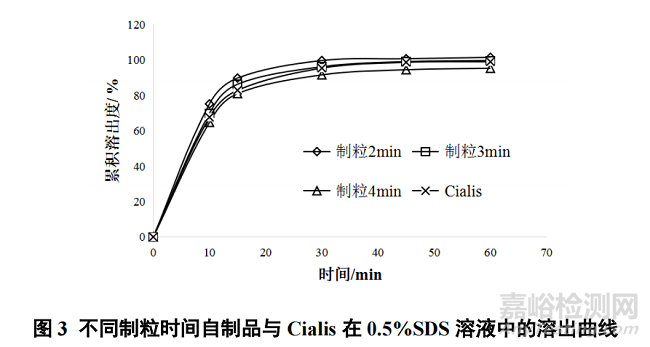
湿法制粒的搅拌制粒时间主要影响所制颗粒的松紧程度,最终影响产品的溶出行为。针对湿法制粒操作,设置湿法混合制粒机参数(搅拌桨Ⅰ速与制粒桨Ⅰ速),分别考察制粒 2、3、4 min 样品的溶出曲线,结果见图 3。
如图 3 所示,随着湿法制粒时间的延长,产品的溶出速率有逐渐降低的趋势。当制粒时间为 2 min时,所制样品与 Cialis 的相似因子 f2值为 59,当制粒时间为 3~4 min 时,所制样品与 Cialis 的溶出行为则具有更好的相似性(f2=80、75),因此选择 3~4 min 作为自制品的湿法制粒时间。
2.3.4 原料前处理考察
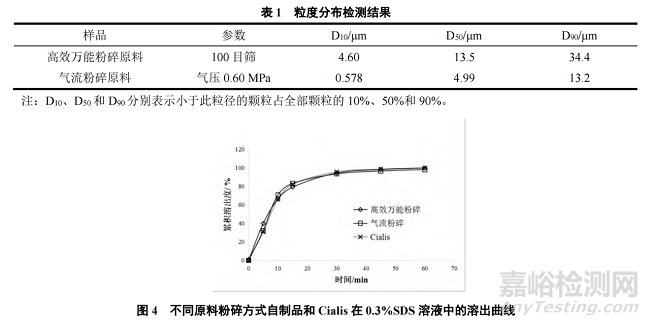
由于他达拉非的生物药剂学分类为Ⅱ类,不仅需要对原料进行微粉化处理,而且需要在溶出介质中添加增溶剂 SDS。为了确认原料粒度的影响,分别采用高效万能粉碎和气流粉碎的方式对原料进行处理。完成样品制备后,为提高溶出曲线区分力,将溶出介质中的增溶剂 SDS 浓度由 0.5%降低至 0.3%进行溶出曲线对比。两种粉碎方式的原料粒度分布结果见表 1,溶出结果见图 4。
由考察结果可知,气流粉碎原料比高效万能粉碎原料粒径更细,且在 0.3%SDS 溶出介质中,采用高效万能粉碎原料制备的自制品与 Cialis 的相似因子 f2值为 63,而采用气流粉碎原料制备的自制品与 Cialis 的相似性更高(f2=76),因此选择气流粉碎作为原料的前处理方式。
2.4 处方工艺确认
根据处方工艺考察结果,选择气流粉碎原料进行中试样品制备(批量:10 万片):称取气流粉碎后原料 2.011 kg(含他达拉非 2.000 kg)、交联羧甲纤维素钠 1.26 kg、十二烷基硫酸钠 0.098 kg和一水乳糖 24.52 kg,混合均匀,另取羟丙纤维素 0.805 kg 溶于 9.26 kg 纯化水中(浓度 8%),加入至上述完成预混的物料中,湿法制粒 3~4 min,干燥至水分≤4.0%后,整粒,再将微晶纤维素 5.25kg、交联羧甲纤维素钠 0.98 kg 和硬脂酸镁 0.088 kg 加入干颗粒中,混合 10 min,压片(片芯硬度控制 6~9 kg),包衣(理论增重 4%),即得自制品。
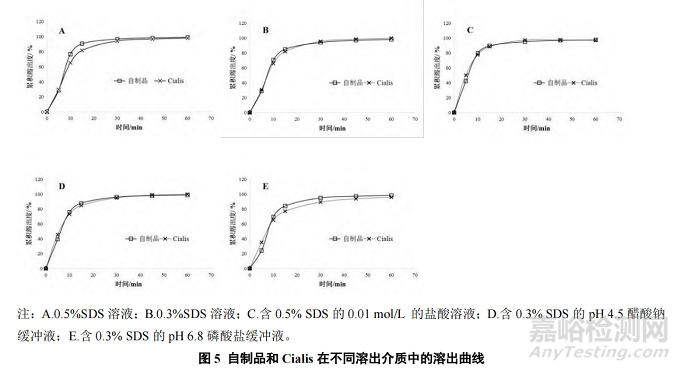
分别测定自制品和参比制剂在 0.5%SDS 溶液(A)、0.3%SDS 溶液(B)、含 0.5% SDS 的 0.01mol·L-1 的盐酸溶液(C)、含 0.3% SDS 的 pH 4.5 醋酸钠缓冲液(D)、含 0.3% SDS 的 pH 6.8 磷酸盐缓冲液(E)5 种溶出介质中的溶出曲线,见图 5。
由考察结果可知,自制品与 Cialis 在上述 A~E 5 个溶出介质中的相似因子 f2 值分别为 58、75、65、70、62,均符合相似要求。
2.5生物等效性研究
为进一步确认自制品与 Cialis 体内药效一致性,选择采用“2.4”项下处方工艺确认批自制品与Cialis 进行空腹条件下给药的人体生物等效性研究。
2.5.1 受试者选择
本研究经东莞康华医院伦理委员会批准。所有受试者均签署了知情同意书。本研究入组10名健康成人男性受试者,年龄为18~45岁,身体质量指数(BMI)在19 kg·m-2至26 kg·m-2之间。
2.5.2 给药方法
采用单剂量、两序列、两周期、自身交叉的试验方案,受试者统一禁食过夜,次日清晨空腹口服 1 片自制品或 Cialis,服药后禁食 4 h,4、10 h 以后统一进餐。
2.5.3 血样采集和处理
分别于给药 0、0.25、0.50、1.00、1.50、2.00、2.50、3.00、4.00、5.00、6.00、9.00、12.00、24.00、48.00、72.00、96.00 h 采集静脉血(每管 4 mL)至已标记好含有 K2EDTA的真空采血管中,轻柔颠倒 6 次混匀,离心 10 min,抽取上层血浆置于 2 个 2 mL 冻存管中,1 h 内转移至-20℃或以下冰箱中暂存,24 h 内转移至-80℃冰箱中储存。
2.5.4 测定方法和样品处理
2.5.4.1 色谱条件
色谱柱 XBridge C18(3.5 μm,4.6mm×50 mm),流动相 A 为含 5 mmol·L-1 甲酸铵和 0.1%甲酸的水溶液,流动相 B 为乙腈:水(90:10,V/V)的混合溶液,梯度洗脱(0.01 min 50%B,1.70 min 50% B,1.80 min 100% B,2.60 min 100% B,2.70 min 50% B)。流速:300 μL·min-1;柱温:30 ℃;进样体积:20 μL。
2.5.4.2 质谱条件
电喷雾离子源(ESI);正离子多反应监测模式(MRM);用于定量分析的离子对为他达拉非 m/z 390.2→268.1,他达拉非-d3(内标)m/z 393.2→271.0,碰撞能量(CE)17 eV;去簇电压(DP)130 V。源参数:喷射电压(IS)3 000 V,离子化温度(Temp)500 ℃,碰撞气(CAD)5 psi,气帘气(CUR)30 psi,喷雾气(Gas1)60 psi,辅助气(Gas2)60 psi。
2.5.4.3 血浆样品处理
在 96 孔板中加入血浆样品 100 μL,内标溶液(他达拉非-d3)50 μL,乙腈300 μL,涡流混匀 10min,离心 10 min(8℃,4 000 r·min-1)。取上清液 200 μL 至另一洁净 96 孔板中,用 300 μL 流动相 B 复溶,取上清液 20 μL 进行 LC-MS/MS 分析。
2.5.5 检测结果
采用 LC-MS/MS 法测定不同时间点血浆中他达拉非的药物浓度,平均血药浓度-时间曲线见图 6。采用 Phoenix WinNonlin 7.0 软件以非房室模型法(NCA)对血药浓度数据进行拟合处理,自制品和 Cialis 的平均药动学参数描述性统计结果见表 2。
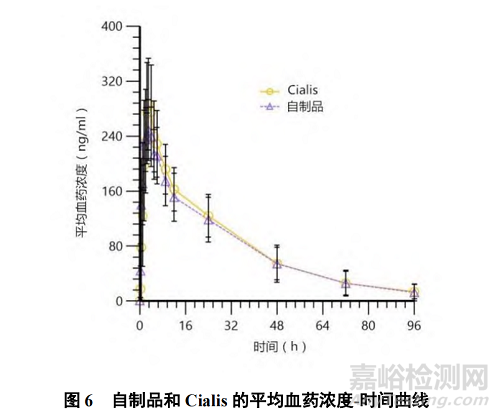
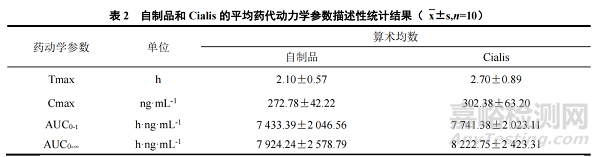
由上述结果可知,自制品与 Cialis 的达峰时间(Tmax)、达峰浓度(Cmax),AUC0-t 和 AUC0-∞均相近。采用 SAS 9.4 软件进行统计分析,采用平均生物等效性评价的方法对自制品和 Cialis 的药代动力学参数进行评价,自制品与 Cialis 的 Cmax、AUC0-t 和 AUC0-∞的 90%置信区间分别为 84.35%~98.00%、86.32%~106.43%和 85.91%~106.89%,均落在可接受范围内(80%~125%),可知自制品与 Cialis 具有生物等效性。
3、讨论
本研究以 Cialis 处方为基础、以体外溶出行为作为评价指标对自制品进行处方工艺筛选。当溶出介质中增溶剂 SDS 浓度为 0.5%时,增溶效果可能会掩盖不同粒径原料所制备的样品的溶出差异。根据 SDS 临界胶束浓度(8.2 mmol·L-1,换算成质量体积分数为 0.236%)[12],在保证增溶效果的前提下,将 SDS 浓度降低至 0.3%,可提高溶出曲线的区分力,有助于筛选出更合理的原料前处理方式。
按照确定的处方工艺进行中试样品制备,所制样品与 Cialis 的体外溶出行为相似,且人体生物等效性研究显示自制品与 Cialis 的 Cmax、AUC0-t 和 AUC0-∞的 90%置信区间均落在可接受范围内(80%~125%),证明自制品与 Cialis 在体内可达到生物等效。
他达拉非片生物等效性研究的样本量需根据试验结果的几何均数比(GMR)和个体内变异系数(CV)等计算。本试验中 CV 最大值为 13.19%,可知他达拉非属于非高变异药物,结合查表法可知,检验效能为 80%时估算样本量为 12 例(未考虑脱落 20%的情况),因此在以后他达拉非片生物等效性研究中,可适当将样本量增加至 12 例以上。
本研究过程中所采用的原料前处理方式、处方工艺、经过调整的溶出方法和生物等效性研究方法,可为他达拉非片的样品研制、体外溶出和体内生物等效性研究提供相应指导。