引言
植入医疗器械产品多面临腐蚀、材料降解、涂层剥离、颗粒脱落等问题,致使金属植入物的离子析出,从而导致人体过量摄入金属离子,引发神经损伤、癌症风险升高等后果。因此金属植入医疗器械的离子释放速率和释放量是评价其临床使用安全性的重要内容。
基于器械原材料本身的性质特点,开展模拟生理环境中发生的植入医疗器械产品金属离子析出试验研究,通过建立金属离子体外释放模型,形成金属离子释放评价的体外试验方法,更好地保证增材制造植入物医疗器械产品的临床使用安全性。
对增材制造技术医疗器械产品进行金属离子析出试验研究,主要包含:毒理学允许限量的建立,浸提条件和时间的确认,方法学开发验证,离子析出含量的测定以及毒理学风险评估。本文据此展开阐述,欢迎留言探讨。
1、研究背景
近年来,增材制造技术(3D打印技术)迅猛发展,在医疗器械中的应用越来越多,例如增材制造可降解镁合金植入物、增材制造椎间融合器、金属增材制造截骨填充融合体、金属增材制造脊柱人工椎体、金属增材制造髋关节骨缺损系统、金属增材制造膝关节骨缺损补块系统等,3D打印医疗器械产品的结构及组成成分也越来越复杂。
3D打印本身的特点决定了除力学性能外,在颗粒残留、离子析出等方面可能存在与常规加工的材料完全不同的性质——这些领域的生物学相关评价成了决定类似器械研发及上市可能性的重点,因此对医疗器械安全性评价的技术要求也越来越高。
医疗器械生物学评价是根据目前现有的科学技术能力和认知水平,对医疗器械在与人体接触使用过程中的潜在危害性进行预估,它是一种综合性的分析评价。
基于《介入类医疗器械产品化学性能要求的说明》和增材制造产品的技术要求和指导原则,如《3D打印人工椎体注册技术审查指导原则》,《3D打印髋臼杯产品注册技术审查指导原则》等,要求对于采用非国家标准/行业标准或国际标准化组织(ISO)发布的标准中规定的金属材料制造的介入类医疗器械产品组件,需要考虑制定有害金属离子析出量的控制指标,如镍、钴、钒、铅等;以及对采用两种或两种以上不同金属材料制造的介入类医疗器械产品组件,当不同金属材料间可能发生相互作用影响到该组件的耐腐蚀性能时,需要在其化学性能要求中考虑制定有害金属离子析出量的控制指标。
增材制造可降解镁合金植入物
△ 图源:中国工程院院刊《Engineering》
同时,现代金属腐蚀学理论认为,金属及其合金的生物相容性主要取决于该材料在环境中金属元素析出的种类和数量级。任何一种人体必需的金属元素,若在人体中的含量过高或过低都可能导致病态。因此,在临床前评价阶段,宜通过建立金属离子体外释放模型,形成金属离子释放评价的体外试验方法,以更好地保证相关产品的临床使用安全性。
金属离子析出研究是指某一医疗器械在特定配置的溶液中 在规定的时间和条件下金属离子的释放。
2、研究方法
2.1金属离子析出原理
引起金属植入物离子析出的因素可能是腐蚀,材料降解,涂层剥离,颗粒脱落等。而腐蚀可能发生在不同的材料表面,如皮肤(有机物)、木材(无机物)、金属(铝、铜)等。由于物质表面发生化学、电化学或其他反应而导致物质变化的过程,是一种化学(电化学)反应;腐蚀也可以是氧化、酸、碱等反应。
植入体内的器械材料浸泡在人体体液中,他们均含有蛋白质、有机酸、碱金属和无机盐,其中Na+, K+, Cl-等离子均是电解质,可使金属产生均匀腐蚀;产品成分不纯,组织不均匀,应力集中或疲劳断裂等因素也可能造成金属植入物腐蚀。
2.2金属离子析出试验研究方法
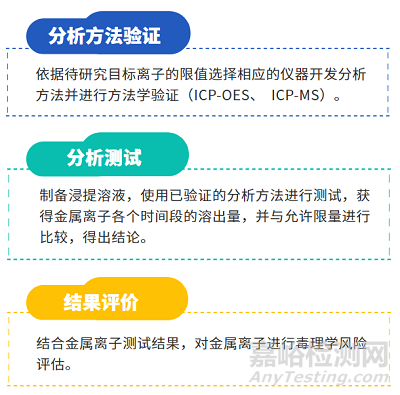
金属离子析出研究和毒理学风险评估依据ISO10993-1、ISO 10993-15、ISO 10993-17、ASTM F3306、YY/T 1823-2022 《心血管植入物 镍钛合金镍离子释放试验方法》和YY/T 1802-2021《增材制造医疗产品 3D打印钛合金植入物金属离子析出评价方法》等进行,项目研究流程图如下:
3、增材制造产品金属离子析出试验研究
3.1金属离子析出试验设计
针对增材制造医疗产品 3D打印钛合金植入物,主要依据YY/T 1802-2021 建立金属离子体外释放模型,重点关注对3D打印钛合金植入物析出的Ti, Al, V, Fe元素离子进行定量分析研究。
根据产品的特点选择不同取样时间点进行取样分析,并依据完整的方法学验证和测试Ti, Al, V, Fe元素析出含量并对其进行毒理学的风险评估。
通常试验条件设计主要有以下几个因素:浸提样品(有接触风险的部件);浸提方式(模拟使用浸提);浸提介质(pH=7.4的Hank’s人工模拟体液 );浸提体积(重量、临床使用);浸提条件(时间、温度等);振荡频率等。
3.2试样样品的要求
依据标准要求,推荐使用标准样件,即:

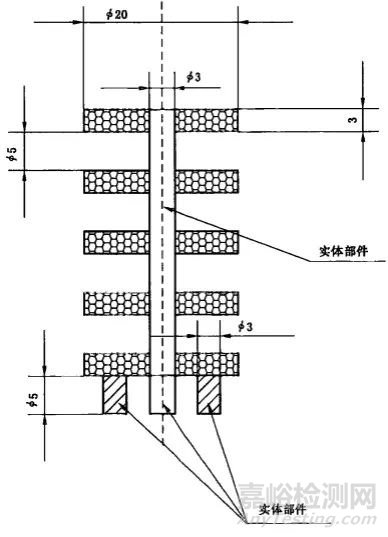
测试用多孔钛合金样品剖面示意图
4、研究总结
增材制造技术(3D打印技术)的产品种类多,应用也广泛。针对增材制造椎间融合器、金属增材制造截骨填充融合体、金属增材制造脊柱人工椎体、金属增材制造髋关节骨缺损系统、金属增材制造膝关节骨缺损补块系统等产品金属离子的析出试验,通过毒理学风险评估建立Ti, Al, V, Fe元素的允许限量(AL),进而根据金属离子析出试验的ICP-MS的测试结果,计算产品的估计暴露量,从而确定产品的毒理学风险是否可接受。
另外,增材制造产品的规格型号千差万别,需要结合产品实际的规格型号和预期使用的解剖学位置进行综合的评估:
一般情况下,推荐使用标准样件进行金属离子析出试验;
当增材制造的产品规格或者潜在的接触表面积远远大于实际人体组织部位时,建议在进行金属离子析出试验时,推荐使用产品最大规格型号进行金属离子析出试验,确保对产品的安全性风险进行全面综合的评估。
【参考文献】
[1] ISO 10993-1, Biological evaluation of medical devices Part 1: Evaluation and testing within a risk management process (2018).
[2] ISO 10993-12, Biological evaluation of medical devices-Part 12: Sample preparation and reference materials (2012).
[3] ISO 10993-15:2019,Biological evaluation of medical devices — Part 15: Identification and quantification of degradation products from metals and alloys
[4] ISO 10993-17, Biological evaluation of medical devices Part 17: Establishment of allowable limits for leachable substances (2002)
[5] ISO 10993-18, Biological evaluation of medical devices-Part 18: Chemical characterization of medical device materials within a risk management process (2020).
[6] ICH Q2 (R2) Validation of analytical procedures: Text and Methodology.
[7] ICH Q3D(R2), Guideline for elemental impurities.
[8] ChP<0412>, Inductively Coupled Plasma Mass Spectrometry (2020).
[9] ChP<9101>, Guideline for analytical methods of pharmaceutical quality standards (2020).
[10] USP <232> Element Impurities-Limits
[11] USP<233>Element Impurities-Procedure
[12] ASTM F3306-19 Standard Test Method for Ion Release Evaluation of Medical Implants.
[13] YY/T 1802-2021《增材制造医疗产品 3D打印钛合金植入物金属离子析出评价方法》
[14] YY/T 1823-2022《心血管植入物 镍钛合金镍离子释放试验方法》
[15] T/CSBM 0011-2021 医用钛合金植入物金属离子析出评价方法