荧光显纳技术提供了克服光学显微镜中衍射极限分辨率障碍的成像技术,开辟了生物医学成像研究领域(尤其在神经科学领域)。与传统显微镜不同,荧光显纳镜提供了一种实现基因组规模成像的有前景的方法,可以产生细胞行为和功能的分子基础全景图;同时结合光学方法、精确建模和对大脑深处神经活动的操纵等手段,荧光显纳技术将继续推动神经科学的发展。
中国工程院外籍院士顾敏等研究人员在中国工程院院刊《Engineering》2022年第9期发表《荧光显纳镜在神经科学中的应用》一文,详细介绍了荧光显纳技术的应用进展,描述了其在阐明蛋白质结构和流动性、神经活动过程中涉及突触参数的实时测定、三维成像和纳米级神经活动跟踪等方面的应用。文章还讨论了荧光显纳镜的发展前景,特别关注其在神经科学中与相关技术(如机器学习)的结合方面的未来发展方向。
一、引言
神经科学的范围包括对神经系统结构及其在产生行为中的功能的科学研究。从宏观的角度来看,神经系统包括分布在大脑中许多离散解剖位置的神经元和回路,并服务于三种功能之一:感觉、运动和联想。在纳米尺度上,相关突触蛋白的组织对于神经元过程的稳定性和功能至关重要,比如神经元信号传递。例如,在化学突触的信号传递过程中,由动作电位(AP)到达引起的突触前Ca2+浓度升高(与突触拮抗素相关)导致神经递质释放,接着可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体(SNARE)复合物将两个膜结合在一起。精细的基于蛋白质的细胞基质在释放过程中起着重要作用。网格蛋白还参与囊泡从质膜的内吞出芽。
除了蛋白质流动性外,蛋白质分布在神经元信号转导中也发挥着不同的功能作用。例如,突触以兴奋性突触后电流(EPSC)或抑制性突触后电流(IPSC)形式传递的信息在轴突的前端处被整合和“读出”。此外,EPSC模型反映了易于释放池的初始大小及其从储备池中的补充率、突触小泡(SV)释放的概率和突触易化。轴突具有独特的细胞骨架,其中包含肌动蛋白和血影蛋白等蛋白质,以及影响其功能完整性的相关蛋白质。膜相关周期性骨架(MPS)可能影响轴突中AP和其他信号通路的产生和信号传播。
荧光显微镜是生物学领域最流行的成像技术,因为它在使用荧光标记的分子特异性标记方面具有优势,并且具有实时成像能力。由于光的衍射极限,使用传统的光学显微镜无法在纳米级解析蛋白质迁移率和亚细胞结构,如突触。近年来,已经出现了几种形式的荧光显纳镜,它们的成像分辨率是传统荧光显微镜的2~100倍。荧光显纳技术提供了一种功能强大的新型成像工具,其分辨率与电子显微镜相似;同时,它具有适合研究亚细胞结构和生物过程的一定优势,包括活细胞、多色、实时和三维(3D)分子成像,以及跟踪能力。结合其他尖端技术,荧光显纳技术为更好地了解神经元、神经元回路以及最终神经系统的功能提供了一条途径。
在本文中,我们总结了几种荧光显纳镜技术:结构光照明显微镜(SIM)、受激发射损耗(STED)显微镜、随机光学重构显微镜(STORM)/光敏定位显微镜(PALM)和最小辐射通量(MINFLUX)显纳镜,它结合了STED显微镜和STORM。然后,我们从分子和细胞神经科学的角度讨论这些技术的高级应用。最后,我们总结荧光显纳镜在神经科学中的前景。
二、荧光和衍射极限
(一)荧光原理
荧光团是一种可以吸收“基态”光子的荧光化合物,在“激发态”导致荧光发射和振动弛豫。从基态到激发态的转变非常迅速(超过飞秒)。了解发射和吸收过程的最有用的方法之一是Jablonski图(图1)。单重态是由在单个状态内具有相反自旋的电子的磁矩抵消引起的。三重态的寿命相对较长。S0表示基态,S1和S2表示激发单重态。S2是比S1高的能态,而S0是比S1低的能态。
图1. Jablonski图说明荧光分子内的能量状态。S0是基态;S1和S2是激发单重态;T0和T2分别是三重态。
由于荧光的斯托克斯位移,即发射光的波长相对于吸收光的红移波长,荧光显微镜中的信噪比之间的对比度得到了显著改善。此外,荧光显微镜的基本原理,即用激发波长照射染色样品并在更长的发射波长上检测其荧光信号,很容易理解。
(二)衍射极限的影响
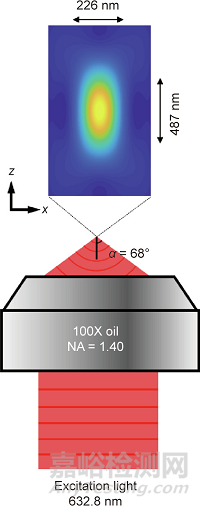
光学显微镜可以被视为一种透镜系统,可用于观察样本中的精细结构。由于光的衍射,因此3D点扩散函数(PSF)具有有限的大小。基于空间中的相长干涉,PSF 的半高峰宽(FWHM)∆r≈λ/(2n×sinα)位于焦平面内,并且Δl≈λ/(n× sin2α)沿光轴。在这里,λ、α和n分别表示光的波长、物镜的孔径角和浸没介质的折射率;∆r是PSF在横向上的FWHM;Δl是PSF在轴向上的FWHM。如图2所示,当使用可见光(λ=632.8 nm)和数值孔径(NA)为1.40(NA=n ×sinα)的油浸物镜成像时,PSF的横向尺寸约为226 nm,PSF的轴向尺寸约为487 nm。光的衍射极限导致无法解析的分子结构,因此细胞的纳米级基本机制仍然不可见。
图2. NA = 1.40油浸物镜的PSF。激发波长为632.8 nm。
三、荧光显纳技术
自20世纪中叶以来,已经引入了几个概念,包括共焦荧光显微镜和多光子显微镜,以减少离焦荧光背景和光学断层成像的能力。原则上,与传统荧光显微镜相比,共聚焦荧光显微镜将空间分辨率提高倍。实际上,由于探测器尺寸有限,它们是相同的。共焦单光子和双光子荧光显微技术提供几乎相同的分辨率。通过扩展照明或探测波前,4Pi显微镜可以在固定细胞中实现80~150 nm的横向分辨率。基于莫尔效应,SIM将高频特征转换为低频特征,进而被显微镜探测到。SIM提供了100~120 nm的横向分辨率和约300 nm的轴向分辨率。然而,分辨率仍然受到衍射极限的限制。
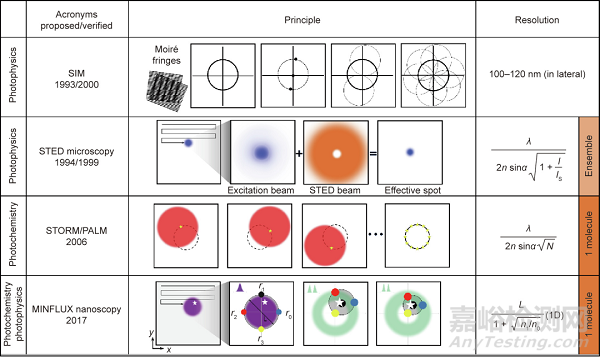
荧光团光物理和光化学方面,取得最显著突破的技术是STED显微镜和STORM/PALM,这两种技术都通过依次读取衍射区的分子荧光特征来打破衍射屏障。具体来说,读出标记是指提供“明亮状态”的信号,同时将其他标记保持在“黑暗状态”。最近,结合这两种技术的优势,MINFLUX显纳镜为生物学研究提供了更强大、更通用的成像工具,在固定细胞和活细胞中实现了1~3 nm的分辨率。图3显示了SIM、STED显微镜、STORM/PALM和MINFLU显纳镜的成像原理。与STORM/PALM类似,MINFLUX显纳镜只对单个(或至少可识别的)分子进行成像。换句话说,与MINFLUX显纳镜和STORM/PALM不同,STED显微镜主要读取荧光基团,依赖于暗态和亮态之间的可逆转换。
图3. SIM、STED显微镜、STORM/PALM和MINFLUX显纳镜的工作原理和分辨率。使用正弦照明模式,在傅里叶域中SIM可以恢复正常观察区域大小两倍的信息。换句话说,SIM在空间域(100~120 nm)中获得两倍的正常分辨率。典型的单点扫描STED显微镜使用环形STED光束(橙色)淬灭激发光束(蓝色)。PALM和STORM随机读取单个分子。N >> 1光子允许对衍射点内的单个分子进行质心计算。紫色斑点表示给定目标(白星)范围的衍射点。使用可调环形光束,目标坐标图案包括四个指定坐标(显示为黑色、红色、黄色和蓝色圆圈)。I:“STED光束”的峰值强度;IS :荧光基团的饱和强度;N:荧光基团位置的光子数;L:圆环图案大小;n0和n1是在分别在圆环位置r0和r1处荧光光子计数;1D:一维;r0、r1、r2和r3分别是甜甜圈位置。
(一)结构光照明显微镜
结构光照明显微镜(SIM)使用图案照明场,结合光学操作和计算算法来获得光学断层成像并促进 3D成像。在空间域中,在线性不变光学系统中观测数据可以表示为发射物和点扩散函数(PSF)H卷积:D(r) =E(r)⊗H(r),其中,r是定位位置。相比之下,卷积可以在傅里叶域中表示为逐点乘积,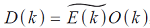 ,其中,O是光学传递函数(OTF),k是空间频率。OTF定义了显微镜可以探测到的空间频率或可观察区域。如图3所示,使用具有不同相位和方向的周期性照明图案的总和,可以在横向和轴向方向上提高所重建的发射物图像的分辨率。
,其中,O是光学传递函数(OTF),k是空间频率。OTF定义了显微镜可以探测到的空间频率或可观察区域。如图3所示,使用具有不同相位和方向的周期性照明图案的总和,可以在横向和轴向方向上提高所重建的发射物图像的分辨率。
(二)受激辐射损耗显微镜
在20世纪90年代,提出了受激辐射损耗(STED)显微镜的概念,在远场中使用传播光和常规透镜。使用时序图案照明,是确定亮标记坐标的最直接方法。该技术可以被视为可逆饱和光学线性荧光跃迁(RESOLFT)。除STED显微镜外,RESOLFT指基态耗尽显微镜。如图3所示,基于共聚焦显微镜配置,荧光标记由聚焦的激发光束激发。在荧光团的自发衰减中,激发光束和STED显微镜光束的重叠会产生亚衍射点。STED显微镜的实际分辨率为 。在这里,I是“STED光束”的峰值强度,Ιs是荧光团的饱和强度。为了提高分辨率,由螺旋空间相位调制器或涡旋相位板产生的红移环形STED光束的强度必须满足Ι>Is。换句话说,STED显微镜的分辨率仅由STED光束决定。通过增加STED光束的强度,有效光斑的直径被限制在20 nm的横向分辨率。尽管如此,为了避免光漂白,必须采用合适的染料和自适应照明技术。
。在这里,I是“STED光束”的峰值强度,Ιs是荧光团的饱和强度。为了提高分辨率,由螺旋空间相位调制器或涡旋相位板产生的红移环形STED光束的强度必须满足Ι>Is。换句话说,STED显微镜的分辨率仅由STED光束决定。通过增加STED光束的强度,有效光斑的直径被限制在20 nm的横向分辨率。尽管如此,为了避免光漂白,必须采用合适的染料和自适应照明技术。
(三)随机光学重构显微镜/光敏定位显微镜
与STED显微镜中选择的坐标相比,在随机光学重构显微镜(STORM)、光敏定位显微镜(PALM)和纳米尺度点累积形貌成像(PAINT),单个荧光分子从随机坐标中读出(图3)。使用宽视场照明,打开或激活单个分子。下一个活化分子与前一个活化分子的距离为λ/2n。分子的重复激发在相机上形成一个放大的衍射点。然后通过用于切换和非切换荧光团的暗-亮-暗状态机制逐个分子组装图像。检测到的光子能够定位点的质心位置并确定分子的横向位置。STORM/PALM的光学分辨率约为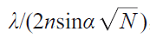 ,其中,N是荧光团位置的光子数。值得一提的是,高质量的STORM图像要求荧光团具有每次切换事件的高光子产量、低开关占空比、高存活率和多个切换周期。在这些特性中,低开关占空比可以最大化荧光密度,这等同于实现奈奎斯特标准允许的最大成像分辨率。然而,激活光不会改变每个开关事件检测到的光子数。
,其中,N是荧光团位置的光子数。值得一提的是,高质量的STORM图像要求荧光团具有每次切换事件的高光子产量、低开关占空比、高存活率和多个切换周期。在这些特性中,低开关占空比可以最大化荧光密度,这等同于实现奈奎斯特标准允许的最大成像分辨率。然而,激活光不会改变每个开关事件检测到的光子数。
(四)最小辐射通量显纳镜
2017年,Stefan Hell实验室提出了一种名为最小辐射通量(MINFLUX)显纳镜的定位概念。这种技术将结构光照明与单分子特征(如在STORM/PALM中)相结合,以获得目标分子的坐标(如在STED显微镜中)。MINFLUX纳米显微镜具有先进的3D多色分子成像和跟踪功能,可在可扩展的视场(FOV)中获得迄今为止未实现的个位数纳米精度和大约100 µs时间分辨率。如图3所示,MINFLUX显纳镜采用可移动的激发光束,其中心的强度最小。该最小值用作参考坐标,发射光子的数量随着接近荧光团而减少。因此,与STED显微镜和STORM/PALM不同,MINFLUX显纳镜不需要大量的光子。
MINFLUX显纳镜装置包括一个在大约400 nm激活区域内激活荧光团的激活光束和一个定位或跟踪分子的激发光束。对于每个定位,首先聚焦光束;然后,一个调制的二维(2D)或3D甜甜圈图案,具有逐渐缩小的直径(L),在焦平面(x, y)或体样品(x, y, z)中利用最大似然估计来定位或跟踪分子。在一维中,定位的最小标准偏差,即区域L内的Cramer-Rao界(CRB)是 ,其中,σ是定位位置,N=n1+n0是在甜甜圈图案中不同位置(r0 和r1)处检测到的光子数。在激活区域内,仅N=600的光子数可以预期一维精度为(σ-1) nm。因此,MINFLUX纳米显微镜的迭代精度超过了基于量子CRB(QCRB)的相机定位的横向精度。
,其中,σ是定位位置,N=n1+n0是在甜甜圈图案中不同位置(r0 和r1)处检测到的光子数。在激活区域内,仅N=600的光子数可以预期一维精度为(σ-1) nm。因此,MINFLUX纳米显微镜的迭代精度超过了基于量子CRB(QCRB)的相机定位的横向精度。
除了直接克服光的衍射极限的荧光显纳镜之外,扩展显微镜(ExM)可以通过组织和器官标本的物理放大,即使使用传统的衍射极限显微镜,也可以实现纳米级3D成像。在过去的几年中,已经提出了各种ExM方案,用于蛋白质和核糖核酸(RNA)的高分辨率成像,或用于人类临床标本。为了实现各向同性样品膨胀,生物分子和(或)标记首先自发耦合到聚合物网。然后将样品均质化并膨胀。ExM的分辨率可以通过使用基于水溶液的CUBIC-X进行两轮扩展达到亚细胞水平。
四、荧光显纳技术的成像能力
在过去的几十年里,荧光显纳技术已经越来越适合对亚细胞动力学和结构的生命系统进行3D、多色和纳米级分辨率的成像。以商业STED显微镜为例:STEDINFINITY [Abberior Instruments (AI),德国]线在2D和3D中可以分别达到小于20 nm×20 nm和小于70 nm×70 nm×70 nm的横向分辨率。再加上100×物镜,FOV为80 µm × 80 µm。使用QUADScanner [Abberior Instruments (AI),德国],对于512像素×512像素图片,行频最高可达2.6 kHz,数据采集速度可达每秒4.2帧。使用自适应光学可以在果蝇幼虫等复杂样品内实现高达100 µm的成像深度。为了减少光漂白和光毒性,具有Dymin成像模式的STED显微镜同时将光剂量最小化并将信号增强一个数量级。
空间和时间分辨率之间的权衡在高分辨率成像技术中是不可避免的,尤其是在荧光显纳镜中。STED显微镜可以毫秒的时间分辨率对相对较小的FOV进行成像。配备快速切换染料和快速互补金属氧化物半导体(CMOS)相机,STORM可以在约20~30 nm空间分辨率下实现亚秒级时间分辨率,用于活细胞成像中的大FOV。此外,在STED显微镜和STORM/PALM中,光漂白和(或)光毒性可以大大降低。凭借其低光毒性,图案化激活非线性SIM(PA NL-SIM)在具有数十个时间点的大FOV上展示了具有大约60 nm的空间分辨率和亚秒级时间分辨率的活细胞成像。在MINFLUX纳米镜中,超精确的2 nm空间分辨率和100 kHz时间分辨率可以通过其最小的光子预算(即固定和活细胞的低光漂白/光毒性)和可扩展的FOV来实现。
五、荧光显纳技术在神经科学中的应用
尽管荧光显纳技术在活性区(AZ)中提供了非常精细的结构信息(如密集蛋白质的亚细胞区室),但不同分子结构的特定生理特性仍然是一项重大挑战。荧光显纳镜主要用于研究结构(如MPS和蛋白质的功能),特别是在终端棒头中[如突触前AZ和突触后密度(PSD)]。由于组织和光的特性,动态、活细胞和体内深部组织成像仍然具有挑战性。由于STED显微镜提供活细胞跟踪功能,因此动态揭示了神经元传递过程中的突触融合。
(一)突触中蛋白质的空间组织
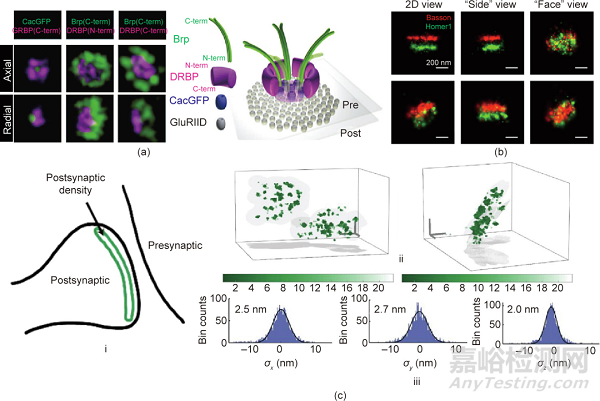
基于蛋白质的细胞基质在AZ(CAZ)中对于促进SV释放过程至关重要。Rab亚科Rab3相互作用分子(RIM)结合蛋白(RBP)是AZ支架的引物效应子。因此,RBP家族对于果蝇中SVs、Ca2+通道和SV融合机制的耦合是必不可少的。双色STED显微镜已证明基于RBP的细胞基质在控制易于释放的SV数量方面具有直接作用。如图4(a)所示,果蝇RIM结合蛋白(DRBP)围绕着中央Ca2+通道。DRBP对于AZ支架的完整性和神经递质的释放至关重要。此外,根据直接STORM技术,CAZ包括含有137个Bruchpilot (Brp)蛋白的单元。这些单位的组织涉及与不同的神经传递释放概率相关的各种AZ状态。
图4. 突触蛋白结构的纳米成像。(a)左图:在果蝇神经肌肉接头突触处包含DRBP、Brp和电压门控Ca2+通道杂音(CaC)的突触前AZ的3D STED图像。右图:倾斜视图中的AZ模型。DRBP:果蝇RIM结合蛋白;Brp:Bruchpilot;GFP:绿色荧光蛋白;CacGFP:GFP标记的Ca2+通道;GluRIID:谷氨酸受体亚基。(b)突触的3D STORM图像。(c)PSD-95的MINFLUX纳米显微镜成像,3D分辨率约为2~3 nm:(i)突触后PSD-95草图;(ii)PSD-95呈簇状分布在曲面上;(iii)各向同性3D定位精度为2.0~2.7 nm的单个荧光团。PSD-95:突触后密度蛋白95。
在神经传递过程中,SV在AZ膜内融合以响应Ca2+流入。在核心融合复合物中,有SNARE蛋白、囊泡成分和AZ特异性蛋白,所有这些都有助于SV和膜对接与融合。STED显微镜已用于可视化SNARE蛋白突触蛋白、不清楚的蛋白SC35和烟碱乙酰胆碱受体。
支架蛋白如突触后密度蛋白95(PSD-95)、鸟苷酸激酶相关蛋白、浓缩蛋白Shank3和Homer是PSD的主要成分。STORM和PALM成像都绘制了突触前和突触后末端蛋白质的空间组织图,包括突触前支架蛋白的方向、PSD的层状组织和神经递质受体的横向分布。图4(b)显示了突触前巴松管(红色)和突触后Homer1(绿色)的轴向和径向3D STORM图像。应该注意的是,PSD-95在突触后膜中的谷氨酸受体锚定和重新排列方面起着至关重要的作用。例如,使用STED显微镜结合内源性蛋白质标记,PSD-95经常出现在扩展分布中,而不是作为孤立的纳米簇。最近,MINFLUX纳米技术表明PSD-95沿着边长为100~400 nm的略微弯曲的表面分布,如图4(c)所示。
(二)轴突的细胞骨架结构
轴突中的MPS最初是使用STORM发现的。据观察,由短肌动蛋白丝构成的肌动蛋白被组织成重复的环状结构作为轴突束。相邻的肌动蛋白环由血影蛋白四聚体连接,形成长程准一维周期结构。这种结构形成于轴突膜下方,周期约为180~190 nm。然而,使用MINFLUX纳米显微镜的研究人员最近发现,在空间分辨率小于2 nm时,MPS类似于轴突中的周期性螺旋结构。此外,使用STED显微镜和STORM,观察到树突中的MPS。然而,树突中MPS的形成倾向和生长速度似乎低于轴突中的。此外,在胞体、树突和Ranvier的节点中观察到由MPS成分形成的二维多边形晶格结构。换言之,神经元中MPS的结构需要进一步阐明,以破译其促进或协助AP产生和传播的功能,目前尚不清楚。
(三)囊泡融合的时间动力学
众所周知,CAZ提供了一个在神经传输和通信过程中释放SV的功能平台。然而,在STED显微镜发明之前,囊泡运动的原理是难以捉摸的,这使得海马神经元中SV的运动能够被跟踪。突触结合蛋白用偶联的抗体标记Atto 647 N(ATTO-TECGmbH,德国),最终图像的空间分辨率为62 nm,显示面积为1.8 μm × 2.5 μm,每秒28帧。这表明囊泡不断结合,然后以类似于“粘连扩散”模型的方式从细胞器中扩散出去。此外,IsoSTED显微镜已被用于在两个内吞作用和胞吐作用周期中跟踪囊泡,表明相同的囊泡用于自发和受刺激的神经递质释放。然而,囊泡运输的潜在机制仍然未知。STED显微镜还从单个SV中分离出突触结合蛋白I,这些SV在囊泡融合时形成孤立的簇。通过用绵羊抗小鼠Atto 532染料标记突触结合蛋白,STED显微镜实现了更高的分辨能力,用于对SV及其密集的分子货物进行成像。此外,在融合过程中,突触结合蛋白仍然聚集在囊泡内。也就是说,它在胞吐作用后不会扩散到质膜。
(四)3D纳米级神经元成像
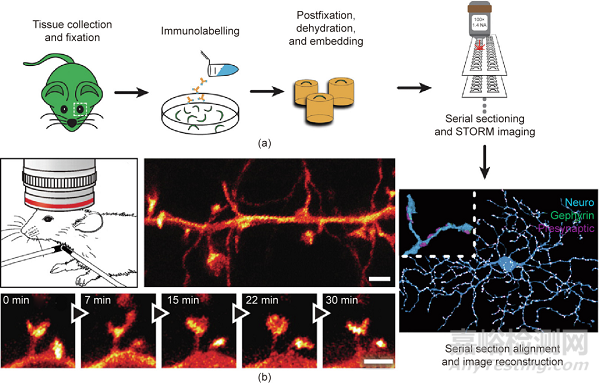
荧光显纳技术已经为具有纳米级空间分辨率的神经回路成像铺平了道路。使用STORM,视网膜神经节细胞的神经元结构映射已在三个维度上投影,在神经回路尺度上提供突触连接。在图5(a)中,使用STORM对视网膜神经节细胞(蓝色)、突触后支架蛋白 gephyrin(绿色)和突触前蛋白(洋红色)进行成像。使用STED显微镜,在体内观察小鼠体感皮层分子层的增强型黄色荧光蛋白(eYFP)标记的神经元的树突和轴突结构;精细神经结构的投影体积和脊柱形态的时间动态以67 nm的空间分辨率显示[图5(b)]。此外,通过结合贝塞尔光束SIM(BB-SIM)和组织清除方法,可以在整个成年果蝇大脑中识别单个mRNA(SmFISH)的定位和丰度。
图5. 离体和体内神经元的纳米成像。(a)视网膜神经节细胞的样品制备和离体STORM成像。最终图像的插图(右下)显示了树突部分的放大视图。(b)小鼠体感皮层的体内STED成像。
六、未来研究方向
(一)MINFLUX显纳镜
有时被称为“诺贝尔后”荧光显纳技术,MINFLUX显纳镜已经为了解固定细胞和活细胞中神经元的蛋白质结构和功能开辟了一条新的研究途径。MINFLUX显纳镜的一个潜在应用是确定突触参数和可视化突触可塑性。确定突触参数需要在囊泡融合或神经递质释放期间使用纳米空间分辨率和微秒时间分辨率进行量化建模。持续数小时或更长时间的长期变化为学习和记忆提供了生理基础,而短期变化则发生在几毫秒到几分钟的时间段内。MINFLUX显纳镜提供超高时空分辨率以及长期活细胞跟踪和成像能力,可实现精确的突触参数建模和具有低光毒性的突触可塑性可视化。此外,结合通过物理样本扩展方法(ExM)进行的高分辨率成像,可以实现荧光显纳镜的空间分辨率的多倍增加,尤其对MINFLUX显纳镜。
(二)荧光生物偶联物
荧光显纳技术的性能与荧光探针的光学特性密切相关。例如,一种名为“quick-SIMBA”的具有高时空分辨率的纳米技术已经使用一种新的光可转换荧光蛋白(FP)pcStar开发出来,并已被用于发现神经元的特定“平行三柱”结构在果蝇胚胎中的胶质细胞连接。除了内源性荧光探针,即FP,正在开发新的外源性探针,以增加图像亮度,提高空间分辨率,并增强荧光显纳技术中标记的特异性,包括小分子有机染料、量子点、聚集诱导发射纳米粒子、聚合物点和上转换纳米粒子(UCNP)。开发尺寸更小、效率更高的新型荧光探针生物偶联物,有可能进一步提高荧光显纳技术的成像分辨率。此外,利用染料标记的脱氧核糖核酸(DNA)探针的随机结合,DNA-PAINT在DNA折纸纳米结构上实现了相似的图像分辨率。值得一提的是,可交换荧光基团已成功用于STED,如STED-PAINT。
(三)基因组成像
神经元的正常功能是基于多种分子的集体作用。然而,荧光团之间的光谱重叠限制了可以同时测量的分子种类的数量。最近开发的基于多重荧光原位杂交(FISH)的基因组规模成像技术极大地增加了可以同时成像并具有一定容错性的分子种类的数量。例如,在标记RNA分子的过程中,可以将一个特殊设计的多位二进制字编码到荧光探针中,可以根据码本进行探测。单细胞转录组成像方法通过原位测序和FISH实现了单个细胞中1000多个基因的成像和多路复用。这些技术与荧光纳米显微镜的结合可能会在分子水平上为神经元的结构和功能提供新的见解。
(四)光学工具和其他相关成像技术
1. 光遗传学
荧光显纳镜是研究神经元内部和神经元之间动态过程的重要工具,它涉及对大脑中特定细胞的快速和精确控制,同时不改变其他细胞。电极精度不够高,药物作用太慢。光遗传学是一种结合遗传和光学方法来激活或抑制活组织特定细胞中明确生理活动的技术。然而,可见光的穿透深度受到内源发色团的强烈散射的限制。近红外(NIR)光在生物组织中具有更深的穿透深度,但其波长位于光遗传学窗口之外。UCNP可以将低能入射NIR光子转换为高能可见发射,并且可以调整光谱以适应不同的光激活通道。将荧光显纳镜与UCNP介导的光遗传学相结合,为大脑深处受控神经元活动的侵入性研究提供了令人兴奋的可能性。
2. 神经元样结构的直接激光写入
我们可以打印大脑吗?这是一个有趣的问题。然而,大脑的复杂性超出了传统制造技术的能力。结合直接激光写入,荧光显纳技术可以促进仿生光子芯片的发展,从而更接近地模拟大脑功能。双光子直接激光写入已经产生了具有亚微米特征的各种拓扑结构的3D仿生神经元结构,而双光束激光写入可以制造特征小至9 nm的结构。
3. 相关成像技术
AP的测量在神经科学中具有重要意义。目前,使用膜片钳的电生理学是测量单个AP的金标准。然而,尽管它具有出色的时间分辨率和良好的信噪比,但空间分辨率仅限于大约10 µm。氮空位(NV)中心的光致发光随AP在称为光学检测磁共振(ODMR)的过程中传播产生的磁场而变化。这可以在环境条件下实现生物系统中的高分辨率磁场感应。例如,已经使用ODMR证明了在单个神经元和完整生物体中检测AP。通过结合荧光使用ODMR进行纳米镜检查,可以在纳米级空间分辨率下可视化和测量具有突触强度变化的AP。
成像深度主要受到可见光范围内的强光吸收和散射的限制,因此即使在小动物中,也很难从大脑更深层次解析图像。解决这个问题的直接方法是通过插入梯度指数(GRIN)透镜或纤维镜或使用微棱镜来访问目标深层区域。例如,可以使用微棱镜对组织的垂直横截面进行成像。GRIN透镜已用于对深部脑组织成像,包括海马、下丘脑、丘脑和CA1海马中的树突棘等精细结构。这些技术的空间分辨率是有限的;因此,结合荧光显纳镜可以帮助实现全尺度的深部脑成像。
为了通过减少光吸收来提高穿透深度,多光子显微镜(MPM)使用更长波长的激发。三光子荧光的成像深度已被证明是小鼠脑组织表面以下5~6个有效衰减长度,对于755 nm激发,其约为130 µm。此外,已经使用具有1280 nm激发的双光子荧光实现了小鼠大脑表面下方1.2~1.6 mm的成像深度。相干拉曼散射(CRS),如受激拉曼散射(SRS)和相干反斯托克斯拉曼散射,是另一种用于深层组织成像的MPM技术。SRS已被用于检测和成像在亚细胞和多神经元尺度上的膜电位分布并在神经肌肉接头处成像神经递质乙酰胆碱。尽管CRS的空间分辨率受到光衍射的限制,但基于尖端增强CRS、CRS的抑制或饱和以及高阶非线性过程的方法已经被开发来解决这个问题。未来CRS的发展可能会实现纳米尺度的成像,并提供与荧光显纳技术互补的信息。
除了光吸收之外,光散射是限制成像深度的另一个问题,因为它会在成像过程中引入像差。自适应光学(AO)使用有源器件,如可变形反射镜和液晶空间光调制器(SLM),来补偿波前失真,可以直接测量或间接测量。AO已应用于单分子定位显微镜(如PALM和STORM)、SIM和STED显微镜,从而显著提高了定位精度、图像清晰度和亮度。预计对AO的新研究将继续促进荧光显纳技术的进步,包括MINFLUX纳米技术。
机器学习(ML)和荧光显纳技术的结合提供了另一个研究方向。最近,ML已通过散射介质应用于光学成像,这可能对深部脑成像有用。ML还被用于加速STORM中的数据处理并提高成像的空间分辨率。此外,ML可以与光学数字化全息(ODH)相结合,以实现对激发场矢量的按需定制,这可以提高荧光显纳技术的灵活性。随着光子忆阻器的发展,其中光学特性根据透射光而变化,可以制造动态ODH用于全光神经形态计算和高速纳米成像。
七、结论
荧光显纳技术研究在过去的几十年中发展迅速,有望推动荧光探针和标记方法的进一步发展,以实现超高分辨率成像,同时降低所需的光子预算和样品的光毒性。与传统显微镜不同,荧光显纳显微镜提供了一种实现基因组规模成像的有前景的方法,这将产生细胞行为和功能的分子基础的全景图。结合其他光学方法、精确建模和对大脑深处神经活动的操纵,荧光显纳技术将继续彻底改变神经科学。MINFLUX显纳镜将实现体内成像和神经活动跟踪,以进一步量化具有纳米空间分辨率和微秒时间分辨率的突触参数。基于ML的荧光显纳技术有可能在神经科学领域实现前所未有的应用发展。由于其巨大的前景,所有形式的荧光显纳技术都将被继续用于阐明大脑的秘密,并为人工智能的突破性发展做出贡献。
改编原文:Yangyundou Wang,Jian Lin,Qiming Zhang,Xi Chen,Haitao Luan,Min Gu.Fluorescence nanoscopy in neuroscience [J].Engineering,2022,16(9):29-38.


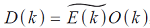 ,其中,O是光学传递函数(OTF),k是空间频率。OTF定义了显微镜可以探测到的空间频率或可观察区域。如图3所示,使用具有不同相位和方向的周期性照明图案的总和,可以在横向和轴向方向上提高所重建的发射物图像的分辨率。
,其中,O是光学传递函数(OTF),k是空间频率。OTF定义了显微镜可以探测到的空间频率或可观察区域。如图3所示,使用具有不同相位和方向的周期性照明图案的总和,可以在横向和轴向方向上提高所重建的发射物图像的分辨率。 。在这里,I是“STED光束”的峰值强度,Ιs是荧光团的饱和强度。为了提高分辨率,由螺旋空间相位调制器或涡旋相位板产生的红移环形STED光束的强度必须满足Ι>Is。换句话说,STED显微镜的分辨率仅由STED光束决定。通过增加STED光束的强度,有效光斑的直径被限制在20 nm的横向分辨率。尽管如此,为了避免光漂白,必须采用合适的染料和自适应照明技术。
。在这里,I是“STED光束”的峰值强度,Ιs是荧光团的饱和强度。为了提高分辨率,由螺旋空间相位调制器或涡旋相位板产生的红移环形STED光束的强度必须满足Ι>Is。换句话说,STED显微镜的分辨率仅由STED光束决定。通过增加STED光束的强度,有效光斑的直径被限制在20 nm的横向分辨率。尽管如此,为了避免光漂白,必须采用合适的染料和自适应照明技术。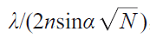 ,其中,N是荧光团位置的光子数。值得一提的是,高质量的STORM图像要求荧光团具有每次切换事件的高光子产量、低开关占空比、高存活率和多个切换周期。在这些特性中,低开关占空比可以最大化荧光密度,这等同于实现奈奎斯特标准允许的最大成像分辨率。然而,激活光不会改变每个开关事件检测到的光子数。
,其中,N是荧光团位置的光子数。值得一提的是,高质量的STORM图像要求荧光团具有每次切换事件的高光子产量、低开关占空比、高存活率和多个切换周期。在这些特性中,低开关占空比可以最大化荧光密度,这等同于实现奈奎斯特标准允许的最大成像分辨率。然而,激活光不会改变每个开关事件检测到的光子数。 ,其中,σ是定位位置,N=n1+n0是在甜甜圈图案中不同位置(r0 和r1)处检测到的光子数。在激活区域内,仅N=600的光子数可以预期一维精度为(σ-1) nm。因此,MINFLUX纳米显微镜的迭代精度超过了基于量子CRB(QCRB)的相机定位的横向精度。
,其中,σ是定位位置,N=n1+n0是在甜甜圈图案中不同位置(r0 和r1)处检测到的光子数。在激活区域内,仅N=600的光子数可以预期一维精度为(σ-1) nm。因此,MINFLUX纳米显微镜的迭代精度超过了基于量子CRB(QCRB)的相机定位的横向精度。