前言
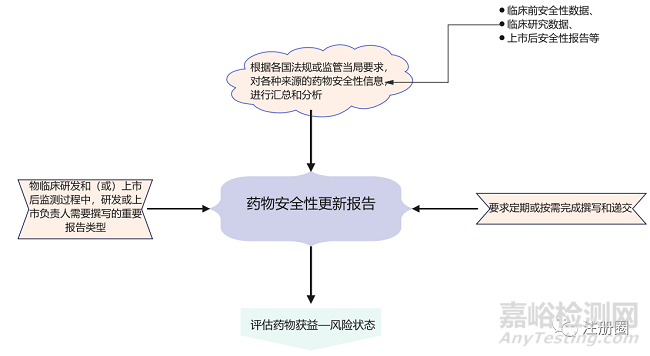
药物安全性更新报告是指根据各国法规或监管当局要求,对各种来源的药物安全性信息,包括临床前安全性数据、临床研究数据、上市后安全性报告等,进行汇总和分析,评估药物获益—风险状态,并按要求定期或按需完成撰写和递交的报告。
由于产品所处的阶段及撰写目的的不同,安全性更新报告有多种类型,主要包括研发期间安全性更新报告(Development Safety Update Report,DSUR),定期安全性更新报告(Periodic Safety Update Report,PSUR)和定期获益-风险评估报告(Periodic Benefit Risk Evaluation Report,PBRER)以及其他安全性更新和总结报告。
一、 安全性更新报告(Development Safety Update Report,DSUR)
(一)各国法规对于撰写和递交的规定区别
(二)DSUR的撰写数据准备
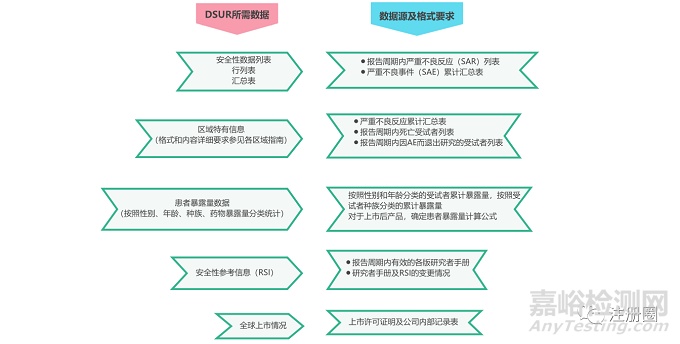

临床研究申请人应根据ICH E2F指南示例,并结合各区域特殊要求进行DSUR的撰写。下图总结出区域特有信息相关要求。
二、 定期安全性更新报告(PSUR)和定期获益—风险评估报告(PBRER)
(一)概念
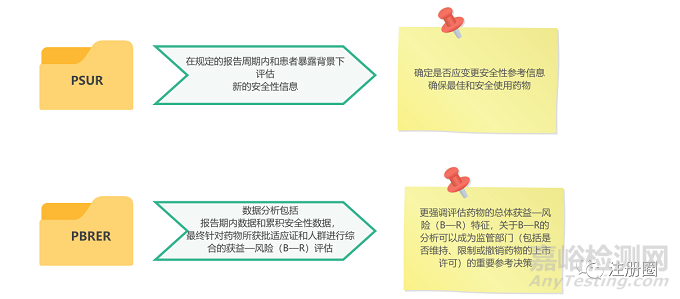
与DSUR对应,PSUR或PBRER是针对获得上市许可的药物需要准备的安全性总结报告。
ICH E2 C(R1)指南和ICH E2 C(R2)指南中有相对应的提交格式、内容和和时间的规定。但是目前各国对于定期上市后安全性报告的递交要求并没有完全统一。
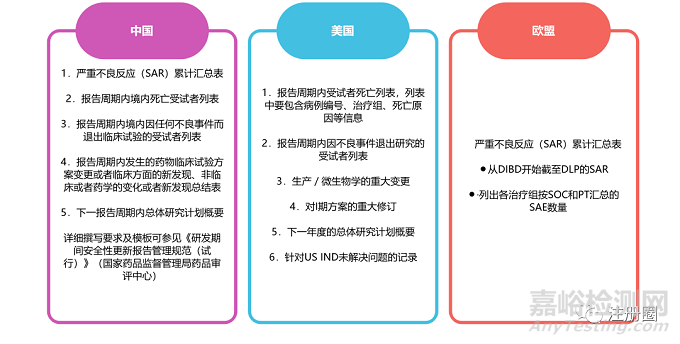
(二)国内外PSUR和PBRER相关法规要求
(三)PBRER区别于PSUR的撰写要求
总体来说,PBRER的撰写基本原则与PSUR相似,包括同一活性成分一份报告的原则、统一数据锁定点的原则等,但PBRER在内容结构和评估方法方面增加了新的要求。
下图是关于安全性信号和风险、获益数据和获益—风险评估这三方面的总结:
产品获得上市许可后,应按照各国上市后法规开始撰写上市后PSUR/PBRER;但如果该产品仍有其他研发项目或新适应症正在进行中,仍需要按照原来的周期继续DSUR的撰写和提交,分别按照IBD和DIBD来确定报告的数据锁定日期,PSUR/PBERE不能替代DSUR。
PSUR和DSUR同时撰写时,如果企业出于数据清理需要,希望能统一数据锁定日期时,需要提前与监管部门沟通,且任何一份报告的周期不低于法规要求的最低周期。
对于附条件批准的上市产品,如条件要求继续进行疗效和安全性炎症的临床研究,也需要根据要求同时撰写DSUR和PSUR/PBRER,直至批件中要求的临床研究完成并获得批准。